卟啉钯配合物催化Suzuki-Miyaura偶联反应的研究
2012-11-10刘岩谢建伟代斌刘平
刘岩,谢建伟,代斌,刘平
(石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室/省部共建国家重点实验室培育基地,石河子832003)
钯催化碳-碳单键的形成反应是有机合成化学研究的重要内容[1]。其中,Suzuki-Miyaura偶联反应是指钯催化下芳香卤代烃与有机硼试剂之间的反应,反应条件温和,已成为制备多种不对称联苯类化合物的重要方法之一。由于有机硼试剂毒性低、稳定性好、适用范围广,易于制备等优点,因此应用最为广泛,一直是构建碳-碳的有效方法,常见于一些药物、天然产物及其精细化工中间体和功能材料的合成中[2-5]。通常,该反应使用膦钯配合物做催化剂[6],但膦配体对空气比较敏感,反应需要在无水无氧的条件下进行,并且C-P键在高温下容易分解,反应后期易析出钯黑[7]。因此,研究对空气、水稳定的钯配合物及避免反应后期析出钯黑的催化剂具有重要的意义。近年来,氮杂环卡宾[8-10]、N、O-or N、N-二齿螯合配体[11-12]等无磷配体的开发对钯催化的Suzuki-Miyaura反应提供了新的机遇。因此,结合本课题组过去的工作[13-20]。本文研究了对水及空气稳定的卟啉钯配合物催化的Suzuki-Miyaura偶联反应。
1 实验部分
1.1 实验仪器与试剂
1H NMR(400 MHz)以TMS为内标,用Bruker-DMX 400型核磁共振仪(CDCl3和 DMSO-d6为溶剂);IR用Thermo Nicolet Nexus智能型中/远红外气相色谱-傅立叶变换红外光谱联用仪(美国Nicolet公司),固体样品用KBr压片法测试;薄层色谱板为青岛海洋化工厂GF254硅胶板;柱层析硅胶(200~300目)为青岛海洋化工厂生产;WRS-1B型数字熔点仪(上海精密科学仪器有限公司,温度未校正);其它化学试剂均为分析纯或化学纯,购自百灵威化学试剂公司、Alfa-Aser公司、阿拉丁化学试剂公司。
1.2 实验方法
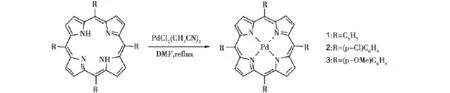
卟啉钯配合物1~3的合成路线如下:
1.3 实验步骤和实验结果
1.3.1卟啉钯配合物的合成
在100 m L三口圆底烧瓶中,加入卟啉配体0.1 mmol和PdCl2(CH3CN)20.5 mmol(130 mg),在磁力搅拌下使其溶于60 m L DMF中,在140℃回流2 h。冷却至室温,将反应液倒入100 m L冰冷的水中,搅拌10 min后放置过夜,有红色沉淀析出。过滤,用大量水洗,所得固体用二氯甲烷溶解,无水硫酸钠干燥,过滤,浓缩,过中性Al2O3柱(CH2Cl2作为淋洗液),真空旋干,即得产品。
1:红色固体,产率75%,1H NMR(400 MHz,CDCl3):δ8.81(s,8 H),8.17(d,J= 6.4 Hz,8H),7.75~7.73 (m,12 H).IR(KBr,cm-1):3050.67,3022.41,1596.77,1541.09,1508.63,1458.91,1440.46,1351.25,1072.53,1013.36,791.48,751.87,701.66。
2:红色固体,产率90%,1H NMR(400 MHz,CDCl3):δ8.80(s,8H),8.08(dd,J1= 2.0 Hz,J2=6.4 Hz,8H),7.73 (dd,J1= 2.0 Hz,J2=6.4 Hz,12 H).IR(KBr,cm-1):1560.42,1541.50,1486.73,1352.09,1091.64,1012.54,806.51,795.15,716.12。
3:红色固体,产率83%,1H NMR(400 MHz,CDCl3):δ8.83(s,8 H),8.07(d,J= 8.4 Hz,8 H),7.27(d,J= 8.4 Hz,8H),4.09(s,12 H).IR(KBr,cm-1):3030.59,2929.49,1605.67,1573.73,1505.16,1459.80,1439.81,1352.70,1287.59,1246.51,1174.64,811.15,799.23,714.17。
1.3.2卟啉钯催化Suzuki-Miyaura交叉偶联反应
在20 m L Schlenk瓶中依次加入溴代芳烃(0.50 mmol)、芳基硼酸(0.75 mmol)、配合物 3(0.1 mol%)、K3PO4·3H2O(1.20 mmol)和2.0 m L甲苯。将反应器放入已预热到100℃的油浴中,反应8 h后冷却到室温。将反应液倒入50 m L单口圆底烧瓶中,用乙酸乙酯洗涤Schlenk瓶(5×2 m L),将洗涤液合并移入到上述50 m L单口圆底烧瓶中。浓缩,硅胶拌样,硅胶柱层析分离得纯品6a~6k(石油醚作为淋洗液)。
目标化合物的结构表征如下:
(1)6a:(4-甲氧基联苯)。1H NMR(400 MHz,CDCl3):δ7.54(t,J = 8.8 Hz,4H),7.41(t,J =7.6 Hz,2H),7.23(t,J= 7.6 Hz,1H),6.97 (d,J= 8.8 Hz,2H),3.85(s,3H)。
(2)6b:(4-乙 酰 联 苯)。1H NMR(400 MHz,CDCl3):δ8.04(d,J= 8.4 Hz,2H),7.69(d,J= 8.4 Hz,2H),7.63(d,J= 7.2 Hz,2H),7.48(t,J= 7.2 Hz,2H),7.41(t,J= 7.2 Hz,1H),2.65(s,3H)。
(3)6c:(4-甲基联 苯)。1H NMR(400 MHz,CDCl3):δ7.55(d,J = 7.2 Hz,2 H),7.46(d,J =7.2 Hz,2H),7.39(t,J = 7.2 Hz,2 H),7.29(d,J= 7.2 Hz,2 H),2.37(s,3H)。
(4)6d:(2-甲 基 联 苯)。1H NMR(400 MHz,CDC13):δ7.44~7.38(m,2 H,Ar H),7.38~7.30(m,3 H,Ar H),7.30~7.20(m,4 H,Ar H),2.28(s,3 H,CH3)。
(5)6e:(4-氟 联 苯)。1H NMR(400 MHz,CDCl3):δ7.56~7.53(m,4H),7.43(t,J = 7.6 Hz,2H),7.34(t,J = 7.2 Hz,1 H),7.13(t,J =8.4 Hz,2H)。
(6)6f:(4-甲氧 基-4′-氟 联 苯)。1H NMR(400 MHz,CDC13):δ7.44~7.39(m,4 H),7.03(t,J=8.8 Hz,2H),6.90(d,J= 8.8 Hz,2H),3.84(s,3 H)。
(7)6g:(4-乙 酰 基-4′-氟 联 苯)。1H NMR(400 MHz,CDC13):δ7.96(d,J= 8.4 Hz,2H),7.57(d,J=8.4 Hz,2H),7.53(dd,J1=5.2 Hz,J2=8.8 Hz,2H),7.08(t,J=8.8 Hz,2H),2.58(s,3H)。
(8)6h:(4-氟-4′-甲 基 联 苯)。1H NMR(400 MHz,CDCl3):δ7.54-7.50 (m,2 H),7.43(d,J=8.0 Hz,2 H),7.24(d,J = 8.0 Hz,2 H),7.14~7.08(m,2H),2.39(s,3 H)。
(9)6i:(4-甲氧基-4′-甲基联苯)。1H NMR(400 MHz,CDC13):δ7.27(d,J=8.8 Hz,2 H),7.21(d,J= 8.0 Hz,2H),6.99(d,J= 8.0 Hz,2 H),6.73(J= 8.8 Hz,2 H),3.62(s,3 H),2.15(s,3 H)。
(10)6j:(4-乙酰基-4′-甲基联苯)。1H NMR(400 MHz,CDCl3):δ7.89(d,J= 8.7 Hz,2 H),7.63(d,J= 8.7 Hz,2H),7.50(d,J= 7.9 Hz,2H),7.24(d,J= 7.9 Hz,2 H),2.60(s,3H),2.38 (s,3 H)。
(11)6k:(4,4′-二 甲 基 联 苯)。1H NMR(400 MHz,CDC13):δ7.40(d,J=8.0 Hz,4 H),7.16(d,J=8.0,4H),2.32(s,6H)。
2 结果与讨论
本文选用4-甲氧基溴苯和苯硼酸的Suzuki-Miyaura交叉偶联作为模型反应,考察了配合物1~3及用量和其它因素如碱、溶剂、温度对反应的影响。
2.1 碱、溶剂和温度对Suzuki-Miyaura偶联反应的影响
其反应式如下,反应条件为对溴苯甲醚0.50 mmol,苯硼酸 0.75 mmol,K3PO4·3H2O 1.5 mmol,1-3(1 mol%),8 h。碱、溶剂和温度对Suzuki-Miyaura偶联反应的影响结果见表1。
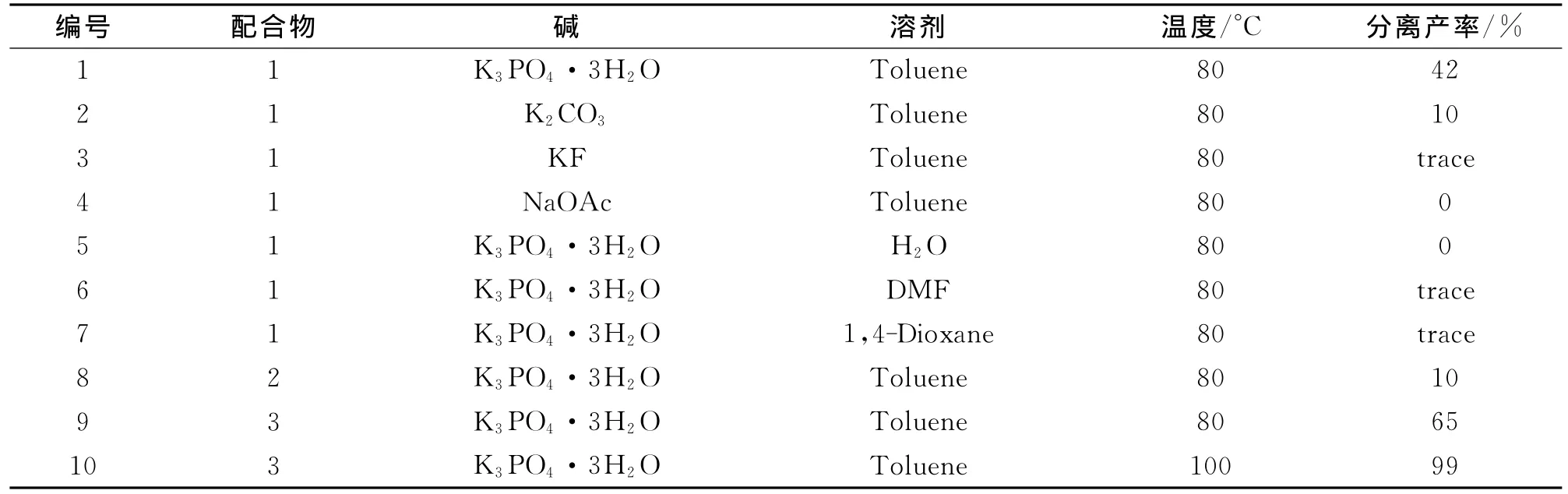
表1 碱,溶剂和温度对Suzuki-Miyaura偶联反应的影响Tab.1 Screening of the base,solvent and temperature for the Suzuki-Mayaura reaction
由表1可知:在配合物1的催化下,以甲苯为溶剂,首先考察了碱对偶联反应的影响,其中K2CO3仅给出10%的产率 (编号2);而KF和NaOAc几乎是不反应 (编号3和4);K3PO4·3 H2O的效果是最好的,但也只有42%的产率 (编号1)。这可能与催化剂自身的催化活性有关,也可能是与各种碱在甲苯中的溶解度较低有关。当用极性较大的DMF和二氧六环为溶剂时,只有微量的偶联产物生成(编号6和7);以水作溶剂,此反应不能顺利进行(编号7),这可能是因为催化剂不溶于水。
配合物1~3的催化活性顺序为3>1>2(编号1、8和9)。这可能是由于配合物3的卟啉环连有供电子基团的甲氧基,使得二价钯更容易被苯硼酸还原生成零价卟啉钯(0),从而更有利于溴代芳烃与零价卟啉钯(0)的氧化加成反应的进行。
在最佳催化剂配合物3的催化下,温度对偶联反应具有较大的影响(编号9和10)。这可能是由于:(1)随着温度上升,溶解度都增大,改善了反应的传质状态;(2)温度上升提高反应的动力学速度,在相同的时间内产率较高,反应温度100℃,8 h内产率达99%,并且没有钯黑析出。
2.2 催化剂量对Suzuki-Miyaura偶联反应的影响
在配合物3催化的Suzuki-Miyaura偶联反应中,反应条件为4-甲氧基溴苯0.50 mmol,苯硼酸0.75 mmol,K3PO4·3H2O 1.5 mmol,甲苯2 m L,100℃,8 h。
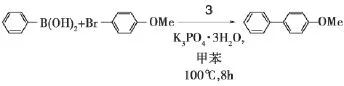
催化剂量对反应的影响结果见表2。
由表2可知:随着催化剂量的降低 (1.0~0.01 mol%),产率变化并不明显,均在94%以上(编号1-3)。但当催化剂量降低到0.001 mol%时,产率也能够达到60%,TON值可高达6×104,TOF值为7500,并且没有钯黑析出。说明催化剂3具有较好的热稳定性和较高的催化活性。
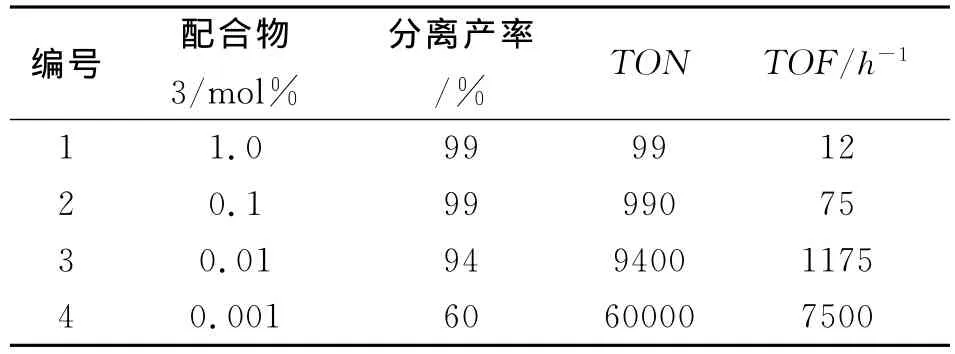
表2 催化剂用量对Suzuki-Miyaura偶联反应的影响aTab.2 Screening of the amount of complex 3 for the Suzuki-Miyaura reaction
通过反应条件的优化可知,模型反应的最佳反应条件为:4-甲氧基溴苯 (0.50 mmol),苯硼酸(0.75 mmol),K3PO4·3 H2O (1.50 mmol),3(0.1 mol%),甲苯 (2.0 m L),反应温度100℃。
2.3 配合物3催化的Suzuki-Miyaura偶联反应
在建立模型反应的最优反应条件后,进一步研究了甲苯中配合物3催化Suzuki-Miyaura交叉偶联反应的底物适用范围。反应条件为芳基溴代物0.50 mmol,芳基硼酸0.75 mmol,K3PO4·3H2O 1.5 mmol,配合物3(0.1%),甲苯2 m L,100℃,8 h,结果见表3。
从表3发现:配合物3在甲苯中可以催化不同底物的Suzuki-Miyaura交叉偶联反应。苯环的4-位连有吸电子基团的溴代芳烃很易进行反应(如4-溴苯乙酮),它与各种芳基硼酸反应的产率都很高(编号2、10),但与4-氟苯硼酸反应产率仅有40%(编号7)。苯环4-位连有供电子基团时,溴代芳烃的Suzuki偶联反应仍然能够获得较高的收率,如4-甲基溴苯与芳基硼酸的反应产率也可达到99%、96% 和98% (编号1、3、11)。苯环的2-位连有甲基时,产率达85% (编号4)。
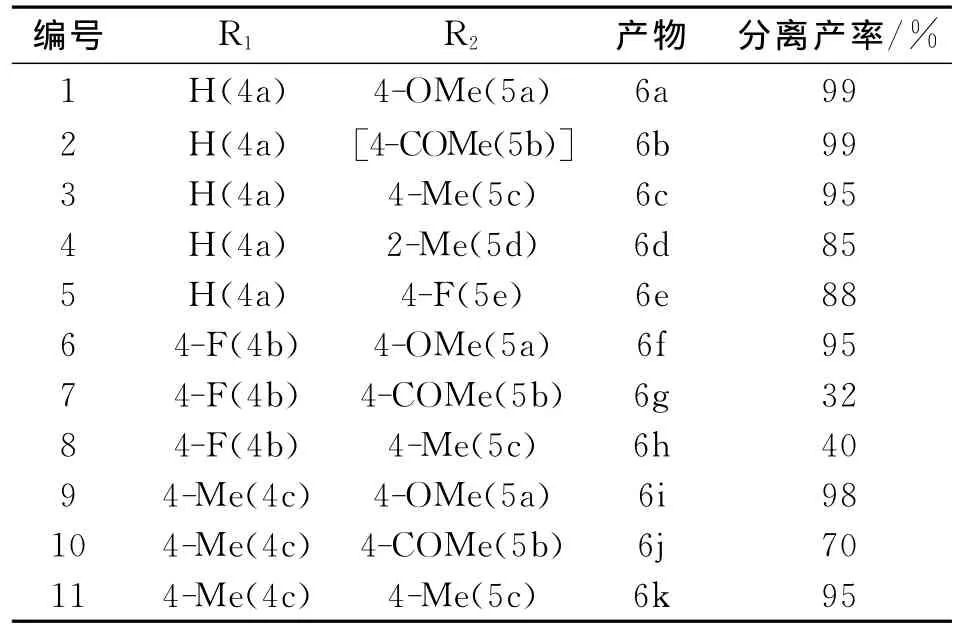
表3 配合物3催化Suzuki-Miyaura交叉偶联反应的底物研究aTab.3 Complex 3 catalyzed Suzuki-Miyaura reaction between different aryl halides and arylboronic acid
3 结论
(1)卟啉钯配合物3能在空气中、以甲苯为介质有效地催化溴代芳烃参加Suzuki交叉偶联反应,最佳反应条件为:溴代芳烃 (0.50 mmol),芳基硼酸(0.75 mmol),催化剂为配合物3(0.1 mol%,相对于溴代芳烃),碱为 K3PO4·3 H2O (1.20 mmol),反应溶剂为甲苯 (2.0 m L),反应温度为100℃。
(2)该催化体系底物适用范围较广,偶联反应最高产率可达99%,TON值最高可达到6×104。
(3)反应过程中没有钯黑析出,这可能是因为卟啉四氮配体对催化反应活性物种零价钯具有很好配位能力和稳定作用,使得催化剂保持着较高的催化活性。
[1]Nabor M F,Nguyen H T,Destrade C,et al.Synthesis and ferroelectric properties of laterally substituted fluoro liquid crystals derived from 4-mercaptobenzoic acid[J].Liq Cryst,1991,10(6):785-797.
[2]Hird M,Gray G W,Toynec K J.Smectic liquid-crystalline phases of F(CF2)7(CHOH)(CH2)8H and F(CF2)9(CHOH)(CH2)10H Comparison with other partially fluorinated molecules[J].Liq Cryst,1992,12(4):531-544.
[3]Tang W,Zhang X.New chiral phosphorus ligands for enantioselective hydrogenation[J].Chem Rev,2003,103(8):3029-3069.
[4]Andersen N G,Keay B A.2-Furyl phosphines as ligands for transition-metal-mediated organic synthesis[J].Chem Rev,2001,101(4):997-1031.
[5]Bessel C A,Aggarwal P,Marschilok A C,et al.Transition-metal complexes containing trans-spanning diphosphine ligands[J].Chem Rev,2001,101(4):1031-1066.
[6]Suzuki A.Metal-Catalyzed Cross-Coupling Reactions[M].Wiley-VCH:Weinheim,1998:49.
[7]Kotha S,Lahiri K,Kashinath D.Recent applications of the Suzuki-Miyaura cross-coupling reaction in organic synthesis[J].Tetrahedron,2002,58(48):9633-9685.
[8]Navarro O,Marion N,Oonishi Y,et al.Suzuki-Miyaura,a-ketone arylation,and dehalogenation reactions catalyzed by a versatile N-heterocyclic carbene-palladacycle complex[J].J Org Chem,2006,71(2):685-692.
[9]Shi M,Qian H X.A new dimeric bidentated NHC-Pd(II)complex from trans-cyclohexane-1,2-diamine for Suzuki reaction and Heck reaction[J].Tetrahedron,2005,61(21):4949-4955.
[10]Wang A E,Zhong J,Xie J H,et al.Highly efficient Suzuki cross-coupling catalyzed by palladium/phosphineimidazolium carbene system[J].Adv Synth Catal,2004,346(6):595-598.
[11]Mino T,Shirae Y,Sakamoto M,et al.Phosphine-free hydrazone-Pd complex as the catalyst precursor for a Suzuki-Miyaura reaction under mild aerobic conditions[J].J Org Chem,2005,70(6):2191-2194.
[12]Botella L,Nájera C.A convenient oxime-carbapalladacycle-catalyzed Suzuki cross coupling of aryl chlorides in water[J].Angew Chem(Int Ed),2002,41(1):179-181.
[13]Liu P,Zhou L,Li X G,et al.Bis(imino)pyridine palladium(II)complexes:Synthesis,structure and catalytic activity[J].J Organomet Chem,2009,694(14):2290-2294.
[14]Liu P,Zhang W Z,He R.Preparation and catalytic properties of bis(imino)pyridine palladium(II)complexes as efficient catalysts for Suzuki cross-coupling reaction in water[J].Appl Organometal Chem,2009,23(4):135-139.
[15]Liu P,Feng X-J,He R.Salen and half-salen palladium(II)complexes:Synthesis,characteriztion and catalytic activity toward Suzuki-Miyaura reaction[J].Tetrahedron,2010,66(3):631-636.
[16]Liu P,Yan M,He R.Bis(imino)pyridine palladium(II)complexes as efficient catalysts for Suzuki-Miyaura reaction in water[J].Appl Organometal Chem,2010,24(2):131-134.
[17]Liu Y,Wang J.Synthesis of 4-substituted styrene compounds via palladium catalyzed Suzuki-Miyaura reaction using bidentate Schiff base ligands[J].Appl Organometal Chem,2009,23(11):476-480.
[18]Liu Y,Wang J.Synthesis of 4-substituted styrene compounds via palladium catalyzed Suzuki coupling reaction using free phosphine ligand in air[J].Synth Commun,2010,40(2):196-205.
[19]东世宏,马瑞,王丹,等.高沸点溶剂脱除棉酚新工艺的研究.石河子大学学报:自然科学版,2011,29(2):236-239.
[20]程喜梅,武春阳,徐龙龙,等.介质阻挡放电降解废水中的硝基苯的研究.石河子大学学报:自然科学版,2010,28(2):211-214.
