局部注射Neuritin促进骨折愈合的实验研究
2012-11-10刘京敏史晨辉王维山孙益明彭方亮张杰董金波
刘京敏,史晨辉,王维山,孙益明,彭方亮,张杰,董金波
(石河子大学医学院第一附属医院骨一科,石河子832000)
Neuritin是以色列科学家Nedivi发现的可促进神经突起的快速生长的一种神经营养因子。研究显示,Neuritin可以稳定树突棘上突触的活性,促进突触成熟[1]。另外,Neuritin在血管领航和网络形成中的轴突向导作用[2],且作为一种新型血管生长因子在机体中起作用[3]。研究发现,在脑外伤合并骨折模型中,其血清中Neuritin的含量较正常大鼠及单纯骨折的大鼠明显升高。据此,我们推测Neuritin因子可能在脑外伤后骨折愈合加速过程中起着极其重要的作用。为了验证Neuritin在骨折愈合中的重要作用,本实验研究拟采用骨折断端局部注射方法,观察Neuritin在SD大鼠骨折模型中促进骨折愈合的作用。
1 材料与方法
1.1 材料
实验在石河子大学医学院第一附属医院动物实验室完成,采用健康成年雄性S-D大鼠96只,体重(275±25)g,由新疆动物实验中心提供。Neuritin重组蛋白购自美国sigma公司(生产日期:2011-01-03,批号:ab69775)。柯达DR3500摄片机(柯达公司,日本);佳能A80数码照相机(佳能公司,日本);Leica2135型石蜡切片机 (莱卡,德国);电钻、直径1 mm克氏针(石河子大学医学院第一附属医院提供)。
1.2 方法
1.2.1大鼠股骨骨折模型建立及试验方法
将96只大鼠随机分为对照组、实验A、B、C组,每组24只。采用浓度为100 g/L的水合氯醛按照体重(300 mg/kg)进行腹腔注射麻醉,无菌条件下取右侧股骨外侧切口,纵行切开约2 cm,显露股骨中段,切断前用游标卡尺测量切断处股骨直径,截断后选择直径为1 mm克氏针髓腔内固定,术后应用青霉素钠肌注,连续7 d,分笼喂养允许自由活动。实验A、B、C组于术后第3 d开始,在大鼠骨折断端局部分别注射浓度为0.1、0.05、0.025μm/L的 Neuritin溶液0.3 m L,每日1次,连续注射7 d[11];对照组于大鼠骨折断端注射0.3 m L的生理盐水。各组分别于术后1、2、4周分期采用颈椎脱臼法处死8只大鼠,并于骨折部位取材。
1.2.2大体观察、骨痂体积测量、骨痂病理学检测(HE染色)
动物处死前先行X线拍片观察骨折愈合影像学观察。处死后行取出骨折断端的骨痂标本,肉眼观察其大体骨痂生长情况和骨折愈合情况,以骨痂Nords-letten X线评分标准评分,剔除骨痂周围组织,采用Perkins骨痂体积测量公式:2πR1(R2-R1)L测量各组骨痂体积,其中R1表示股骨半径,R2表示骨痂半径,L表示骨痂长度。保留骨痂两侧各约1 cm骨组织截骨,常温下4%的多聚甲醛固定24 h后,再用蒸馏水浸泡4 h,最后经EDTA-2Na脱钙4~6周。常规脱水石蜡包埋、切片。光镜下观察新生骨小梁、软骨细胞、成骨细胞和骨重塑等细胞组织学形态变化。以骨痂组织学评分方法评分。
1.2.3统计学分析
2 结果
2.1 大体标本观察
观察结果见表1。
由表1可知:1周时各组之间骨痂形成不明显。2周时对照组断端机化组织明显增多,但是局部未见骨痂组织;B组、C组可见中大量肉芽组织生长,骨痂周径增粗膨大,组间相差不大,但均少于A组。4周时对照组局部出现略小的梭型骨痂,部分纤维骨痂未完整连接。实验A组骨痂触之质硬,见骨性骨痂形成,部分甚至已骨化。实验B组、C组介于两者之间。骨痂体积测量显示,实验各组明显大于对照组(P<0.05),在2、4周时实验A组明显大于其余各组(P<0.05)。
表1 骨痂体积测量值及统计结果STab.1 Measurement and statistical results of callus volume

表1 骨痂体积测量值及统计结果STab.1 Measurement and statistical results of callus volume
注:△与实验A组比较(P<0.05),◇与实验B组比较(P<0.05),□与实验C组比较(P<0.05),○与对照组比较(P<0.05)。
组别 时间/d 7 14 28对照组 2.06±0.05△ 10.06±0.12△◇□ 89.53±0.59△◇□实验 A组 3.73±0.35○ 57.07±3.13◇□○166.28±3.82◇□○实验B组 2.66±0.23 38.68±1.61△○ 130.52±1.19△□○实验C组 2.17±0.07 18.32±1.04△○ 109.66±0.71△◇○
2.2 X线摄片观察
结果如图1所示。
图1显示:1周时对照组、实验B组、C组骨折线清晰可见,断端周围未见明显骨痂组织,实验A组断端亦可见骨折线,但有少量骨痂形成;2周时对照组骨折线仍然清楚,骨折断端未见明显的骨痂形成。实验A组、B组、C组骨折线开始模糊,部分骨痂包绕在骨折断端,但实验A组最为明显;4周时对照组骨折线开始模糊,有较少量骨痂形成,A组有大量骨痂生长,骨折线开始模糊甚至消失。
根据骨痂Nordsletten X线评分标准,结果见表2。
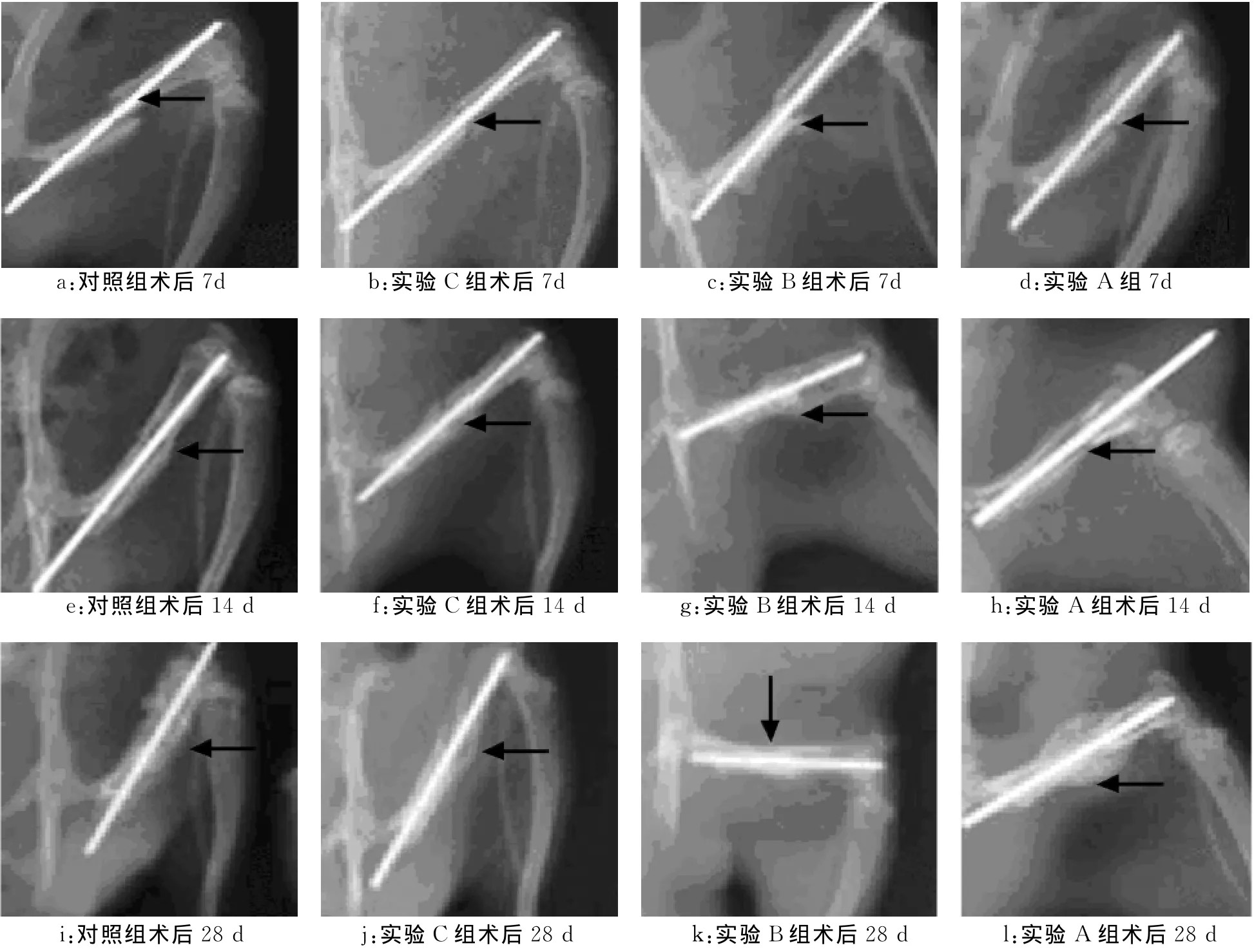
图1 术后各组各时间点X线片观察Fig.1 X-ray observation at different time points after operation
表2 骨痂X线评分及统计结果STab.2 Grade and statistical results of callus X-ray

表2 骨痂X线评分及统计结果STab.2 Grade and statistical results of callus X-ray
注:△与实验A组比较(P<0.05),◇与实验B组比较(P<0.05),□与实验C组比较(P<0.05),○与对照组比较(P<0.05)。
7 14 28对照组 0 0.86±0.64△◇□ 1.25±0.46组别 时间/d△◇□实验 A组0.88±0.64◇□○2.25±0.71◇□○ 2.75±0.46◇□○实验B组 0.62±0.74△○ 1.88±0.64△□○ 2.37±0.92△□○实验C组 0.63±0.52△○ 1.62±0.52△◇○ 2.25±0.89△◇○
2.3 HE染色
结果见图2。
由图2可见:1周时对照组可见骨折端纤维母细胞自骨膜下长入骨折间隙,并夹杂少量成骨细胞;实验A组成骨细胞数量较单纯骨折组增多,骨折端见大量肉芽组织连接,并有纤维骨痂生成。2周时实验各组骨折断端软骨性骨痂增多,实验A组可见新生骨小梁长入。4周时对照组骨折端出现大量软骨骨痂和骨性骨痂,但纤维母细胞减少,纤维性骨痂减少,实验A组骨小梁形成骨性骨痂并连接断端,骨折端为结构均一的编织骨痂,成骨细胞活跃,骨膜增厚明显。
软骨细胞骨化评分结果见表3。
表3 软骨细胞骨化评分及统计结果STab.3 Grade and statistical results of chondrocytes in ossification
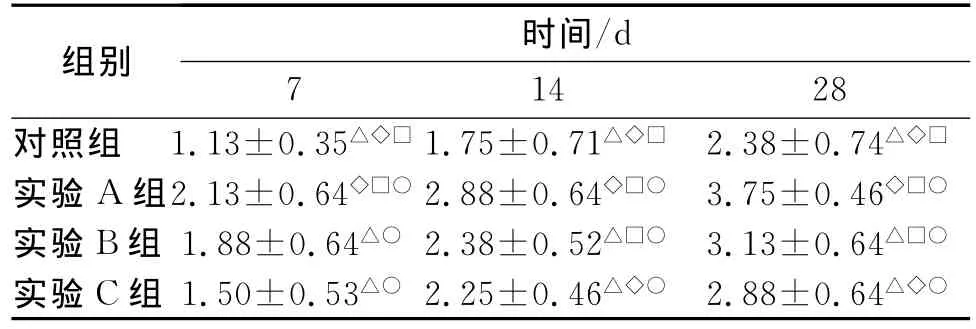
表3 软骨细胞骨化评分及统计结果STab.3 Grade and statistical results of chondrocytes in ossification
注:△与实验A组比较(P<0.05),◇与实验B组比较(P<0.05),□与实验C组比较(P<0.05),○与对照组比较(P<0.05)。
组别 时间/d 7 14 28对照组 1.13±0.35△◇□1.75±0.71△◇□ 2.38±0.74△◇□实验 A组2.13±0.64◇□○2.88±0.64◇□○ 3.75±0.46◇□○实验B组 1.88±0.64△○ 2.38±0.52△□○ 3.13±0.64△□○实验C组 1.50±0.53△○ 2.25±0.46△◇○ 2.88±0.64△◇○
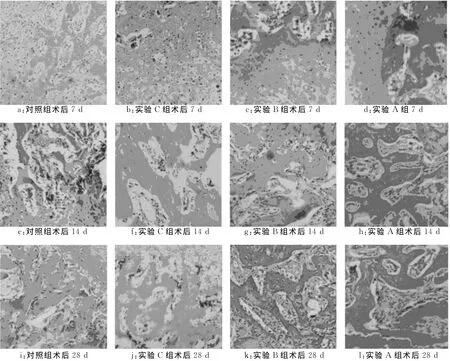
图2 术后各组个时间点组织学观察(HE×40)Fig.2 Histological observation at different time points after operation(HE×40)
3 讨论
临床实践发现,四肢骨则患者若同时合并有脑外伤,其骨折愈合速度明显快于单纯四肢骨折患者,骨痂过度生长,甚至在肌肉中出现异位骨化。Boes等[4]证实合并脑外伤的大鼠股骨干骨折愈合时间明显短于单纯股骨干骨折者,其骨痂数量较对照组明显增多。但是其具体机制尚不明确,如果能揭示这一现象的原因,将为临床中骨不连、骨缺损等难治性骨创伤疾病的治疗带来希望。
大量研究证实在骨组织中有神经纤维存在,有许多无髓和有髓神经纤维支配骨膜、骨组织和骨髓[5],在骨的愈合修复过程中伴随有神经纤维长人骨痂,在长骨骨不连断端组织中几乎没有神经纤维支配,这些说明骨痂中有无神经纤维长人及神经纤维的多少与骨折修复愈合的关系密切。因此,在骨折愈合过程中,神经支配和调节起着重要作用,例如,脑外伤病人骨折愈合明显加快,而骨折修复愈合过程中,局部骨生长因子或细胞因子起主要作用,包括有BMP、VEGF、PDGF、FGF、NGF等。彭吾训等[6]研究发现,双相陶瓷生物骨(BCBB)、骨形态发生蛋白(BMP)和碱性成纤维细胞生长因子 (basic fibroblast growth factor,b FGF)复合物具有较强的成骨能力。莫勇军等[7]通过动物实验观察到,局部应用NGF对大鼠骨折愈合有促进作用,高浓度的NGF对骨折愈合有显著促进作用。而Neuritin作为神经营养因子家族的一个新的成员,可促进神经细胞树突和轴突的生长和分支,以及调节神经元回路的形成,在神经再生和可塑性中起着重要作用[8]。同时,Neuritin还能促进血管内皮细胞的增殖、粘附能力,促进血管形成,并且,Neuritin在神经损伤的修复过程中起着重要的作用[9]。魏勇等[10]研究发现,脑外伤合并骨折病人血清中NGF、Neuritin表达明显高于对照组,说明与骨折有密切的相关性,两种因子可能在骨折愈合中共同起作用。我们前期研究已证实,在脑外伤合并骨折的大鼠模型,其血清中Neuritin含量明显升高[11],这说明,Neuritin与骨折愈合能力成正比,并呈现明显的正相关性。据此,我们推测Neuritin可能是参与骨折愈合过程中一个重要的神经因子。因此,本实验我们通过在大鼠骨折断端局部注射Neuritin发现,大鼠骨折愈合速度明显加快,我们猜想这可能是Neuritin通过以下途径实现:诱导神经纤维长入;增加了骨折断端血液供应;定位于胞浆中[12]与多种神经神经营养因子协同作用及调节相关基因促进骨折愈合等。
本实验同时还采用不同浓度梯度的Neuritin对SD大鼠骨折端进行干预,通过大体观察及影像学检查结果显示,术后1周空白对照组无骨痂形成,随着时间的延长,逐渐出现少量骨痂。同时实验各组随时间延长,亦出现骨痂快速增多,骨折线逐渐模糊,甚至部分已骨化,在同一时间点上实验各组变化均比对照组明显,实验组之间比较A组变化更加显著,B组、C组次之,这表明A组在加速骨痂形成及新生骨痂成熟方面效果显著。组织学观察结果显示,对照组在1周时软骨细胞骨化极少,随着时间的延长,逐渐出现少量骨化组织,而实验组从1周到4周,软骨细胞明显增多,软骨化骨的比率逐渐增高,而且实验各组均比对照组变化明显;在同一时间点上,实验各组之间比较A组较B组、C组变化更加显著,这表明A组在促进骨痂形成、成熟及加速骨折愈合方面明显优于其他组。上述各项检测指标均显示,在适宜的浓度范围内,Neuritin浓度越高,其促进骨折愈合越能达到最佳效果,即在加速骨痂形成及新生骨痂成熟方面效果显著。
综上所述,局部应用Neuritin对大鼠骨折愈合有促进作用,低浓度梯度的Neuritin促进作用不明显,高浓度梯度的Neuritin有明显促进作用,但是由于Neuritin在体内的含量目前仍缺乏实验证据,在选择Neuritin剂量时也没有明确的标准,导致本实验选择Neuritin的浓度梯度有一定局限性,尚未确定促进大鼠骨折愈合的最佳有效浓度,本研究意在通过动物实验,初步验证Neuritin的作用,以及是否存在剂量相关性;因此,是否有更佳的有效治疗浓度,仍有待进一步研究。
[1]Tadahiro Fujino,Jennifer H,Leslie,Ronen Eavri,et al.CPG15 regulates synapse stability in the developing and adult brain[J].Genes Dev,2011,25(21):2674-2685.
[2]Le Jan S,Le Meur N,Cazes A,et al.Characterization of the expression of the hypoxia-induced genes neuritin,TXNIP and IGFBP3 in cancer[J].FEBS Lett,2006,580(14):3395-3400.
[3]Dingding Han,Bo Qin,Guoqing Liu,et al.Characterization of neuritin as a novel angiogenic factor[J].Biochemical and Biophysical Research Communications,2011,15(4):608-612.
[4]Boes M,Kain M,Kakar S,et al.Osteogenic effects of traumatic brain injury on experimental fracture-healing[J].Bone Joint Surg Am,2006,88(4):738-743.
[5]Micera A,Lambiase A,Aloe L,et al.Nerve grow th factor involvement in the visual system:implications in allergic and neuro degenerative diseases [J].Cytokine Growth Factor Rev,2004,15(6):411-417.
[6]彭吾训,王蕾,邓进,等.BCBB/BMP/bFGF复合物修复股骨头坏死模型的成骨观察[J].中国现代医学杂志,2010,20(19),2917-2921.
[7]莫勇军,杨志,苏伟,等.NGF促进骨折愈合的适宜浓度初步研究[J].中国修复重建外科杂志,2011,25(5):575-581.
[8]Di Giovanni S,Faden A I,Yakovlev A,et al.Neuronal plasticity after spinal cord injury:identification of a gene cluster driving neurite outgrowth[J].FASEB J,2005,19(1):153-154.
[9]聂琨,黄瑾,高蕊.大鼠脑缺血再灌注损伤后脑皮层神经突起生长素(neuritin)表达变化的研究[J].石河子大学学报(自然科学版),2012,2(30):210-214.
[10]魏勇,董金波,李长俊,等.NGF与Neuritin在脑外伤伴四肢骨折病人血清中的表达及意义[J].现代生物医学进展,2011,11(19):3683-3686.
[11]彭方亮,董金波,吴迎波,等.Neuritin在大鼠脑外伤合并骨折过程中的作用研究[J].现代生物医学进展,2011,11(15),2854-2857.
[12]罗星,徐坚,黄瑾.人Neuritin真核表达载体的构建及其在细胞中的定位[J].中国现代医学杂志,2011,21(28),3495-3498.
