PtSnFe/C催化剂的制备、表征及其对乙醇电化学氧化的催化活性
2012-11-10高晓玲朱明远代斌
高晓玲,朱明远,代斌
(石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室,石河子832003)
由于乙醇的天然存在性、无毒,是一种可再生能源,使得直接乙醇燃料电池(DEFCs)开始引起人们的研究兴趣[1]。但乙醇完全氧化涉及到12个电子的转移,同时需要C-C键的断裂,使乙醇电催化氧化机理较为复杂,而且由于阳极电催化剂容易被乙醇电氧化过程中生成的类CO物质毒化等问题,因此,提高催化剂对乙醇的电化学氧化活性是目前直接乙醇燃料电池发展的最重要的任务[2]。
对于DEFC阳极电催化剂,其研究主要集中在Pt Ru/C和PtSn/C 两种催化剂上[3-9]。近年来,为了研究能够得到氧化性能更好的催化剂,PtSn M/C三元催化剂的研究备受关注。Ribeiro等[10]发现Ir的引入导致了PtSn合金晶格常数的收缩,提高了对EOR的催化活性,PtSnIr/C中的Ir Ox能够减弱中间物质在电催化剂表面的毒化作用。Antolini等[11-12]发现,三元 PtSnRu/C电催化剂中存在 PtSn合金、Ru O2和Sn O2物质,其中Pt∶Sn∶Ru原子比为1∶1∶0.3的催化剂可以获得最佳对EOR的催化活性,并且还发现PtSnRh/C对EOR的催化活性高于PtSn/C电催化剂,Rh的引入有利于乙醇分子中C-C键的断裂。Spinace等[13]制备出的三元PtSnNi/C电催化剂,其Pt∶Sn∶Ni原子比为5∶4∶1,该催化剂的测试结果均表明,PtSn Ni/C对EOR的催化活性在整个电位扫描区都高于PtSn/C电催化剂。
由于FeSO4在乙二醇溶液中,加热到180℃时,FeSO4会发生水解反应,生成Fe2O3的纳米粒子。同时,在负载Pt和Sn的过程中,具有很多空置d轨道的Pt原子会把电子转移至Fe2O3表面,稳定的正电Pt原子对Fe2O3其有较强的约束力,从而形成具有核壳结构的催化剂。为了进一步提高EOR的催化活性,本文掺入了Fe,对PtSn Fe[14]三元催化剂进行了研究。
1 实验部分
1.1 催化剂的制备
以氯铂酸、氯化亚锡、Fe2O3为前驱体,碳黑(XC-72,Cabot,比表面积250 m2/g)[15]为载体,采用乙二醇还原法(EG 法)[9]制备 Pt/C(Pt 20%,C 80%),Pt Fe/C(Pt 20%,Fe2O39.02%,C 70.98%,PtSn/C (Pt 20%,Sn 4.06%,C 75.94%),PtSn Fe/C(Pt 20%,Sn 4.06%,Fe2O39.02%,C 66.92%)的催化剂。
主要试剂见表1。

表1 主要试剂Tab.1 Main reagents
(1)将75.94 mg C粉和50 m L乙二醇混合超声分散成均匀的C浆,在搅拌过程中快速加入5.3 m L氯铂酸(H2PtCl6,1.93×10-2mol/L)和 1.5 m L SnCl2到三口烧瓶中,并加入2 m L NaOH(q乙二醇,1 mo L/L)溶液调节p H=11,室温下搅拌5 min,回流并加热至130℃,恒温搅拌4 h,降温至60℃。加入2 m L HCl(1.5 mol/L)溶液和50 m L蒸馏水,调节p H=4,搅拌过夜,降至室温。抽滤、洗涤、干燥,制得催化剂标记为PtSn/C。Pt/C和Pt-Fe/C催化剂的制备采用类似的方法。
(2)将28.5 mg FeSO4,50 m L乙二醇和1 m L蒸馏水于三口烧瓶中,回流并加热至180℃,恒温搅拌4 h,降至室温,搅拌过夜。加66.92 mg用乙二醇超声分散均匀的C浆,50 m L蒸馏水,1.5 m L SnCl2(5.26 mg/m L)溶液,加入 NaOH (q乙二醇,1.5 mo L/L)溶液调节p H=11,搅拌5 min,加入5.3 m L氯铂酸 (H2PtCl6,1.93×10-2mol/L),回流并加热至130℃,恒温搅拌4 h,降温至60℃。加入2 m L HCl(1.5 mol/L)溶液和50 m L蒸馏水,调节p H=4,搅拌过夜,降至室温。抽滤、洗涤、干燥,制得催化剂标记为PtSnFe/C。
1.2 催化剂表征
X-射线衍射实验,采用德国布鲁克公司生产的Advanced D8型X-射线衍射仪进行。Cu-Kα为射线源,λ=1.54056Å,Ni为滤波,扫描速度为0.1°/min,扫描角度分辨率为0.01°,管压为40 k V,管流为40 m A。
1.3 电化学性能测试
催化剂电化学性能测试在上海辰华仪器有限公司产的CHI760D型电化学工作站上进行。称取5 mg催化剂,分散于1 m L无水乙醇中,加入5μL的Nafion溶液,分散均匀后,用微量注射器移取40μL涂在Pt电极上形成薄层,除去溶剂并固定催化剂,作为工作电极。参比电极采用氯化钾饱和甘汞电极,对电极为Pt丝。用循环伏安扫描和线性扫描对催化剂进行电催化活性测试,扫描速度分别为50 m V/s,5 m V/s,混合溶液是浓度为0.5 mol/L的H2SO4和浓度为1 mol/L的CH3CH2OH。电化学表面积测试中扫描速度为25 m V/s,电解液是浓度为0.5 mol/L的H2SO4溶液。计算催化剂的电化学表面积。
2 结果与讨论
2.1 催化剂的XRD表征
Pt/C、PtSn/C、Pt Fe/C、PtSn Fe/C四种催化剂的XRD的谱图如图1所示。
由图1可知:在2θ=25°为炭的(220)晶面的衍射峰,在2θ=39°、67°、81°左右的特征衍射峰,可分别归属为Pt金属晶相(111)、(220)、(311)晶面的衍射峰。选取不受碳载体干扰的Pt(220)晶面特征峰通过Scherrer公式计算铂晶粒大小:L=0.9λka1/(B2θcosθmax),其中L 为Pt的平均粒径大小,λka1为X射线波长(Cu-Kα为射线源,λ=1.54056Å),θmax为Pt(220)衍射峰对应的角度,B2θ为半峰宽(θ弧度值)[16]。
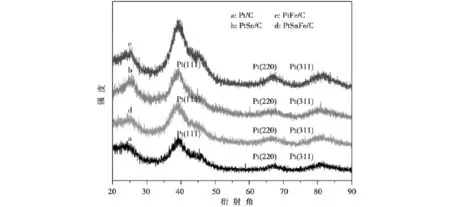
图1 Pt/C、PtSn/C、PtFe/C、PtSnFe/C四种催化剂的XRD的谱图Fig.1 XRD patterns on(a)Pt/C,(b)PtSn/C,(c)PtFe/C and(d)PtSnFe/C catalysts
图1中a、c、d、b分别代表Pt/C、PtSn/C、Pt Fe/C、PtSn Fe/C四种催化剂,其Pt的粒径分别为2.30、2.30、1.82、1.52 nm。由实验数据可知,随着Sn、Fe的引入,催化剂平均粒径减小。粒子尺寸减小,增加了表面原子的无序度和表面缺陷,有助于贵金属比表面积的增大和贵金属利用率的提高,同时提高了催化剂对乙醇的电氧化活性。
在图1中未见到有Sn和Fe或其氧化的物的峰,其主要原因一方面是SnO2和Fe2O3在PtSnFe/C催化剂中的理论含量都低于5%;另一方面可能是Sn O2和Fe2O3在PtSn Fe/C催化剂中主要以无定形态存在。
2.2 电催化性能的表征
在含 0.5 mol/L 的 H2SO4和 1 mol/L 的CH3CH2OH的溶液,扫描速度为50 m V/s时,Pt/C、PtSn/C、Pt Fe/C、PtSn Fe/C 四种催化剂测得的循环伏安扫描结果如图2所示。
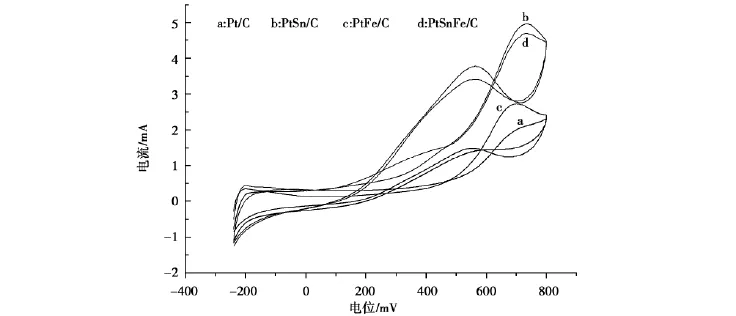
图2 Pt/C、PtSn/C、PtFe/C、PtSnFe/C四种催化剂的循环伏安扫描Fig.2 Cycle voltampere scanning on(a)Pt/C,(b)PtSn/C,(c)PtFe/C and(d)PtSnFe/C catalysts
由图2可知:Pt/C、PtSn/C、PtFe/C和PtSnFe/C四种催化剂的循环伏安曲线均在-200 m V(vs SCE)左右出现电流很小的对氢的氧化电流很小的峰,这是由于乙醇氧化中间产物(主要是乙醛,有少量的乙酸)对Pt的毒化阻止了氢的氧化。对乙醇氧化的起始电位分别在300 m V、200 m V、250 m V、250 m V(vs SCE)左右。随着扫描电位的提高,在500 m V(vs SCE)以下电流增加缓慢,而当扫描电位高于500 m V时,乙醇氧化电流急剧增加,但在不同催化剂上增加的幅度不同。Pt/C和PtFe/C对乙醇的氧化电流增加的速度基本相同,但在500 m V(vs SCE)以上,Pt Fe/C对乙醇的氧化电流增加的速度要比Pt/C快,PtSn/C和PtSnFe/C对乙醇的氧化电流增加得最快,而且都比Pt/C和Pt Fe/C要快得多,但在100~500 m V(vs SCE)PtSnFe/C要比PtSn/C好一些。综上可以得出,PtSn Fe/C对乙醇的电化学活性最高。
当Pt/C、PtSn/C、Pt Fe/C、PtSn Fe/C四种催化剂 在 含 0.5 mol/L 的 H2SO4和 1 mol/L 的CH3CH2OH的溶液,扫描速度为5 m V/s时,LSV扫描结果比较如图3所示。
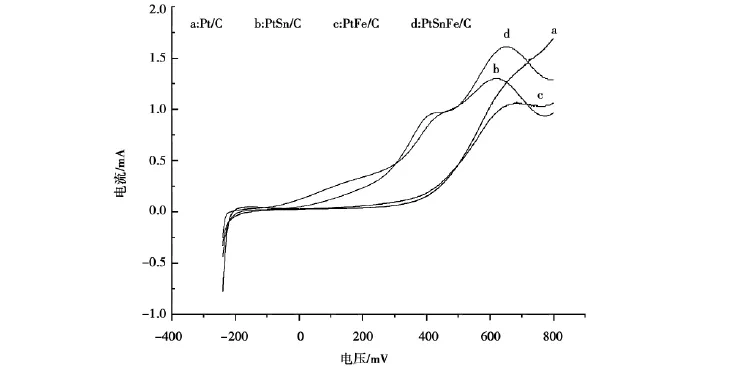
图3 Pt/C、PtSn/C、PtFe/C、PtSnFe/C四种催化剂的线性扫描Fig.3 Linear sweep voltammetry on(a)Pt/C,(b)PtSn/C,(c)PtFe/C and(d)PtSnFe/C catalysts
由图3可见:PtSn/C和PtSn Fe/C催化剂的线形扫描起始电位在-100 m V(vs SCE)左右,而Pt/C和Pt Fe/C催化剂半电池线形扫描起始电位均在400 m V(vs SCE)左右,所以Pt/C和Pt Fe/C相对于PtSn/C和PtSn Fe/C,对乙醇的氧化能力明显较弱。随着扫描电位的提高,对乙醇的氧化电流提高最快的是 PtSn Fe/C,在400~500 m V(vs SCE)PtSnFe/C催化剂对乙醇的氧化电流增长缓慢,高于500 m V(vs SCE)的电位时,PtSn Fe/C催化剂对乙醇的氧化电流又继续快速增长。对乙醇的氧化电流提高其次快的是PtSn/C催化剂,在200~300 m V(vs SCE)PtSn/C催化剂对乙醇的氧化电流增长缓慢,在高于300 m V(vs SCE)的电位时,PtSn/C催化剂对乙醇的氧化电流又继续快速提高。在600 m V(vs SCE)以上时,PtSn Fe/C的氧化电流增长速度明显高于PtSn/C,这是因为PtSn Fe/C催化剂粒径最小,能提供更多的Pt活性位,因此PtSnFe/C催化剂在整个测试过程中,相对于Pt/C、PtSn/C、Pt Fe/C催化剂表现出更高的峰电流密度。
图4为Pt/C、PtSn/C、Pt Fe/C、PtSn Fe/C四种催化剂在含0.5mol/L的H2SO4的电解液,扫描速度为25m V/s时电化学循环伏安曲线。
由图4可知,在氢吸附脱附区域,假设氢在Pt上的吸附过程符合Langumiur吸附,即单层吸附,根据CV曲线来计算Pt催化剂的电化学活性表面积(electrochemical surface area,ECSA)。通过电流-电压曲线,计算出这一区域所对应的电量Q,得到吸附电量同多晶铂电极上氢峰对应的电量进行对比,可计算出制备的Pt/C催化剂的ECSA。这里假定氢在多晶Pt电极上吸附电量为一定值,取210μC/cm2。
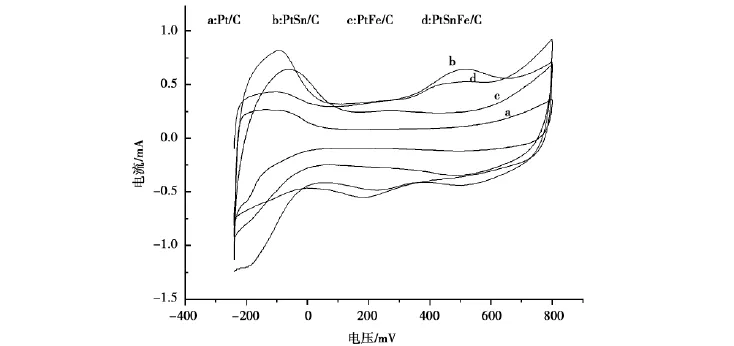
图4 Pt/C、PtSn/C、PtFe/C、PtSnFe/C四种催化剂的电化学循环伏安扫描Fig.4 Electrochemical cycle volt ampere scanning on(a)Pt/C,(b)PtSn/C,(c)PtFe/C and(d)PtSnFe/C catalysts
表2为Pt/C、PtSn/C、PtFe/C、PtSnFe/C四种催化剂,通过循环伏安曲线中的氢吸附-脱附区间的电量来计算的金属比表面。
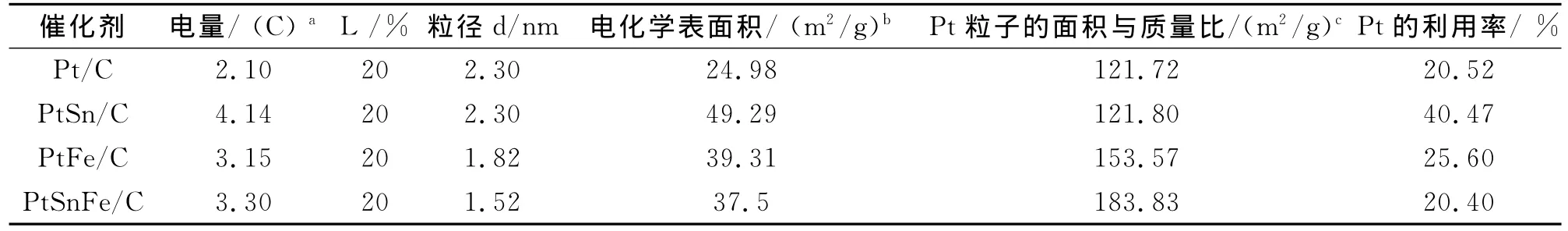
表2 Pt/C、PtSn/C、PtFe/C、PtSnFe/C四种催化剂的电化学表面积(ECSA)以及Pt的利用率Tab.2 Electrochemical surface area(ECSA)and the utilization rate of Pt on(a)Pt/C,(b)PtSn/C,(c)PtFe/C and(d)PtSnFe/C catalysts
由表2可知:电化学表面积分别为24.98,49.29,39.31,37.5m2/g,相差较大,对于Pt/C催化剂,Pt的活性位较少。对于PtSn/C催化剂,姜鲁华等[6]研究表明Sn不吸附CO,并且氧化态Sn能够在较低电位下提供OH物种,OH物种与反应中生成的CO毒物进行反应,使Pt活性位得以释放,使得Pt的活性位增加;对于PtFe/C催化剂,由于制备过程中先制备出Fe2O3纳米粒子,然后再还原铂,因此粒子表面可能富含Pt,并且Pt的活性位较多;而对于PtSn Fe/C催化剂,先制备出Fe2O3纳米粒子,然后再同时还原铂和锡,这样的结构会导致Pt的活性位被Sn所占据,氢在Pt活性位上的吸脱附受到抑制,降低了其电化学表面积。
尽管PtSn Fe/C催化剂电化学表面积较低,但其获得了最高的乙醇电化学氧化催化活性。造成这种显现可能的原因是,对于乙醇电化学氧化催化活性与两个因素有关,一是催化剂能提供的活性位的数目,电化学表面积越高,催化剂表面能够提供的催化活性位越多。二是每个催化活性位对乙醇电化学氧化反应的催化性能,乙醇电化学氧化产生的乙醛等中间物种在催化剂表面的吸附越强,则其催化性能越低。本文所制备的PtSn Fe/C催化剂,尽管由于FeOx对于Pt的覆盖作用,降低了电化学表面积,但同时FeOx与Pt之间的相互作用电子转移,降低了中间物种在Pt活性位上的吸附能力,从而造成总体的催化性能提高。
3 结论
(1)采用乙二醇还原法制备出了 Pt/C、PtSn/C、PtFe/C[17-18]、PtSn Fe/C 四种催 化 剂,PtSnFe/C三元催化剂相对于Pt/C、PtSn/C和Pt Fe/C三种催化剂,具有较高的乙醇电化学氧化催化活性。
(2)PtSn Fe/C三元催化剂活性较高,一方面是由于Fe的加入导致三元催化剂粒子的平均粒径变小,增加了表面原子的无序度和表面缺陷,有助于贵金属比表面积的增大和贵金属利用率的提高,从而提高了催化剂对乙醇的电氧化活性;另一方面是由于FeOx与Pt之间的相互作用电子转移,降低了中间物种在Pt活性位上的吸附能力,从而导致催化活性提高。
[1]宋树芹,陈利康,刘建国,等.直接乙醇燃料电池初探[J].电化学,2002,8(1):105-110.
[2]Jiang L H,Zhou Z H,Li W Z,et al.Effects of Treatment in Different Atmosphere on PtSn/C Electrocatalysts for Ethanol Electro-oxidation[J].Energy and Fuels,2004,18(3):866-871.
[3]Zhou W J,Zhou Z H,Song S Q,et al.Pt based anode catalysts for direct ethanol fuel cells[J].Solid State Ionics,2003,46(2):273-285.
[4]Jiang L H,Sun G Q,Sun S G,et al.Structure and chemical composition of supported Pt-Sn electrocatalysts for ethanol oxidation [J].Electrochimica Acta,2005,50(27):5384-5389.
[5]姜鲁华,周振华,周卫江,等.直接乙醇燃料电池PtSn/C电催化剂的合成表征和性能[J].高等学校化学学报,2004,(8):1511-1516.
[6]姜鲁华,藏海霞,孙公权,等.制备方法对直接乙醇燃料电池阳极PtSn/C催化剂性能的影响[J].催化学报,2006,27(1):15-19.
[7]Li H Q,Sun G Q,Cao L,Jiang L H,et al.Comparison of different promotion effect of PtRu/C and PtSn/C electrocatalysts for ethanol electro-oxidation[J].Electrochimica Acta,2007,52(24):6622-6629.
[8]Melke J,Schoekel A,Dixon D,et al.Ethanol Oxidation on Carbon-Supported Pt,Pt Ru,and PtSn Catalysts Studied by Operando X-ray Absorption Spectroscopy[J].Journal of Physical Chemistry C,2010,114:5914-5925.
[9]Su B J,Wang K W,Cheng T C,et al.Preparation of PtSn/C electrocatalysts with improved activity and durability toward oxygen reduction reaction by alcohol-reduction process[J].Materials Chemistry and Physics,2012,135:395-400.
[10]Ribeiro J,Anjos D M D,Kokoh K B,et al.Carbon-supported ternary PtSnIr catalysts for direct ethanol fuel cell[J].Electrochimi Acta,2007,52(24):6997-7006.
[11]Antolini E,Colmati F,Gonzalez E R.Effect of Ru addition on the structural characteristics and the electrochemical activity for ethanol oxidation of carbon supported Pt-Sn alloy catalysts[J].Electrochem Commun,2007,9(3):398-404.
[12]F.Colmati,E.Antolini,E.R.Gonzale.Preparation structural characterization and activity for ethanol oxidation of carbon supported ternary Pt-Sn-Rh catalysts[J].Journal of Alloys and Compounds,2008,456(1-2):264-270.
[13]Spinace E V,Linardi M,Neto A O.Co-catalytic effect of nickel in the electro-oxidation of ethanol on binary Pt-Sn electrocatalysts[J].Electrochemistry Communication,2005,7(4):365-369.
[14]Qiao B T,Wang A Q,Yang X F,et al.Single-atom catalysis of CO oxidation using Pt1,FeOx[J].Nature Chemsitry,2011,3:634-642.
[15]慕春海,韩博,李超鹏,等.多壁碳纳米管对异甘草素和甘草素的选择性吸附[J].石河子大学学报:自然科学版,2010,28(4):483-486.
[16]Radmilovic V,Gasteiger H A,Ross P N.Structure and Chemical Composition of a Supported Pt-Ru Electrocatalyst for Methanol Oxidation[J].Journal of Catalysis,1995,154(1):98-106.
[17]Li W Z,Xin Q,Yan Y S.Nanostructured Pt-Fe/C cathode catalysts for direct methanol fuel cell:The effect of catalyst composition[J].Science Direct,2010,35:2530-2538.
[18]卫芬芬,侯娟,熊曹水,等.CoFe2O4铁氧体的固相反应法制备及其磁特性[J].石河子大学学报:自然科学版,2010,28(5):640-643.
