结直肠癌中Runx3基因启动子区甲基化状态及其表达研究
2012-11-10刘康兵杨振平罗纪红石首市中医医院肿瘤科湖北石首434400
刘康兵,杨振平,罗纪红 (石首市中医医院肿瘤科,湖北 石首 434400)
结直肠癌中Runx3基因启动子区甲基化状态及其表达研究
刘康兵,杨振平,罗纪红 (石首市中医医院肿瘤科,湖北 石首 434400)
目的:观察结直肠癌中Runx3基因启动子区域甲基化状态及Runx3基因表达情况,探讨Runx3基因启动子区域异常甲基化状态在结直肠癌发生和发展过程中的意义。方法:采用DNA甲基化特异性PCR(MSP)技术分别对7种结直肠癌细胞系和65例结直肠癌患者肿瘤组织及其癌旁组织Runx3基因启动子区域甲基化进行检测,同时采用逆转录-聚合酶链反应(RT-PCR)检测结直肠癌细胞系及肿瘤组织、癌旁组织中Runx3基因表达情况。结果:在结直肠癌组织中,Runx3基因启动子区域甲基化率占43.1%(28/65),而在相对应的癌旁正常组织中,Runx3基因启动子区域未发现高甲基化现象;在7种结直肠癌细胞系中,有6种细胞Runx3基因启动子区域存在过度甲基化异常;RT-PCR结果显示,7种结直肠癌细胞系中仅Caco-2细胞中出现Runx3基因表达,而65例结直肠癌标本中,Runx3 mRNA表达率为49.2%(32/65),其表达情况与肿瘤分化程度、Dukes分期及淋巴结转移等临床病理参数之间存在显著相关性。结论:Runx3基因启动子区域甲基化是导致Runx3基因失活的主要原因之一,与结直肠癌发生密切相关,可作为结直肠癌早期诊断的分子标记物及分子治疗的靶点。
结直肠癌;Runx3基因;甲基化;表达
人类Runx3基因位于1号染色体的1p36.1,基因全长约67kb,含有p1和p2两个启动子、6个外显子和1290kb的开放阅读框[1],其表达产物约由415个氨基酸残基组成,RUNX3蛋白在TGF-β介导的细胞周期调控、细胞分化与凋亡过程中发挥重要作用[2],近年来多种研究发现Runx3异常表达与人类多种消化系肿瘤的发生密切相关[3]。据Ku等[4]报道,结直肠癌中启动子区域的高度甲基化是Runx3基因失活的主要机制,从而导致TGF-β/SMADS信号通路削弱或信号转导障碍,影响细胞分化和凋亡。本研究中我们检测了结直肠癌细胞系和结直肠癌组织中Runx3基因启动子区甲基化状态和表达情况,旨在阐明Runx3基因启动子区域甲基化异常与结直肠癌发生、发展过程的关系,从而探讨Runx3基因可能成为结直肠癌早期诊断和治疗的分子标记物。
1 对象与方法
1.1对象
65例结直肠癌组织及相对应的癌旁正常组织取自湖北省肿瘤医院、荆州市第一人民医院和石首市中医院肿瘤科2005年8月至2008年5月手术切除标本,所选取的结直肠癌患者术前均未实施放疗或化疗,患者年龄35~76岁,平均年龄52.8岁,其中男54例,女11例。所取组织离体后立即一分为二,一份先置于液氮中速冻10min,然后置于-80℃冰箱中保存。另一份以40g/L甲醛溶液固定,制作常规病理切片,通过HE染色,确定病理诊断。
1.2基因组DNA提取及甲基化PCR(MSP)
利用常规酚/氯仿抽提法提取DNA,参照MSP方法[5]对稀释的DNA进行预处理,两对Runx3基因的甲基化引物和非甲基化引物设计和PCR反应参见文献[6]。
1.3MSP结果判断
在MSP结果中,仅甲基化引物能扩增出目的带型,表明Runx3基因启动子区域过度甲基化;如甲基化引物和非甲基化引物都能扩增出目的带型,表明Runx3基因启动子区域处于部分甲基化状态;仅非甲基化引物能扩增出目的带型,表明Runx3基因启动子区域未甲基化。
1.4总RNA抽提及RT-PCR
收集细胞后,总RNA抽提及RT-PCR参见文献[7]。
1.5统计学分析
利用SPSS11.0软件对Runx3 mRNA表达情况与临床病理资料之间进行统计学分析,采用χ2检验分析不同组别Runx3 mRNA表达情况。Plt;0.05为差异有统计学意义。
2 结 果

M:250bp梯度标准DNA分子量m:甲基化;u:未甲基化。
2.1Runx3基因在结直肠癌细胞中甲基化状态及表达情况
在7种结直肠癌细胞(以胃癌细胞SNU-1、SNU-5为参照)中,仅Caco-2细胞中Runx3基因启动子区部分甲基化,其余6种结直肠癌细胞中Runx3基因启动子区都呈现过度甲基化现象(图1)。利用RT-PCR方法检测结直肠癌细胞Runx3基因表达情况显示,仅Caco-2细胞中出现Runx3基因表达(图2)。
2.2Runx3基因在结直肠癌组织中甲基化状态分析
在65例结直肠癌组织中,Runx3基因启动子区甲基化率约占43.1%(28/65),其中部分甲基化状态占18.5%(12/65),而在相对应的癌旁正常组织中,Runx3基因启动子区域未发现过度甲基化现象(图3),两者比较具有统计学差异(Plt;0.05)。

M:250bp梯度标准DNA分子量。
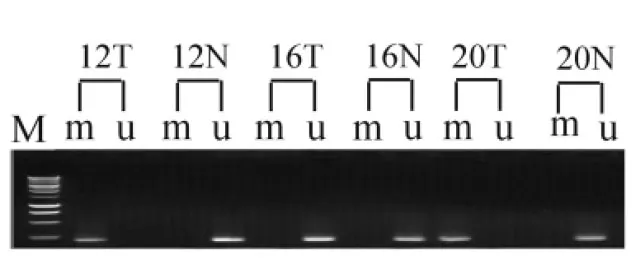
M:250bp梯度标准DNA分子量;m:甲基化;u:未甲基化;N:正常结直肠组织;T:结直肠癌组织;
2.3Runx3mRNA在结直肠癌组织中的表达及其与临床病理参数的关系
在65例结直肠癌标本中,Runx3 mRNA表达率为49.2%(32/65),不表达的标本约为50.8%(33/65),且Runx3基因启动子区过甲基化的12例结直肠癌标本中Runx3 mRNA全部不表达,而在相应的癌旁组织中,Runx3 mRNA全部表达(见表1)。结直肠癌组织与癌旁组织之间存在统计学差异(Plt;0.05)。结直肠癌组织中Runx3 mRNA表达情况与患者年龄、性别、肿瘤部位、肿瘤大小、肿瘤组织学类型等临床病理参数无关(Pgt;0.05),而与肿瘤分化程度、Dukes分期及淋巴结转移等临床病理参数有关(Plt;0.05)。
3 讨 论
癌基因的激活和(或)抑癌基因的失活是结直肠癌发生、发展的分子生物学基础,新型抑癌基因Runx3广泛表达于消化道上皮细胞、血液细胞、间叶细胞、神经细胞等[8-9]。Runx3基因是Runx家族中最近受到广泛研究的基因,是哺乳动物runt家族进化的基础[10],其产物通过指导TGF-β信号转导,从而对细胞分化、细胞周期调控、细胞凋亡等起着重要的作用。Runx3基因失活或下调表达的机制目前认为可能与基因缺失和甲基化相关[11],而肿瘤细胞中Runx3基因启动子区CpG岛的甲基化是其失活的主要原因[12]。

表1 结直肠癌组织中Runx3 mRNA表达情况与临床病理参数的关系
Runx3基因的5'端启动子及附近存在4.2kb的CpG岛,其GC含量约高达64%,这种结构表明该基因可能受甲基化的调控[9]。许多研究表明,Runx3基因在胃癌、肝细胞癌、胆道肿瘤、肺癌、婴儿睾丸内胚窦瘤等人类多种肿瘤中存在启动子区域甲基化异常[1,13-16],在结直肠癌中也有报道[17],这是抑癌基因Runx3失活的主要机制。本研究通过运用MSP技术对7种结直肠癌细胞系和65例结直肠癌患者癌组织Runx3基因启动子区甲基化情况进行研究显示,7种结直肠癌细胞中,仅Caco-2细胞中Runx3基因启动子区部分甲基化,其余6种结直肠癌细胞中Runx3基因启动子区都呈现过度甲基化现象;65例结直肠癌组织中Runx3基因启动子区甲基化率约占43.1%(28/65),其中部分甲基化状态占18.5%(12/65),而在相对应的癌旁正常组织中,Runx3基因启动子区域未发现过度甲基化现象[18],两者比较具有统计学差异(Plt;0.05)。MSP实验结果表明,Runx3基因启动子区过度甲基化现象是结直肠癌中常见的表观遗传事件,可能参与了结直肠癌的发生发展过程。我们通过RT-PCR方法分析了7种结直肠癌细胞系和65例结直肠癌患者癌组织及癌旁组织中Runx3 mRNA表达情况。在结直肠癌细胞系中,仅Caco-2细胞中出现Runx3基因表达,其表达结果与MSP实验结果相符;在65例结直肠癌组织中,Runx3 mRNA表达率为49.2%(32/65),不表达的标本约为50.8%(33/65),且Runx3基因启动子区过甲基化的12例结直肠癌标本中Runx3 mRNA全部不表达,而在相应的癌旁组织中,Runx3 mRNA全部表达,结直肠癌组织与癌旁组织之间存在统计学差异(Plt;0.05)。RT-PCR结果显示,结直肠癌中Runx3基因启动子区甲基化现象与其mRNA表达下调保持一致。通过研究结直肠癌组织中Runx3 mRNA表达情况与临床病理参数的关系显示,Runx3 mRNA表达情况与患者年龄、性别、肿瘤部位、肿瘤大小、肿瘤组织学类型等临床病理参数无关(Pgt;0.05),而与肿瘤分化程度、Dukes分期及淋巴结转移等临床病理参数之间存在显著相关性(Plt;0.05)。
本实验的研究结果表明,Runx3基因启子区CpG岛的高甲基化在结直肠癌的发病过程中是一种常见的表观遗传学事件,而Runx3作为一个肿瘤抑制基因,其表达下调参与了结直肠癌的发生、发展,并可能与结直肠癌的分化程度、病理分期及淋巴结转移密切相关。在此基础上进一步研究Runx3基因在结直肠癌发生发展过程中的作用将可作为结直肠癌早期诊断的分子标记物及分子治疗的靶点。
[1]张海元,刘娟,解庭波.肝细胞癌中Runx3基因启动子区甲基化研究[J].华中科技大学学报:医学版,2009,38(1):23-26.
[2]张海元,云鹏.肝癌细胞系中Runx3基因表达及启动子区异常甲基化分析[J].长江大学学报:自科版医学卷,2009,6(1):1-3.
[3]曾超,贺修胜.Runx3基因与消化系统恶性肿瘤的关系[J].国外医学:肿瘤分册,2005,32(2):128-131.
[4]Ku J L,Kang S B,Shin Y K,et al.Promoter hypermethylation downregulates RUNX3 gene expression in colorectal cancer cell lines[J].Oncogene,2004,23(40):6736-6742.
[5]James G,Heman,Jeremy R,et al.Methylation-specific PCR:A novel PCR assay for methylation status of CpG islands[J].Proc Natl Acad Sci USA,1996,93:9821-9826.
[6]何小兵.胃癌细胞系Runx3基因甲基化状态及临床意义[J].长江大学学报:自科版医学卷, 2008,5(4):16-18.
[7]何小兵,张海元,王卫政.胃癌中Runx3基因甲基化表达及临床研究[J].长江大学学报:自科版医学卷,2009,6(2):16-19.
[8]Woolf E,Xiao C,Fainaru O,et al.Runx3 and Runx1 are required for CD8 T cell development during thymopoiesis[J].Proc Natl Acad Sci USA,2003,100(13):7731-7736.
[9]Levanon D,Bettoun D,Harris-Cerruti C,et al.The Runx3 transcription factor regulates development and survival of Trk C dorsal root ganglia eurons[J].EMBO J,2002,1(13):3454-3463.
[10]Bangsow C,Rubins N,Glusman G,et al.The RUNX3 gene sequence structure and regulated expression[J].Gene,2001,279:221-232.
[11]Tozawa T,Tamura G,Honda T,et al.Promoter hypermethy lation of DAP-kinase is associated with poor survival in primary biliary tract carcinoma patients[J].Cancer Sci,2004,95(9) :736-740.
[12]Kato N,Tamura G,Fukase M,et al.Hypermethylation of the Runx3 gene promoter in testicular yolk sac tumor of infants[J].Am J Pathol,2003,163(2) :387-391.
[13]Sato K,Tomaizawa Y,Lijima H,et al.Epigenetic inactivation of the RUNX3 gene in lung cancer[J].Oncol Rep,2006,15(1):129-135.
[14]Tomohiro Tozawa,Gen Tamura,Teiichiro Honda,et al.Promoter hypermethylation of DAP-kinase is associated with poor survival in primary biliary tract carcinoma patients[J].Cancer Sci,2004,95:736-740.
[15]张海元,熊维,任松森.肝细胞癌中Runx3基因表达状态分析及预后评估价值的研究[J].长江大学学报:自然科学版医学卷,2010,7(3):15-17.
[16]Noriko Kato,Gen Tamura,Masayuki Fukase,et al.Hypermethylation of the RUNX3 Gene Promoter in Testicular Rolk Sac Tumor of Infants[J].American Journal of Pathology,2003,163:387-391.
[17]Ajay Goel,Takeshi Nagasaka,Christian N,et al.The CpG island methylator phenotype and chromosomal instability are inversely correlated in sporadic colorectal cancer[J].Gastroenterology,2007,132(1):127-138.
[18]何小兵,张海元.胃癌及癌旁组织中Runx3基因甲基化研究及临床意义[J].吉林医学,2012,33(2):227-228.
[编辑]一 凡
10.3969/j.issn.1673-1409(R).2012.03.003
R735.5;R730.231
A
1673-1409(2012)03-R006-04
2012-01-16
湖北省教育厅中青年项目(020091207)
刘康兵(1974-),男,湖北石首人,主治医师,主要从事肿瘤基础与临床研究工作。
