黄芪预防小鼠急性酒精性肝损伤的作用机制研究
2012-11-09舒慧,魏蕾
舒 慧,魏 蕾
(武汉大学基础医学院,湖北武汉430071)
酗酒易引起酒精性肝病,包括肝炎、脂肪肝和肝硬化,严重危害身体健康。近年来,酒精性肝病的发病率明显上升[1],受到广泛的关注和重视。目前对该病的治疗仍以戒酒、营养支持为主,西医药未有突破性进展,而多应用中医药治疗。中药黄芪具有补气固表功效,能增强机体免疫力、增强造血功能、改善物质代谢、抗应激、延缓衰老、保肝和抗溃疡等作用并已广泛应用于临床[2]。文献报道,氧化应激是酒精性肝损伤发生和发展的重要原因之一[3],本实验观察黄芪对急性酒精性肝损伤模型小鼠氧化应激的影响,探讨黄芪的护肝作用机制,为本药临床应用于预防酒精性肝病提供实验依据,现将实验结果报告如下。
1 材料与方法
1.1 实验材料
①黄芪口服液的制备:黄芪购自湖北省咸宁市温泉辅仁堂药店,按文献[4]法制成每毫升相当原生药1g(1g/ml)的浓缩口服液,4℃保存。②实验用酒:使用市售红星牌二锅头酒,酒精度55%(v/v),北京酿酒总厂出品,临用前用双蒸水稀释成50%酒精浓度。③试剂与仪器:丙氨酸氨基转移酶(ALT)试剂盒(批号20100528)、天冬氨酸氨基转移酶(AST)试剂盒(批号20100516)、超氧化物歧化酶(SOD)试剂盒(批号20100425)、谷胱甘肽过氧化物酶(GSH-PX)试剂盒(批号20100421)、谷胱甘肽(GSH)试剂盒(批号20100419)、丙二醛(MDA)试剂盒(批号20100313)、总蛋白(TP)试剂盒(批号20100528)由南京建成生物工程研究所提供,其余试剂均为国产分析纯。722型光栅分光光度计(上海精密科学仪器有限公司)。
1.2 实验动物
昆明种雄性小鼠60只,体质量(20±2)g,清洁级,由湖北医学科学院实验动物中心提供(合格证号:00011585)。动物实验室条件:室温(22±2)℃,湿度50% ~70%。
1.3 实验方法
1.3.1 动物分组给药及造模
60只小鼠随机分成4组,即正常组、模型组、黄芪低、高(0.5g/kg,1.0g/kg)剂量组,每组 15只,分别灌胃等容积生理盐水和黄芪口服液,1次/d,连续7d。末次给药后,除正常组外,其他各组灌胃50%白酒0.2ml/10g,1次/d,共3次,制备小鼠急性酒精性肝损伤模型。
1.3.2 指标测定
实验结束后,禁食12h(不禁水),将各组存活小鼠摘眼球采血,肝素抗凝,3000r/min离心10min,制备血浆。然后脱臼处死,取各组小鼠肝脏称湿重,并用生理盐水制备10%肝组织匀浆。按试剂盒说明书方法,分别测定血浆ALT和AST活性(赖氏法),并测定肝组织SOD和GSH-PX活性及MDA、GSH和总蛋白(考马斯亮蓝法)的含量。
1.4 统计学处理
所有数据采用SPSS11.5软件进行统计分析,计量资料采用s表示,组间显著性差异性比较采用t检验。
2 结果
2.1 一般情况
正常组小鼠毛发光泽,动作自如,反应灵敏,15只全部存活;模型组小鼠明显嗜睡、倦怠、存活8只;黄芪低、高剂量组上述症状较模型组轻,分别存活8只和10只。χ2检验,4组间小鼠存活率无显著性差异(P>0.05)。
2.2 黄芪对酒精性肝损伤小鼠氧化应激的影响
见表1、表2和表3。
表1 4组小鼠血浆ALT和AST活性的比较(s,U/赖氏单位)
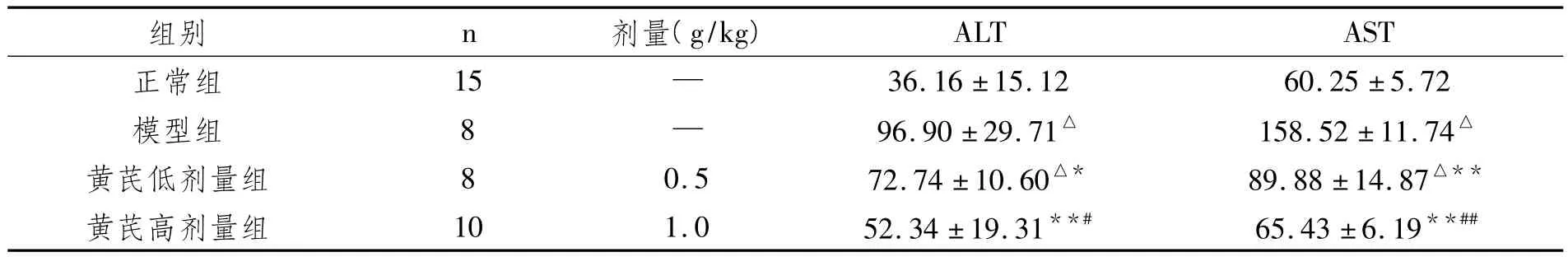
表1 4组小鼠血浆ALT和AST活性的比较(s,U/赖氏单位)
与正常组比较,△P<0.01;与模型组比较,*P<0.05、**P<0.01;与黄芪低剂量组比较,#P<0.05、##P<0.01
36.16±15.12 60.25±5.72模型组 8 — 96.90±29.71△ 158.52±11.74△黄芪低剂量组 8 0.5 72.74±10.60△* 89.88±14.87△**黄芪高剂量组 10 1.0 52.34±19.31**# 65.43±6.19**##ALT AST正常组 15 —组别 n 剂量(g/kg)
表2 4组小鼠肝组织SOD和GSH-PX活性的比较(s,)
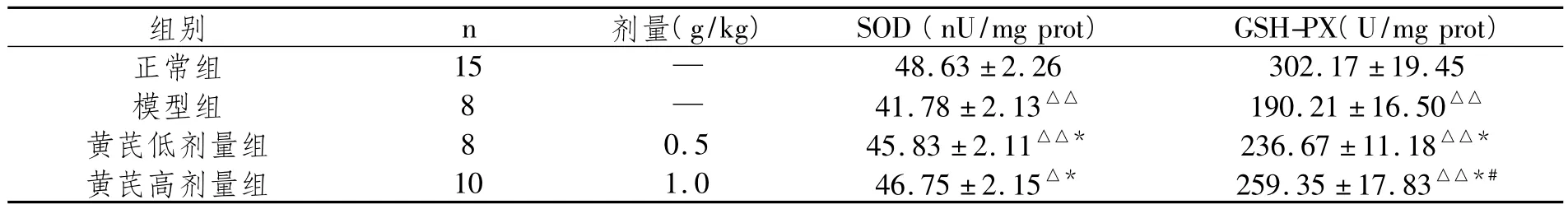
表2 4组小鼠肝组织SOD和GSH-PX活性的比较(s,)
与正常组比较,△P<0.05、△△P<0.01;与模型组比较,*P<0.01;与黄芪低剂量组比较,#P<0.05
组别 n 剂量(g/kg)SOD(nU/mg prot)GSH-PX(U/mg prot)48.63±2.26 302.17±19.45模型组 8 — 41.78±2.13△△ 190.21±16.50△△黄芪低剂量组 8 0.5 45.83±2.11△△* 236.67±11.18△△*黄芪高剂量组 10 1.0 46.75±2.15△* 259.35±17.83△△*#正常组 15 —
表3 4组小鼠肝组织GSH和MDA含量的比较(s,nmol/mg prot)

表3 4组小鼠肝组织GSH和MDA含量的比较(s,nmol/mg prot)
与模型组比较,*P<0.05、**P<0.01;与正常组比较,△P<0.05、△△P<0.05;与黄芪低剂量组比较,#P<0.05
组别 n 剂量(g/kg)2.10±0.21 41.36±2.51模型 8 — 4.15±1.26△△ 33.54±3.23△△黄芪低剂量 8 0.5 2.81±0.71△* 37.61±2.74△△*黄芪高剂量 10 1.0 2.69±0.78△** 41.92±3.65**#MDA GSH正常 15 —
3 讨论
众所周知:酗酒易伤肝。为了探讨中药黄芪预防酒精性肝损伤的作用机制,本文采用白酒灌胃建立酒精性肝损伤的小鼠动物模型[5],因ALT和AST是肝细胞内的主要功能酶,在肝组织损伤及坏死时,肝细胞膜和细胞器结构被破坏,膜的流动性失常,酶从细胞内漏出入血,故检测造模后小鼠血中ALT和AST活性的高低可判断其肝细胞损伤的程度[6],本文模型组小鼠血浆ALT和AST活性显著高于正常组,表明酒精性肝损伤的小鼠动物模型制备成功。有文献报道[7,8],酒精性肝损伤的致病机制与氧化应激关系紧密,氧化应激是指活性氧自由基导致机体组织的氧化损伤。在生理条件下,机体细胞经呼吸获取氧,其中98%的氧与细胞器内的葡萄糖和脂肪相结合,转化为能量,以满足细胞活动的需要,另外2%的氧则转化成氧自由基。氧自由基主要有活性氧(O-2)、过氧化氢(H2O2)、羟自由基(·OH)等。氧自由基的过氧化杀伤,主要是破坏细胞膜的结构和功能,破坏线粒体,断绝细胞的能源,毁坏溶酶体,使细胞自溶[9]。一次性大量或长期过量饮酒,约90%酒精(主要成分是乙醇)在肝脏内氧化,除少量乙醇可在乙醇脱氢酶(ADH)和醛脱氢酶(ALDH)的催化下代谢生成二氧化碳和水排出体外,大量乙醇在ADH的催化下氧化转变成乙醛。乙醛的毒性很强,与肝脏毒性密切相关,乙醛可通过黄嘌呤氧化酶转变成超氧化物和氧自由基,乙醇还能诱导肝脏细胞色素P450酶活性增高,产生大量的活性氧簇,引发脂质过氧化,破坏肝细胞的结构和功能,造成肝损伤[10];MDA是脂质过氧化反应过程中不饱和脂肪酸分解释放出的反应性醛,是脂质过氧化的终产物,可严重破坏细胞膜结构,致细胞肿胀、坏死,故检测MDA含量的高低可反映肝脏损伤的程度[11]。机体存在着抗氧化系统,一类是酶系统,包括SOD、CAT、GSH-PX等;另一类是非酶系统,主要有GSH、维生素C和E等。生理状态下,体内这些抗氧化系统可以及时清除氧自由基,保护组织细胞免受氧自由基的氧化损伤,但如氧自由基生成过多,超过了体内抗氧化系统的清除能力时,导致氧自由基过剩而蓄积,破坏了氧化/抗氧化的动态平衡,组织细胞遭受明显的损伤和破坏,使机体病变及恶化,故检测抗氧化系统的酶活性及GSH的含量变化亦可反映组织抗氧化应激能力的高低[12]。本实验结果显示:模型组小鼠MDA显著高于正常组,而 SOD、GSH-PX和 GSH显著低于正常组,表明小鼠急性酒精性肝损伤时肝脏组织存在着明显的氧化应激;中药黄芪可显著降低血浆ALT和AST活性及肝组织中MDA含量;提高肝组织SOD和GSH-PX的活性和GSH含量;表明黄芪具有明显的减轻酒精性肝损伤作用,机制可能与抗氧化应激作用有关,而且高剂量黄芪组GSH-PX活性和GSH含量明显高于其低剂量组,呈现量效关系。本文为黄芪预防酒精性肝损伤及其机制的进一步研究提供了实验依据。
[1]邱德凯.重视对酒精性肝病的防治[J].中华消化杂志,1993,13(3):126
[2]候家玉,方泰恵.中药药理学[M].第2版.北京:中国中医药出版社,2007:218
[3]黄梅芳,朱尤庆.酒精性肝病发病机制的研究进展[J].医学新知杂志,2003,13(2):104
[4]李仪奎.中药药理实验方法学[M].上海:上海科学技术出版社,1991:36
[5]赵敏,杨杏芳,黄俊明,等.小鼠酒精性肝损伤模型的研究[J].卫生研究,2005,34(1):121
[6]王金萍,曾明.可舒胶囊对小鼠酒精性肝损伤的影响[J].中国实验方剂学杂志,2004,10(6):64
[7]陈慧敏,高南南.中药抗氧化作用治疗酒精性肝损伤的研究进展[J].中华中医药杂志,2009,24(7):912
[9]楼宜嘉,朱依谆.药物毒理学[M].第2版,北京:人民卫生出版社,2008:104
[10]李东良,郭红哲,杨才生,等.大鼠酒精性肝损伤模型的建立及病理学观察[J].中西医结合肝病杂志,2000,10(2):30
[11]Koruk K,Taysi S,Savas MC,et al.Oxidative stress and enzymatic antioxidant status in patients with nonalcoholic steato-hepatitis[J].Acta Clin Lab Sci,2004,34:57
[12]Lebel CP,Bondy SC.Oxidative damage and cerebral aging[J].Progress In Neurobiology,1992,38:601
