s区金属离子对锰(Ⅱ)配位聚合物的结构构建及性质影响
2012-11-09周爱菊洪燕霞林培洪
徐 敏 周爱菊 王 静 洪燕霞 林培洪
s区金属离子对锰(Ⅱ)配位聚合物的结构构建及性质影响
徐 敏*周爱菊 王 静 洪燕霞 林培洪
(广州大学化学化工学院,广州 510006)
本文通过在 s 区金属离子(Li+,Na+,K+,Mg2+,Ca2+)存在下,2,6-吡啶二羧酸(H2pda)或 2-吡啶羧酸(picH)与 Mn(Ac)2·4H2O 的水热合成反应,系统探讨了s区金属离子的电荷和半径对Mn(Ⅱ)配位聚合物的结构构建以及热稳定性和溶解性能的影响。合成了2个混合金属配位聚合物[Na2Mn(pda)2]n(1)和[K2Mn(pda)2]n(2),并通过红外和X-单晶衍射进行了结构表征:1属于正交系,空间群Pnna;2属于单斜系,空间群P2/n。同时应用荧光光谱测试研究了配合物1水溶液的荧光性质。
锰配位聚合物;2,6-吡啶二羧酸;吡啶羧酸;晶体结构;水热合成;荧光性质
0 引 言
金属配位聚合物兼有复合高分子和配位化合物两者的优点,在气体储存、分离以及催化、光电磁性等方面呈现出诱人的应用前景[1-3]。但目前分子的组装有许多不确定的因素。s区金属离子虽配位能力弱,但其存在会影响化合物的组成和结构,从而影响其性能,包括溶解性、稳定性、孔径大小、磁学性质等[4-7]。本文选择了易于得到晶体的常见配体2,6-吡啶二羧酸(H2pda),2-吡啶羧酸(picH),探讨了在s区金属离子(Li+,Na+,K+,Mg2+,Ca2+)存在下,Mn(Ac)2分别与H2pda,picH的水热合成反应,并获得了混合金属配位聚合物[Na2Mn(pda)2]n1、[K2Mn(pda)2]n2和[NaMn(pic)3]n3。此外,研究了1的荧光性质,并通过对比实验以及红外光谱和单晶结构系统讨论了s区金属离子的电荷、半径对锰(Ⅱ)金属配位聚合物的结构构建以及稳定性和溶解性能的影响。
1 实验部分
1.1 原料和仪器
所有购买的化学试剂均没有进行进一步处理直接使用。N-n-Bu4MnO4按文献制备[8]。Elementar Vario ELCHNS-O元素分析仪,Bruker EQUINOX55-A590/3F 红外光谱仪 (4 000~400 cm-1,KBr压片),Bruker Smart ApexⅡ CCD单晶衍射仪,TGA4000热重分析仪,UV-2550 UV-Vis光谱仪,F-4500荧光光谱仪。
1.2 配位聚合物的合成
1.2.1 [Na2Mn(pda)2]n(1)
将 Mn(OAc)2·4H2O(0.019 g,0.1 mmol)、H2pda(0.085 g,0.5 mmol)、N-n-Bu4MnO4(0.071 g,0.2 mmol)、NaOH(0.044 g,1.0 mmol)和 10 mL DMF 加入聚四氟乙烯反应釜中。在温度160℃反应2 d得到淡黄色六边形晶体。 IR(cm-1):3 045(w),3 017(w),2 626(m),1 625(vs),1 542(vs),1 475(vs),1 319(s),1 196(m),903(m),755(m)。
1.2.2 [K2Mn(pda)2]n(2)
用KOH替代NaOH,采用上述方法得到淡黄色菱形晶体。 IR(cm-1):3 541(w),3 233(m),1 611(s),1 430(s),1 379(s),779(m)。
1.2.3 [NaMn(pic)3]n(3)
按文献[4]的合成方法,用NaCl替代NaClO4得到浅黄色块状晶体。 IR(cm-1):3 638(w),3 300(w),1 618(s),1 595(s),1 567(m),1 383(s),1 015(m),855(m),777(m),704(m)。 晶胞参数为:a=1.249 70 nm,b=1.703 72 nm,c=1.750 31 nm;V=3.726 6(4)nm3。
1.2.4 [Mn(pic)2]n(4)
按文献[4]的合成方法,用LiNO3替代NaClO4,并改用DMF做溶剂得到无色透明针状晶体。C12H8MnN2O4计算结果(%):C,48.18;H,2.70;N,9.37。分析结果 (%):C,48.22;H,2.80;N,9.37。 IR(cm-1):3447(w),3089(m),1654(s),1624(s),1595(s),1407(s),1 346(s),780(m),698(m)。 晶胞参数为:a=1.039 0 nm,b=1.0853nm,c=1.0342nm;β=108°;V=1.1066(4)nm3。
1.3 晶体结构分析
分别选择 0.162 mm×0.120 mm×0.065 mm(配合物 1)和 0.160 mm×0.125 mm×0.060 mm(配合物 2)尺寸的单晶,采用Bruker Smart ApexⅡCCD单晶衍射仪 Mo Kα 射线(λ=0.071 073 nm),在 110(2)K 条件下,以 φ-ω 扫描方式。 对于配合物 1:在 2.23°<θ<27.06°范围共收集8 381个衍射点,其中1 488个(Rint=0.017 7)独立衍射点,1 371 个(I>2σ(I))可观察衍射点;对于配合物 2:在 2.68°<θ<27.09°范围共收集4 766个衍射点,其中1 604个(Rint=0.035 0)独立衍射点,1 169个(I>2σ(I))可观察衍射点用于结构分析和结构修正。全部数据经Lp因子和经验吸收校正。晶体结构采用SHELXTL程序由直接法解出、对氢原子和非氢原子分别采用各向同性和各向异性温度因子用全矩阵最小二乘法进行修正。有关晶体学数据见表1。
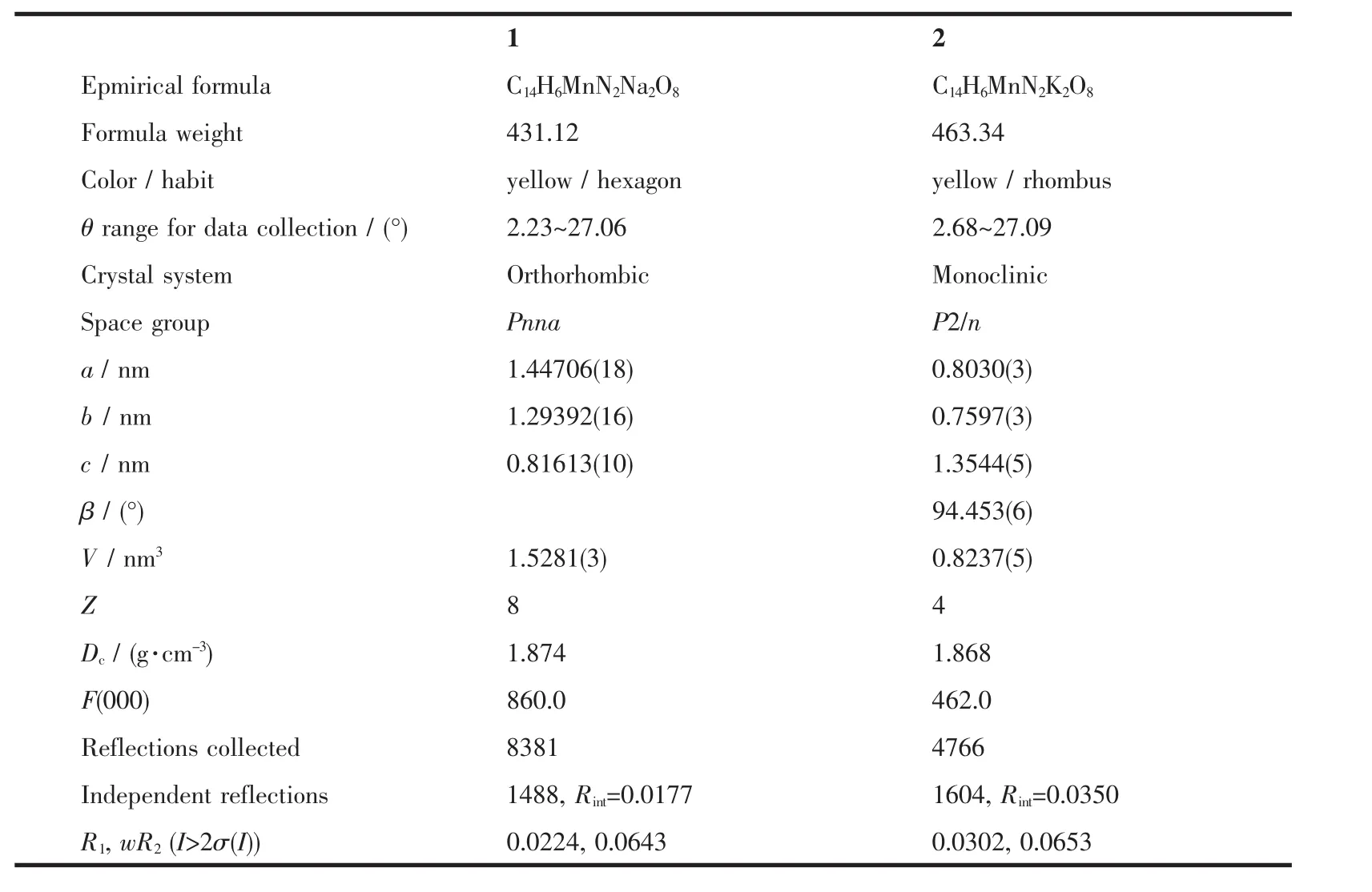
表1 配位聚合物1、2的晶体学数据Table 1 Crystallographic data for 1 and 2
CCDC:898743,1;898744,2。
2 结果与讨论
2.1合 成
Na/Mn混合金属配位聚合物1是Mn(Ac)2·4H2O与H2pda在NaOH和N-n-Bu4MnO4存在下,采用水热合成法获得。用KOH替代NaOH,则得到组成类似的K/Mn配合物2。但同样条件下未得到相应组成的Li/Mn混合金属配位聚合物。在N-n-Bu4MnO4不存在的类似条件下,则未得到任何晶体。同样在N-n-Bu4MnO4存在下,用 Mn(OAc)2·4H2O 和 picH 分别与NaClO4、NaCl和Nadca(dca-=二氰胺根)进行水热合成均得到已知的[NaMn(pic)3]n[4]和[Mn(pic)2]n[9]。而相同条件下,其他s区离子存在(如KCl,LiNO3,Mg(NO3)2,CaCO3)均只能得到已知[Mn(pic)2]n。 同样只有在N-n-Bu4MnO4存在时才能得到相应的Na/Mn混合金属配位聚合物,这说明混合金属配合物中的锰(Ⅱ)来自N-n-Bu4MnO4而不是Mn(Ac)2。
2.2 晶体结构描述
配合物1和 2中Mn2+,Na+,K+的配位方式见图1,主要原子的键长和键角列于表2。1晶体的结构基元为[Na2Mn(pda)2](图1a),基元中的Mn1分别与2个pda2-中的4个氧原子(O2,O3,O2E,O3E)和2个氮原子(N1,N1E)配位形成变形的八面体。Mn-N的键长均为 0.214 48 nm,Mn-O的键长有两种,分别为0.218 57 和 0.227 14 nm。 含有 Mn1 变形八面体的最小键角是 N1-Mn1-O3 72.33(4)°,最大键角是 N1E-Mn1-N1 156.20(7)°。Na1 与来自 2 个不同基元的pda2-的 4 个氧原子(O3B,O4B,O1C,O2C)以及分别来自另2个pda2-所提供的2个氧原子 (O1,O4A)也形成变形八面体,Na-O的6个键长都略有不同,从0.228 97 到 0.267 33 nm 不等,且 2 个 Na+的配位环境完全一样。变形八面体的最小键角O3B-Na1-O4B 51.15(3)°,是 Na1 与同一羧基的 2 个氧原子形成的角度。 最大的键角 O1C-Na1-O4B 145.72(4)°,是Na1与来自不同基元中羧基的2个氧原子所形成的。
2 晶体的结构基元为[K2Mn(pda)2],其 Mn2+,K+的配位方式与配合物1类似(图1b),均为变形八面体。但相比配合物1,其键长和键角有明显的不同。Mn-N的键长略长(0.216 3 nm),而Mn-O的键长略短,也只有两种键长(0.220 08 和 0.225 73 nm),且 O-K 的键长(0.2611~0.2910 nm)明显比 O-Na 大。 含有 Mn1变形八面体的最小键角 N1-Mn1-O1 71.84(7)°,最大键角 N1A-Mn1-N1 160.54(11)°。 含 K+变形八面体的最小键角 O4B-K1-O4C 74.99(7)°,最大键角 O1-K1-O4C 130.89(6)°。


表2 配合物1、2中部分键长和键角Table 2 Selected bond lengths(nm)and bond angles(°)in complexe 1 and 2
在1和2的结构中,Na+或K+之间均借助不同羧基中的氧原子以μ2-O相结合且均为六配位。这与已报道的类似配位聚合物的配位模式明显不同,如[Na2Mn(pda)2(H2O)2]n[10]中Na+的配位数 1个为 5,另 1个为7,且羧基中有1个氧原子与3个Na原子以μ3-O 的方式结合;而[K2Mn(pda)2(H2O)7]n[5]中 K+的配位数1个为6,另1个为7。此外,在已报道的配合物中Na+或K+之间均借助水和羧基氧结合。这可能与本实验所用溶剂为极性较大的DMF,缺少水的配位有关。
图2显示了1和2的结构堆积图。Na+,K+通过羧基氧将不同基元连接成具有不同孔径大小和形状的三维网状结构。其中含有Na+的三维结构孔道中,大的有效窗口直径是:0.273 9 nm×0.273 9 nm;小的为0.136 0 nm×0.136 0 nm,而含有K+的三维结构没有实际空洞。这说明虽然2个配合物组成类似,但由于Na+,K+半径不同,其三维结构即堆积方式和孔径大小都有明显差异。此外,在1和2中2个吡啶环平面之间的距离分别为0.325 03和0.326 01 nm(2个吡啶环中心间的距离分别为0.333 5和0.333 7 nm,见图3),说明在配位聚合物中芳香苯基间存在较强的π-π堆积作用力,增加了其稳定性。

2.3 IR光谱
1和2的红外光谱分别在1 625(vs),1 611 cm-1(s)观察到归属CO2-的反对称伸缩振动;分别在1 542(vs),1 475(vs)和 1 429 cm-1(s),1 379 cm-1(s)有芳环的骨架振动。可以看出2个配合物的红外谱图有明显的不同,这进一步说明1和2的对称性不同。此外在3 200~3 450 cm-1均没有发现属于氢键的宽、强振动峰,说明所得到的配合物不存在氢键作用,进一步说明不存在没有配位的OH-以及水分子。
2.4 光谱研究
室温测定了1的紫外-可见光谱和荧光光谱。1水溶液 (10-5mol·L-1)的紫外-可见光谱见图4,在250~290 nm附近出现一较宽的吸收谱带,最大吸收峰与配体相比出现明显的红移,这可以归属为ππ*跃迁。


选择410 nm为发射波长,得到1水溶液 (10-5mol·L-1)的荧光激发光谱图(见图5a)。以298 nm为最佳激发波长,得到发射扫描图谱,在410 nm处出现最大发射波长(图5b),这可以归属于配体pda2-的π-π跃迁荧光发射。
2.5 热稳定性
1在10℃·min-1的升温速度和氮气氛下,120~150℃失重7.5%,这可能是在空气中吸水所致,1和2均易潮解也验证了这一点。失水后在460℃观察到再次失重,说明1具有较高的热稳定性,而含水[Na2Mn(pda)2(H2O)2]在130℃时会失去2个配位水分子[10];不含 Na+的[Mn2(pda)2(H2O)3]在 180 ℃失去配位水[11],在362℃就开始分解。此外,对3和4的热重分析结果显示,含Na+配合物3在398℃开始出现明显的失重,而不含Na+配合物4在350℃就开始出现明显的失重。这些都说明Na+,K+的参与增加了配合物的热稳定性。我们观察到1和2的晶体在空气中易于潮解而坍塌,而[K2Mn(pda)2(H2O)7]n[5],[Na2Mn(pda)2(H2O)2]n[10],[Mn2(pda)2(H2O)3][11]难溶于水,所以在空气中晶体很稳定。同样[Mn(pic)2]n难溶于水,而[NaMn(pic)3]n易溶于水。说明Na+的参与对结构以及热稳定性和溶解性能都有明显的改变。因此[Na2Mn(pda)2]n,[K2Mn(pda)2]n和[NaMn(pic)3]n晶体只能在非水溶剂中得到。而已往报道的Mn(Ⅱ)与H2pda形成的配位聚合物几乎都是在水/醇混合溶剂中获得的,故在结构中都含有多个水分子。
2.6 金属离子的半径和电荷对配合物构建的影响
用钠盐(如 NaClO4[4]或 NaCl或 Nadca)与 Mn(Ac)2·4H2O、picH和N-n-Bu4MnO4进行水热合成均易得到[NaMn(pic)3]n晶体,而分别用 KCl、Li2CO3、LiNO3、Mg(NO3)2、CaCO3以及La(NO3)3替代钠盐,在不同pH条件下进行水热合成都只能得到[Mn(pic)2]n。说明在Mn2+与picH的体系中只有Na+的半径和电荷可构成稳定性比[Mn(pic)2]n更高的Na/Mn混合金属配合物[NaMn(pic)3]n。相应金属离子半径大小顺序为:Li+(0.60)≈Mg2+(0.65)<Na+(0.95)≈Ca2+(0.99)<La3+(1.15)<K+(1.33)[12],说明在金属配位聚合物的构建中具有与大环配合物类似的特殊选择性,即与三维孔径的匹配程度决定。Li+半径偏小,而K+偏大都不易形成稳定的混合金属配位聚合物。Ca2+的半径虽与Na+接近,由于电荷不同,所形成的配合物的组成和结构也会有很大差异,故此条件下也无法获得相应的混合金属配位聚合物。
同样分别用 KOH、NaOH、LiOH与 H2pda在上述类似条件下只能得到组成类似的Na/Mn和K/Mn混合金属配位聚合物。这与Na+,K+的电荷相近,配位数均易为6有关。但由于半径不同,配合物的组成类型虽相同,其对称性和堆积方式确有明显的差异。1属于正交系,Pnna空间群;2则属于单斜系,P2/n空间群。Li+由于半径小,配位数大多为4,且半径不匹配,所以难以形成类似组成和结构的配合物。
这些结果证实,s区金属离子的半径和电荷对金属配位聚合物结构的构建和稳定性都有很大的影响。也进一步说明构建稳定的金属配位聚合物对于阳离子的高度选择性。
[1]Mulfort K L,Hupp J T.Inorg.Chem.,2008,47(18):7936-7938
[2]Rowsell J L C,Yaghi O M.J.Am.Chem.Soc.,2006,128(4):1304-1315
[3]Zhou W,Wu H,Yildirim T.J.Am.Chem.Soc.,2008,130:15268-15269
[4]XU Min(徐敏),LÜ Yin-Jie(吕英杰),DONG Wen(董文),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(5):827-830
[5]Zhang X F,Zhu H P,Liu Q T,et al.Bull.Chem.Soc.,Jpn.,2003,76:301-304
[6]Tan X S,Ma Z S,Shi N C,et al.J.Chem.Soc.,Dalton Trans.,1996:2735-2738
[7]SHI Wei(施伟),XU Ying-Kai(徐英凯),WANG Hong-Mei(王红梅),et al.Chem.J.Chinese Universities(Gaodeng XuexiaoHuaxue Xuebao),2003,24(3):516-518
[8]Vincent J B,Chang H R,Folting K.J.Am.Chem.Soc.,1987,109:5703-5711
[9]Huang D G,Wang W G,Zhang X F,et al.Eur.J.Inorg.Chem.,2004:1454-1464
[10]Xie C Z,Yu B,Wang X Q,et al.J.Coord.Chem.,2006,59(18):2005-2014
[11]Wei Y L,Hou H W,Li L K,et al.Crystal Growth Design,2005,5(4):1405-1413
[12]Winkler H G F,Translated By Shao Ke-Zhong(邵克忠).The Crystal Structure and Crystal Properitry(晶体构造和晶体性质).Beijing:Science Press,1960:337-340
Effect of s-Block Metal Ion on the Structure and Properties of Mn(Ⅱ)Coordination Polymer
XU Min*ZHOU Ai-Jü WANG Jing HONG Yan-Xia LIN Pei-Hong
(School of Chemistry&Chemical Engineering,Guangzhou University,Guangzhou 510006,China)
In the presence of s-block ion(Li+,Na+,K+,Mg2+,Ca2+),the reactions of Mn(Ac)2·4H2O with H2pda(H2pda=2,6-pyridinedicarboxylic acid)or picH(picH=picolinic acid)were studied by hydrothermal synthesis.The effect of ion radius and charge of s-block on the structure,thermal stability and solubility of Mn(Ⅱ)coordination polymer was discussed systematically.Two mixed-metal coordination polymers[Na2Mn(pda)2]n(1)and[K2Mn(pda)2]n(2)have been synthesized by hydrothermal synthesis and characterized structurally by IR and single crystal X-ray diffraction.1 crystallizes in the orthorhombic space group Pnna,2 in monoclinic space group P2/n.The aqueous solution of complex 1 shows interesting fluorescent property caused by pda2-ligand at room temperature.CCDC:898743,1;898744,2.
manganese coordination polymer;2,6-pyridinedicarboxylic acid;picolinic acid;crystal structure;hydrothermal synthesis;fluorescent property
O614.11;O614.23;O614.71+1
A
1001-4861(2012)11-2294-07
2011-08-22。收修改稿日期:2012-07-03。
国家自然科学基金(No.20901018)资助项目。
*通讯联系人。 E-mail:xuminxumin@tom.com
