对羟基苯乙酸铜(Ⅱ)、锌(Ⅲ)配位聚合物的合成、晶体结构及与DNA作用
2012-11-09吴小勇刘建风赵国良
吴小勇 刘建风 赵国良*,,2
(1浙江师范大学化学与生命科学学院,金华 321004)(2浙江师范大学行知学院,金华 321004)
对羟基苯乙酸铜(Ⅱ)、锌(Ⅲ)配位聚合物的合成、晶体结构及与DNA作用
吴小勇1刘建风1赵国良*,1,2
(1浙江师范大学化学与生命科学学院,金华 321004)(2浙江师范大学行知学院,金华 321004)
合成了两种过渡金属配合物[M(HPAA)(phen)2]HPAA·7H2O(M=Zn,1;Cu,2;HPAA-=对羟基苯乙酸根;phen=1,10-邻菲啰啉),并通过元素分析、红外光谱、热重分析对其进行表征,用单晶X-射线衍射方法测定了配合物的晶体结构。结构分析显示,两种配合物属于异质同晶型,不对称单元都是由1个金属离子,2个对羟基苯乙酸根离子,2个邻菲啰啉分子和7个游离的水分子组成的,其中有1个对羟基苯乙酸根离子未参与配位。每个金属离子的配位数为6,处于扭曲的八面体配位环境中。另外,用荧光光谱法研究了两种配合物与DNA之间的相互作用。
过渡金属配合物;对羟基苯乙酸;晶体结构 ;DNA作用
近年来,利用过渡金属配合物作为核酸断裂剂的研究与DNA作用的研究一直是较为活跃的研究领域[1-8]。许多研究显示,多吡啶铜,锌,钴等[4-8]配合物能较好地与DNA发生插入作用,因而具有许多潜在的生物活性。Cu(Ⅱ),Zn(Ⅱ)是生物体内氧化还原体系中具有独特作用的酶的活性中心,铜、锌配合物与DNA的相互作用的研究有助于认识某些疾病的致病机制和药物治病机理,这对于新型高效低毒药物的设计合成方面具有很大的指导意义[9-11]。然而具有生物活性的配合物的合成通常选用的配体一般都集中于多吡啶,席夫碱,咪唑类衍生物等[12-14]化合物,为了扩大配体的选择性。本文以对羟基苯乙酸(H2PAA)为主配体,1,10-邻菲啰啉(phen)为辅助配体,合成了两种过渡金属配合物[M(HPAA)(phen)2]HPAA·7H2O(M=Zn,1;Cu,2),并对其组成、结构和与DNA作用进行了研究。
1 实验部分
1.1 仪器与试剂
小牛胸腺DNA为生化试剂,将其用0.l mol·L-1的 NaCl溶液配成 200 μg·mL-1(cDNA=3.72×10-4mol·L-1),经纯度测定 A260/A280=1.8~2.0,置 4 ℃保存,在 4 d之内使用;Tris-HCl缓冲溶液的pH为7.40,其中cTris为 0.01 mol·L-1。对羟基苯乙酸、硫酸铜、硫酸锌、邻菲啰啉、氢氧化钠、无水乙醇、三羟甲基氨基甲烷、溴化乙锭、氯化钠等试剂均为市售分析纯试剂,使用前未做进一步处理。
碳、氢、氮含量用德国Elementar公司Vario ELⅢ型元素分析仪测定;美国Nicolet公司NEXUS 670型傅立叶变换红外光谱仪 (FTIR),KBr压片,测定范围为400~4 000 cm-1;英国爱丁堡公司FLS920全功能型稳态荧光/瞬态荧光光谱仪;瑞士METTLER-TOLEDO公司TGA/SDTA 851e型热分析仪;德国Bruker公司Smart APEXII CCD单晶衍射仪。
1.2 配合物的合成
先将1 mmol新制氢氧化锌加入20 mL 50%的乙醇溶液中,搅拌。再将含2 mmol HHPAA的50%的乙醇溶液(10 mL)滴加至氢氧化锌的烧瓶中,并不断搅拌,保持70℃水浴加热反应12 h,至无白色Zn(OH)2固体,水浴温度调至40℃,再加入含2 mmol phen的50%乙醇溶液(10 mL),有白色沉淀,继续加热12 h,过滤,滤液于室温放置14 d,有大量无色晶体析出,产率约为 34%(以 Zn(OH)2计)。对C40H44N4O13Zn 进行元素分析(Mr=854.16),实验值(%):C,53.34;H,7.00;N,4.42。计算值 (%):C,53.50;H,7.05;N,4.38。 IR(cm-1):3 444.4(w),3 056.6(w),2 923.4(w),1 562.3(m),1 514.4(s),1 381.7(m),848.3(w),726.2(m)。
用上述相同的方法,将新制氢氧化锌换成氢氧化铜,其他试剂用量不变,合成了配合物2。滤液于室温放置11 d,从滤液析出了蓝色晶体,产率为21%(以 Cu(OH)2计)。对 C40H44CuN4O13进行元素分析(Mr=852.33),实验值(%):C,55.29;H,6.05;N,4.59。计算值(%):C,55.45;H,6.14;N,4.67。IR(cm-1):3 405.6(w),3 059.3(w),2 922.6(w),1 589.3(m),1 514(s),1 373.4(m),849.2(w),723.9(m)。
1.3 晶体结构分析
选用大小为 0.329 mm×0.219 mm×0.098 mm 的配合物 1 的单晶和 0.282 mm×0.256 mm×0.130 mm的配合物2的单晶,在德国Bruker SMART APEXⅡCCD单晶衍射仪上上进行衍射实验。用辐射Mo Kα 射线(λ=0.071 073 nm),在设定的 1.71°≤θ≤27.61°范围内收集衍射数据。衍射数据用程序SADABS[15]进行经验吸收校正。晶体结构用SHELXS-97[16]软件由直接法解出,精修采用SHELXL-97[17],所有非氢原子的坐标及各向异性温度因子用全矩阵最小二乘法进行修正。除水上的氢原子外,其余氢原子均为理论加氢。水上的氢原子通过差值Fourier合成得到。主要晶体学数据列于表1,主要的键长和键角列于表2。
CCDC:729804,1;729805,2。
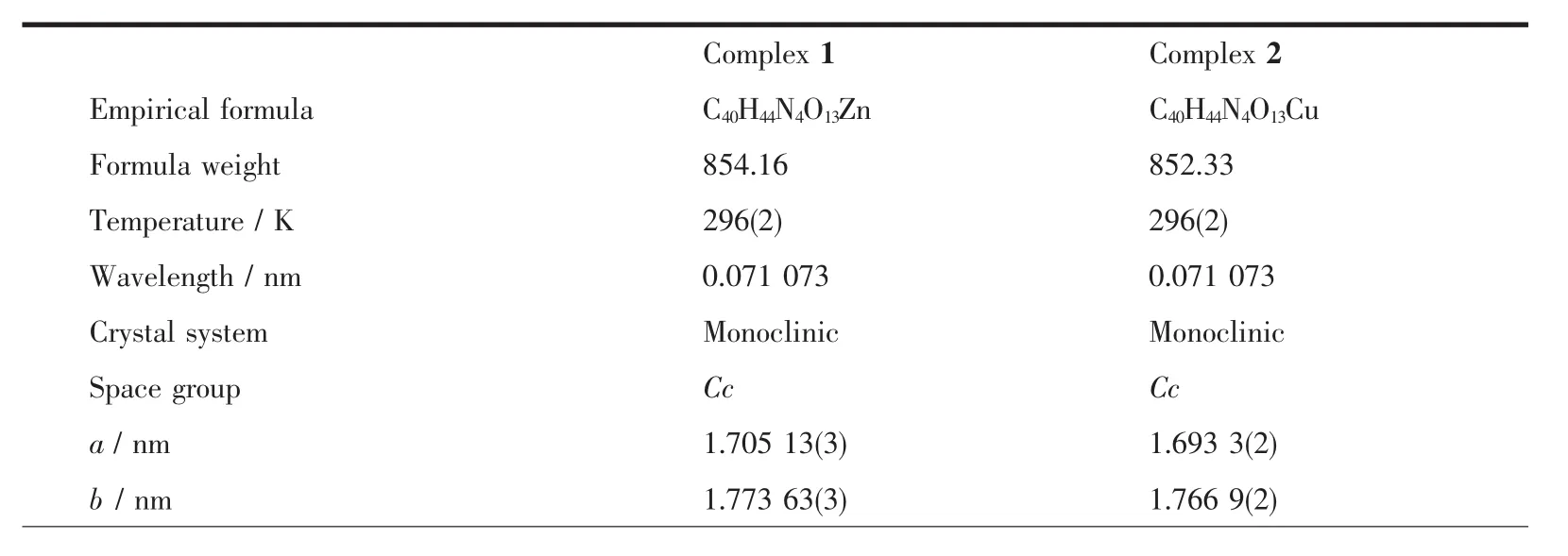
表1 配合物的晶体学数据Table 1 Crystal data of the complexes
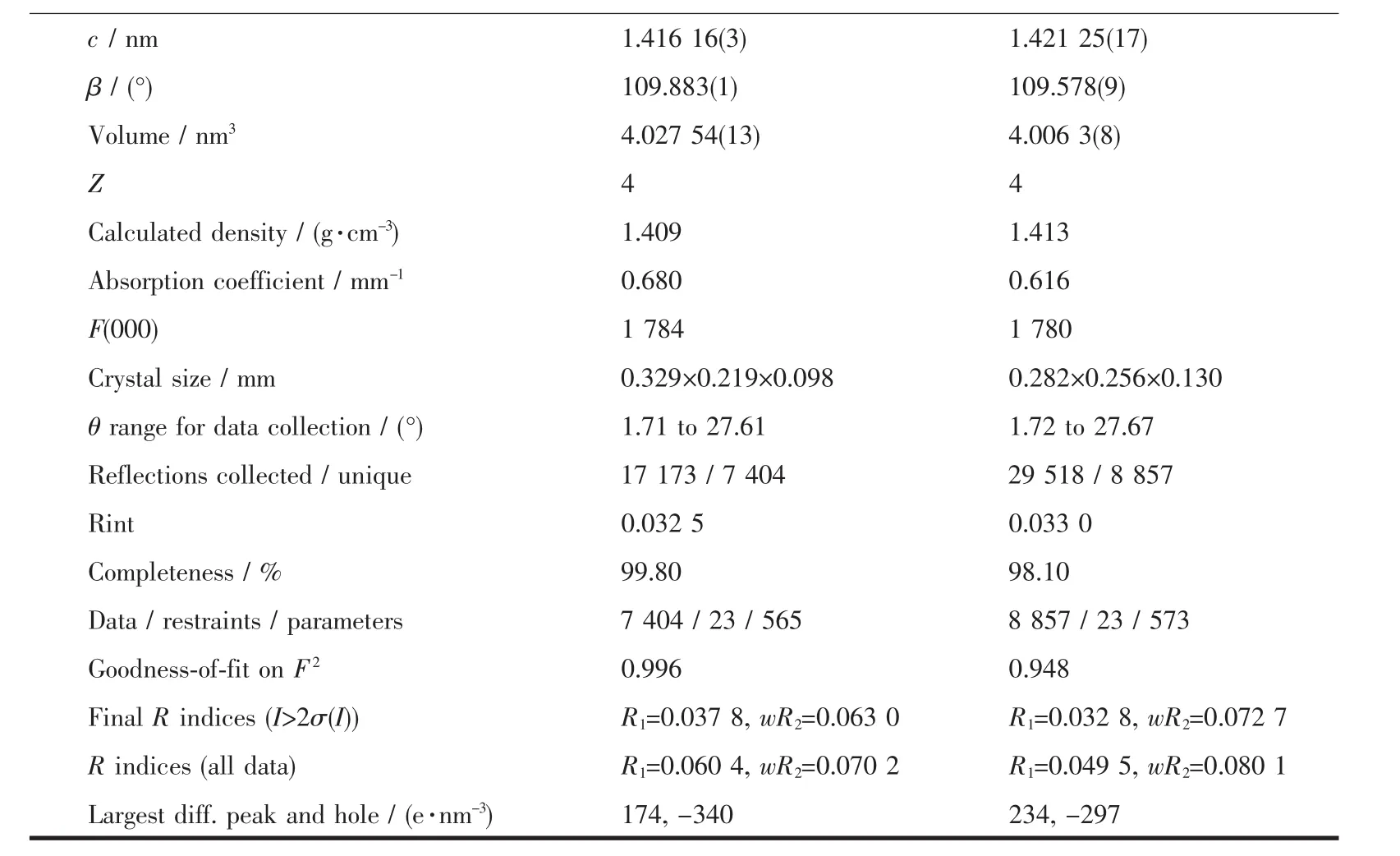
续表1

表2 配合物的主要键长和键角Table 2 Selected bond distances(nm)and bond angles(°)of complexes
1.4 配合物与DNA作用的荧光光谱
在10 mL比色管中加入1.0 mL EB溶液(200 μg·mL-1),1.0 mL DNA 溶液 (200 μg·mL-1),2.0 mL Tris缓冲溶液(pH 为 7.40),放置2 h,加入不同量的化合物溶液(10-4mol·L-1),稀释至刻度,反应 12 h,以251 nm为激发波长,扫描复合体系在520~700 nm波段的荧光光谱。
2 结果与讨论
2.1 红外光谱
由于配合物1,2红外光谱非常相似,以配合物2为代表分析产物的红外光谱图。3 405 cm-1处的宽峰属于O-H键的伸缩振动,说明配合物中含有水分子。3 059~2 922 cm-1附近的峰是-CH2-伸缩振动的特征吸收峰。形成配合物后羧基反对称伸缩振动νas(COO-)和对称伸缩振动νs(COO-)分别位于1 589和1 373 cm-1,且Δν值为216 cm-1。这表明配合物中的HPAA-的羧基部分以双齿鳌合配位形式与金属结合。1 250 cm-1的峰为酚羟基C-O伸缩振动峰。参与配位的邻菲啰啉的特征吸收峰出现在1 514、849和724 cm-1几处,与邻菲啰啉配体的特征吸收峰(1 587、862、739 cm-1)相比均向低波数移动,表明phen与金属螯合配位。这些信息与单晶结构测定的结果相符。
2.2 配合物的热重分析
配合物1和2的热分解过程相似,现以配合物1的TG-DTG曲线来分析讨论。
图1为配合物1的TG-DTG曲线,该配合物的热分解分4个阶段进行:第一个失重台阶在30~100℃之间,质量损失为14.49%,与理论失7个晶格水相吻合 (理论失重 14.76%);在 236~385 ℃之间为第二个失重台阶,失去总质量的17.86%,对应失去1个未配位的HPAA-离子,与理论值17.70%相对应;第三个失重台阶在385~496℃之间,质量损失为42.56%,与理论失去2个phen分子相对应,理论失重42.20%;496~557℃为最后一个失重台阶,失去13.14%的质量,对应一个螯合的HPAA-分解燃烧,推断残余物可能是ZnO,最终残留量为11.95%,(理论值:11.53%)。
2.3 晶体结构分析
配合物1和2属于异质同晶型,在这里仅描述配合物 1,[Zn(HPAA)(phen)2]HPAA·7H2O 的结构。从配合物1的分子结构图(图2)可以看出,该配合物的不对称单元是由1个Zn(Ⅱ)离子、2个HPAA-离子,2个phen分子和7个游离的水分子组成,其中有1个对羟基苯乙酸根离子未参与配位。Zn(Ⅱ)离子为六配位,呈畸变的八面体构型。两个对羟基苯乙酸根负离子以不同的方式存在于晶体中,其中1个以双齿螯合配位模式与Zn(Ⅱ)结合,Zn-O键长为:Zn-O(1)0.214 5(2)nm,Zn-O(2)0.231 3(2)nm,螯合角为58.67(8)°(O(1)-Zn-O(2)),与文献报道相似[18-20],苯环上的酚羟基未参与配位;另1个HPAA-离子游离,未参与配位。两个phen分子与Zn(Ⅱ)螯合配位,Zn-N键长在 0.210 8(3)~0.215 1(3)nm 之间,phen 分子的2个平面夹角为62.529(36)°。游离的HPAA-离子恰好位于这2个phen所形成的沟槽之中,它的苯环平面与其中1个phen分子近似平行,2个平面的夹角为 1.278(66)°,2 个分子之间的质心距为 0.349 62 nm,说明HPAA-与phen之间存在π-π堆积作用。而另1个phen平面与螯合配位的HPAA-苯环平面几乎平行,形成的二面角为 0.201(79)°,配体 HPAA-的苯环距离phen的质心距为0.330 05 nm。从配合物的堆积图(图3)中,可以观察到一有趣的现象,即沿c轴方向,Zn(Ⅱ)离子与其周围的配体像展翅的蝴蝶整齐的排列成行,游离的HPAA-离子与水分子填充在空隙之中。

图1 配合物1的TG和DTG曲线Fig.1 TG-DTG curves of the complex 1
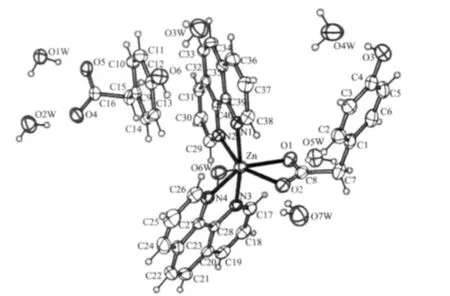
图2 配合物1的分子结构Fig.2 Molecule structure of complex 1 with ellipsoids shown at 30%level
配合物中存在着丰富的氢键。丰富的氢键不仅存在于分子内,而且存在分子间。形成氢键的原子来自于游离水分子中的氧原子,对羟基苯乙酸根中的羧基氧原子和羟基氧原子,氢键键长范围从0.182 nm(d(O(6)-H(6A)…O(5)#5),#5=x,-y+1,z+1/2)至 0.22 4(2)nm(d(O1W-H1WB…O2W))(表 3)。 通过氢键的作用,配合物进一步形成了三维网状结构见图3。氢键作用和π-π堆积作用有利于配合物的稳定。配合物2的结构与配合物1相同,氢键的连接方式也一样,只是键的长度有所不同,配合物2的氢键键长范围为 0.179(3)~0.229(2)nm(表 3)。

表3 配合物的氢键数据表Table 3 Hydrogen bond data of complexes
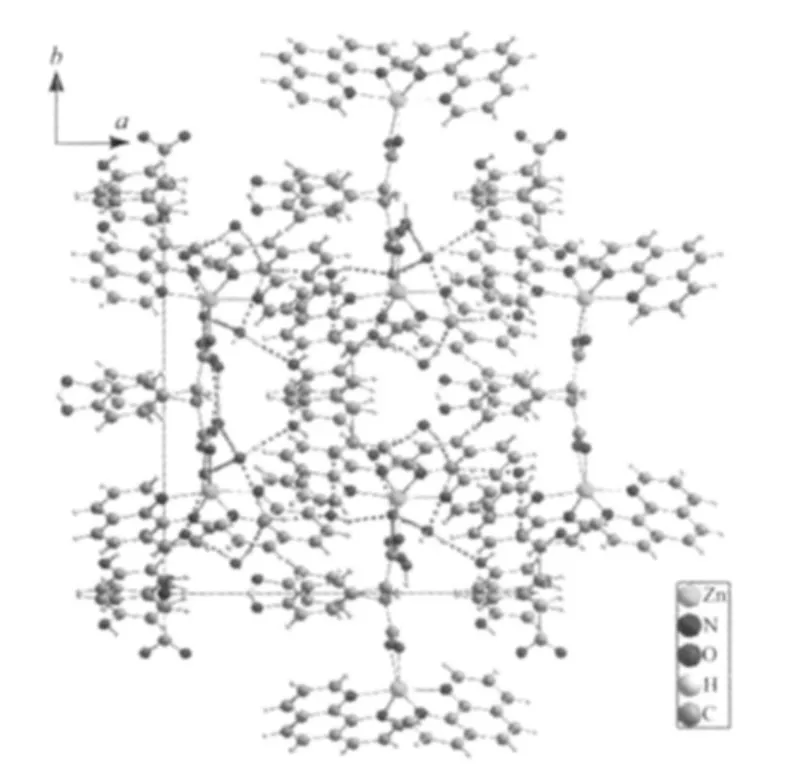
图3 配合物1的堆积图Fig.3 Packing plot of complex 1
2.4 配合物与DNA作用的荧光光谱
溴化乙锭(EB)为一共轭平面分子,其本身的荧光很弱,但能专一性地插入DNA双螺旋内部的碱基对之间使荧光显著增强。如果共存于EB-DNA复合体系中的药物分子也能与DNA发生类似于EB的插入作用,这些小分子就会竞争EB与DNA的结合位点,使EB-DNA复合体系的荧光猝灭,且EBDNA复合体系荧光猝灭的程度可以说明化合物分子与DNA插入作用的强弱。
图4为不同浓度的两种配合物对EB-DNA复合体系的荧光猝灭图,从图可看出,EB-DNA复合体系在592 nm处发出强烈的荧光,随着不同浓度的配合物的加入,EB-DNA复合体系的荧光发生了不同程度的猝灭,由此可以推测这两种配合物均与DNA发生了不同程度的插入作用。为了较为定量地研究配合物与DNA的结合能力。根据Stem-Volmer公式求得配合物对 EB-DNA体系的荧光淬灭常数[21]:I0/I=1+Ksqr,其中 I0和 I分别为 EB-DNA 复合体系和不同浓度的配合物加EB-DNA复合体系的荧光强度,r为配合物与DNA浓度之比,Ksq为线性Stem-Volmer淬灭常数 (1inear Stern-Volmer quench constant)。以I0/I对r作图(小图),直线的斜率即为Ksq。计算得出配合物1和配合物2与DNA作用的结合常数Ksq分别为1.94和1.55,其大小定量的反应出配合物与DNA插入作用的能力。两种配合物的配位环境相同,两个邻菲啰啉分子分别与金属离子双齿螯合配位,由于邻菲啰啉具有较大的刚性芳香环平面,使得配合物具有更强的插入作用。通过结合常数大小的比较,可以得出配合物1插入作用稍强于配合物2。
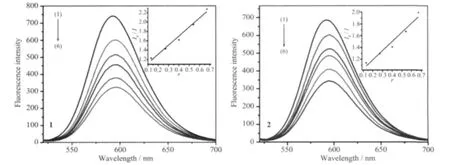
图4 配合物1,2对EB-DNA复合体系的荧光猝灭图Fig.4 Emission spectra of EB-DNA system in the absence and presence of complex 1 and complex 2
[1]LI Fen-Fang(李芬芳),LIU Xiu-Ping(刘秀萍),JIN Long-Fei(金龙飞),et al.Chemical Research(Huaxue Yanjiu),2010,21(6):18-20
[2]Nataraj C,Viswanathan M,Matthias Z,et al.Inorg.Chim.Acta,2010,363:3685-3693
[3]Ana M P,Peter J S.Biochimie,2009,91:1198-1211
[4]ZHAO Lin(赵琳),WU Bao-Yan(吴宝燕),WANG Ke-Zhi(王科志),et al.Acta Chim.Sinica(Huaxue Xuebao),2006,64(13):1402-1406
[5]Gapian B,Maxim E,Robert H,et al.Bioconjugate Chem.,2006,17:1441-1446
[6]LI Lian-Zhi(李连之),HUANG Lei(黄蕾),BIAN Lin(边琳),et al.Acta Chim.Sinica(Huaxue Xuebao),2011,69(6):647-652
[7]YANG Hao(杨浩),LIU Jian-Chao(刘建超),CHEN Wen-Tao(陈文涛).et al.Acta Chim.Sinica(Huaxue Xuebao),2010,68(6):508-514
[8]ZHANG Jun-Jun(张军军),LE Xue-Yi(乐学义).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(2):175-180
[9]Lu X Q,Zhu K M,Zhang M,et al.J.Biochem.Bioph.Methods,2002,52:189-200
[10]Tiwari A D,Mishra A K,Mamba B B,et al.Spectrochim.Acta,Part A,2011,79:1050-1056
[11]Wang Y,Okabe N.Inorg.Chim.Acta,2005,358:3407-3416
[12]Li Y,Yang Z Y,Liao Z C,et al.Inorg.Chem.Commun.,2010,13:1213-1216
[13]Raman N,Pothiraj K,Baskaran T.J.Mol.Struct.,2011,1000:135-144
[14]ZHU Li(朱莉),YU Xian-Yong(于贤勇),LONG Yun-Fei(龙云飞),et al.Acta Chim.Sinica(Huaxue Xuebao),2009,67(2):139-144
[15]ScheldrickGM.SADABS,UniversityofGöttingen,Göttingen,Germany,1996.
[16]Sheldrick G M.SHELXS 97,Program for the Solution of CrystalStructure,University ofGöttingen,Göttingen,Germany,1997.
[17]Sheldrick G M.SHELXS 97,Program for the Refinement of CrystalStructure,University ofGöttingen,Göttingen,Germany,1997.
[18]Bo Q B,Sun Z X,Sun G X,et al.J.Inorg.Organomet.Polym.,2007,17:615-622
[19]LI Xiu-Mei(李 秀梅),DONG Yan-Hui(董 艳 辉),LIU Bo(刘波),et al.Chinese J.Struct.Chem.(Jiegou Huaxue),2007,20(12):1495-1498
[20]Yin H D,Wang C H,Xing Q J.Appl.Organometal.Chem.,2005,19:402-403
[21]Lakowicz J R,Weber G.Biochmistry,1973,12(21):4161-4170
Synthesis,Crystal Structures and DNA-Binding of Cu(Ⅱ),Zn(Ⅱ)
Coordination Polymer Constructed from 4-Hydroxyphenylacetic Acid
WU Xiao-Yong1LIU Jian-Feng1ZHAO Guo-Liang*,1,2
(1College of Chemistry and Life Science,Zhejiang Normal University,Jinhua,Zhejiang 321004,China)(2Zhejiang Normal University Xingzhi College,Jinhua,Zhejiang 321004,China)
Two transition metal complexes[M(HPAA)(phen)2]HPAA·7H2O(M=Zn,1;Cu,2;HPAA-=4-hydroxyphenylacetic acid anion;phen=1,10-phenanthroline)were sythesized and characterized by elemental analysis,IR and TG-DTG.Their crystal structures were determined by single crystal X-ray diffraction method.The crystal structure anlysis reveals two complexes belong to isomorphism,and the asymmetric unit contains one metal ion,two 4-hydroxyphenylacetic acid anions and seven free water molecules,one of acid anions is not coordinated with the metal ion.The metal ion is six-coordinated and involved in a distorted octahedral coordination geometry.In addition,the interaction of complexes with DNA were also studied by ethidium bromide (EB)fluorescence spectroscopy.CCDC:729804,1;729805,2.
transition metal complex;4-hydroxyphenylacetic acid;crystal structure;DNA-binding
O614.24+1;O614.121
A
1001-4861(2012)08-1661-07
2011-12-22。收修改稿日期:2012-03-22。
浙江省自然科学基金(No.Y4080256)资助项目。
*通讯联系人。 E-mail:sky53@zjnu.cn
