用NH4F络合还原法制备的炭载Pd催化剂对甲酸分解的催化性能和甲酸氧化的电催化性能
2012-11-09沈娟章唐亚文陆天虹
沈娟章 唐亚文 陆天虹*,,3
(1江苏省新型动力电池重点实验室,南京师范大学化学与材料科学学院,南京 210097)
(2中国林业科学研究院林产化学工业研究所,南京 210042)
(3中国科学院长春应用化学研究所,长春 130022)
用NH4F络合还原法制备的炭载Pd催化剂对甲酸分解的催化性能和甲酸氧化的电催化性能
沈娟章1,2唐亚文1陆天虹*,1,3
(1江苏省新型动力电池重点实验室,南京师范大学化学与材料科学学院,南京 210097)
(2中国林业科学研究院林产化学工业研究所,南京 210042)
(3中国科学院长春应用化学研究所,长春 130022)
直接甲酸燃料电池(DFAFC)的两大问题是炭载Pd(Pd/C)催化剂对甲酸氧化的电催化稳定性不好和Pd催化剂能催化甲酸分解。发现用NH4F络合还原法制备的NH4F修饰Pd/C催化剂对甲酸氧化的电催化活性要比Pd/C催化剂好大约20%,电催化稳定性也要稍优于Pd/C催化剂。在120 s内和30℃下,甲酸在Pd/C催化剂上分解产生38 mL气体,但在NH4F修饰Pd/C催化剂上基本上不分解,因此NH4F修饰主要能抑制Pd催化剂催化分解甲酸的能力,而且又能在一定程度上提高Pd/C催化剂对甲酸氧化的电催化性能。
炭载Pd催化剂;NH4F络合还原法;甲酸氧化;甲酸分解
0 引 言
由于直接甲酸燃料电池(DFAFC)的燃料甲酸无毒、不易燃、电化学氧化性能好、对Nafion膜渗透率低等一系列优点而受到了越来越为广泛的关注[1-3]。Pd对甲酸氧化有比Pt好的电催化氧化活性[3-4],因此Pd是DFAFC中常用的阳极催化剂。但是Pd催化剂对甲酸氧化的电催化稳定性不好,这是DFAFC的一个大的问题。其次,Pd催化剂能催化甲酸的分解,甲酸被Pd催化分解的主要产物之一是CO[5-6],而CO会使Pd/C催化剂中毒,这可能是Pd/C催化剂电催化稳定性不好的原因之一。因此,最理想的是研制一种Pd催化剂,它不但对甲酸氧化有好的电催化性能,而且对甲酸分解的催化活性很低。
过去对DFAFC中Pd阳极催化剂的研究主要集中在两个方面。首先,由于常用的液相还原法制备的Pd/C催化剂粒径较大,因此,研究者主要致力于研究一些新的制备方法,如在制备Pd/C催化剂时加入稳定剂,乙二胺四乙酸(EDTA)[1],NH4OH[7],环己二胺四乙酸(CyDTA)[8],NH4VO3[9],Na2WO4[10]等,从而能制得Pd粒子的平均粒径较小的Pd/C催化剂来提高其电催化性能。其次,许多研究都集中在Pd基复合催化剂方面,如 Pd-Co[11]、Pd-Ir[12]、Pd-Au[13]、Pd-Pb[14]、Pd-Cu[15]、Pd-Sb[16]、Pd-P[17]、Pd-B[18]和Pd-杂多酸[19-20]等,这些研究主要想用Pd基复合催化剂来提高Pd催化剂对甲酸氧化的电催化稳定性。但是,还没有同时报道Pd催化剂催化分解甲酸的能力和Pd催化剂对甲酸氧化的电催化性能的文章。
本工作用NH4F络合还原法制得了NH4F修饰的Pd/C催化剂,发现该催化剂不但对甲酸氧化有很好的电催化性能,而且又能大大降低对甲酸分解的催化性能。
1 实验部分
1.1 试剂和仪器
Vulcan XC-72活性炭(粒径30 nm,美国Cabot公司)、Nafion溶液(质量分数为 5%,美国 Sigma-Aldrich公司),其余试剂均为分析纯试剂,所有溶液均用三次蒸馏水配制。
电化学测量用CHI600电化学分析仪(美国CHI仪器公司)和常规的三电极电化学池进行,X-射线衍射谱(XRD)测量D/max-rC型转靶X射线衍射仪(日本理学公司),靶压40 kV,靶流200 mA,CuKα射线源为光源,波长为0.154 18 nm,用石墨单色器滤波,闪烁计数器记录X射线强度。非金属元素分析测试用Elementar Vario EL ш仪器进行。
1.2 Pd/C催化剂的制备
1.2.1 改进的液相还原法制备Pd/C催化剂
Pd/C催化剂按文献[21]步骤进行。室温下,将60 mg Vulcan XC-72活性炭,3.13 mL 0.045 04 mol·L-1PdCl2溶液和10 mL蒸馏水混合,超声30 min后,再继续搅拌4 h后,用Na2CO3调节悬浮液pH值至8~9,然后,逐滴滴加含15 mg NaBH4的10 mL水溶液,超声20 min,再搅拌1 h。最后用三次水洗涤至无Cl-,60℃真空干燥12 h,即得含Pd质量分数为20%的Pd/C催化剂[22],并标记为Pd/C-a催化剂。
1.2.2 NH4F络合还原法制备Pd/C催化剂
与制备Pd/C-a催化剂的方法相似,只是在混合好Vulcan XC-72活性炭和PdCl2水溶液后,再加入25 mg NH4F和125 mg H3BO3溶解在10 mL蒸馏水中,混合均匀后,用浓氨水把悬浊液的pH值调节为8~9,然后,同样加入NaBH4、洗涤和干燥后,即制得含一定量NH4F和Pd质量分数为20%的Pd/C催化剂,并标记为Pd/C-b催化剂。
1.3 Pd/C催化剂的电化学性能测试
电化学测试在常规三电极体系的电化学池进行,对电极为 Pt片,参比电极为饱和甘汞电极(SCE),本文所述电位均相对于SCE,直径4 mm的玻碳电极作为工作电极的基体。
每次实验前,将玻碳电极依次用5#金相砂纸、0.3和0.05 μm的Al2O3粉磨至镜面,超声洗涤,最后用三次蒸馏水淋洗干净。然后,将4 mg Pd/C催化剂与乙醇配制成2 g·L-1的悬浮液,超声分散30 min后,移取8.9 μL悬浮液至电极表面,50℃干燥后,移取3.0 μL Nafion溶液于催化剂表面,制得的工作电极表面的Pd载量为28 μg·cm-2。
在进行循环伏安法测量时,电解液为0.5 mol· L-1H2SO4或0.5 mol·L-1H2SO4+0.5 mol·L-1HCOOH溶液。实验在(30±1)℃的温度下进行,电位扫描速率为50 mV·s-1。为了排除溶液中溶解的氧气的干扰,在电化学测试前,向电解液中通入高纯氮气15 min,测试过程中一直在溶液上方通氮气保护。4.2.4 Pd/C催化剂对甲酸分解的催化性能测试
在50 mL三颈烧瓶中加入20 mg Pd/C催化剂和30 mL 0.5 mol·L-1HCOOH溶液,在30℃下用排饱和碳酸氢钠溶液的方法收集生成的气体,每隔5 min记录1个数据,记录2 h。
2 结果与讨论
2.1 Pd/C催化剂的物理和化学表征
图1为Pd/C-a和Pd/C-b催化剂的XRD图。图中均可观察到在2θ为24.4°处XC-72活性炭中的炭(002)晶面的衍射峰。其他衍射峰的2θ值分别位于39.9°、46.1°、67.7°和81.4°处,分别相应于Pd(111)、Pd(200)、Pd(220)、Pd(311)的面心立方晶体的特征衍射峰一致,表明Pd/C-a和Pd/C-b催化剂中的Pd粒子均以面心立方结构形式存在。根据Scherrer公式[23],用Pd(220)衍射峰的半峰宽,可计算得Pd/C-a和 Pd/C-b催化剂中 Pd晶粒的平均粒径分别为4.5和3.8 nm,两种催化剂中Pd晶粒的平均粒径差别不大。
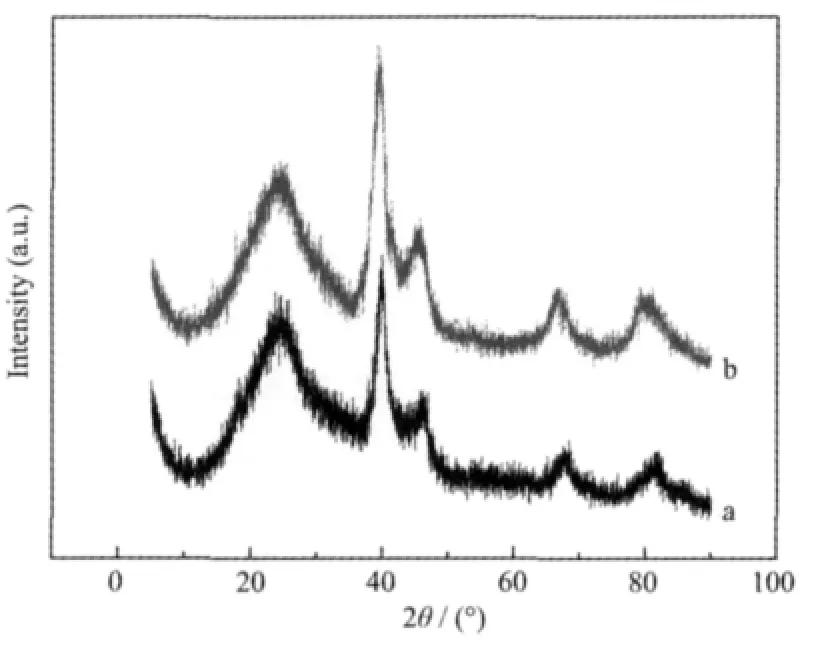
图1 2种催化剂的XRD图Fig.1 XRD patterns for(a)Pd/C-a and(b)Pd/C-b catalysts
催化剂中非金属元素含量的测试表明,Pd/C-b催化剂中N元素的含量比Pd/C-a中的多0.033%,说明Pd/C-b催化剂中含有N元素的化合物。由于在Pd/C-b催化剂制备时,加入的含N元素的化合物只有NH4F,因此,这表明在Pd/C-b催化剂上含有吸附的NH4F。
2.2 Pd/C催化剂对甲酸氧化的电催化性能
图2为在H2SO4溶液中的甲酸在Pd/C-a和Pd/ C-b催化剂电极上的线性扫描伏安曲线。由图可见,甲酸在Pd/C-a和Pd/C-b催化剂电极上的氧化峰电流密度分别为9.3和11.1 mA·cm-2,这表明Pd/C-b催化剂对甲酸氧化的电催化活性要比Pd/C-a催化剂好大约20%。
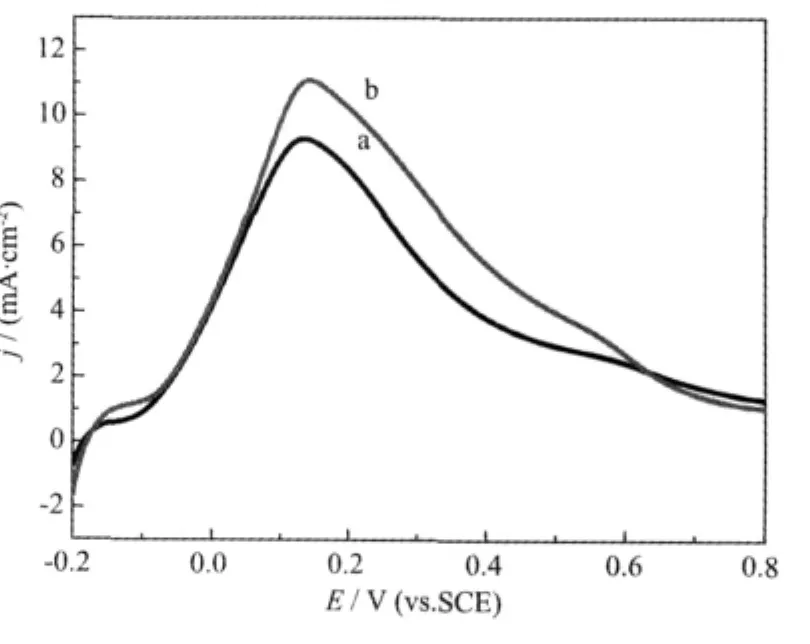
图2 在H2SO4溶液中的甲酸在2种催化剂电极上的线性扫描伏安曲线Fig.2 Linear sweeping voltammograms for 0.5 mol·L-1 HCOOH in 0.5 mol·L-1H2SO4solution at(a)Pd/ C-a and(b)Pd/C-b catalyst electrodes
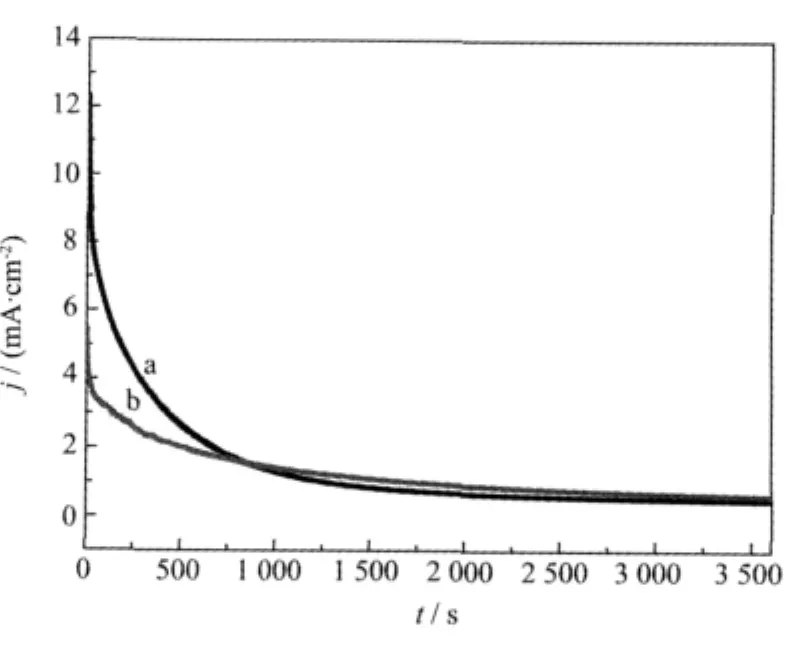
图3 在H2SO4溶液中的甲酸在两种催化剂电极上,在0.10 V下的计时电流曲线Fig.3 Chronoamperometric curves for 0.50 mol·L-1 HOOH in 0.50 mol·L-1H2SO4solution at(a) Pd/C-a and(b)Pd/C-b catalyst electrodes and at 0.1 V
图3为在H2SO4溶液中的甲酸在Pd/C-a和Pd/ C-b催化剂电极上,在0.10 V下的计时电流曲线。为了避免电极的双电层放电以及吸附氢的氧化产生的电流贡献,我们选择10 s时的电流作为参比初始电流[24]。经计算,在3 600 s时,甲酸在Pd/C-a和Pd/C-b催化剂电极上氧化电流分别衰减到初始电流的5.1%和15.0%,说明Pd/C-b催化剂对甲酸氧化的电催化稳定性稍优于Pd/C-a催化剂。
2.3 Pd/C催化剂对甲酸分解的催化性能
图4为在30℃时,甲酸在Pd/C-a和Pd/C-b催化剂上分解产生气体的体积与时间关系曲线。由图可见,Pd/C-a催化剂对甲酸分解产生的气体体积基本上随时间直线上升,表明Pd/C-a催化剂对甲酸分解有好的催化作用,而甲酸在Pd/C-b催化剂上基本不分解,表明Pd/C-b催化剂对甲酸分解基本上没有催化活性。
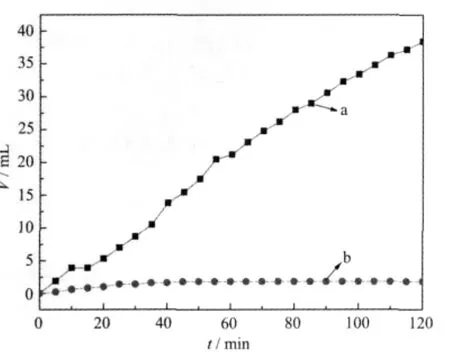
图4 在30℃时,甲酸在2种催化剂上分解产生气体的体积-时间关系曲线Fig.4 Relationship between the volume of the decomposed gas and the time on(a)Pd/C-a and(b)Pd/C-b catalysts in 0.5 mol·L-1HCOOH solution at 30℃
图5是溶液中的NH4F对Pd/C-a催化剂催化甲酸分解产生的气体体积与时间关系的影响曲线。由图可见,在Pd/C-a催化剂和甲酸悬浊液中加入NH4F溶液未抑制甲酸的分解,反而促进了甲酸分解,表明溶液中的NH4F不抑制甲酸在Pd/C-a催化剂上分解。
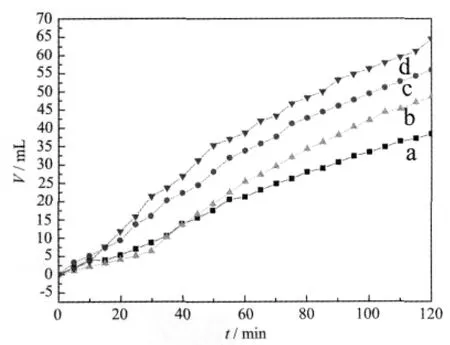
图5 在30℃时,NH4F、H3BO3和NH4F+H3BO3存在时,Pd/C-a催化剂催化甲酸分解产生的气体体积与时间关系曲线Fig.5 Relationshipbetweenthevolumeofthedecomposed gas and the time on Pd/C-a catalyst in(a)0.5 mol·L-1HCOOH,(b)0.5 mol·L-1HCOOH+1×10-4 mol·L-1H3BO3,(c)0.5 mol·L-1HCOOH+2×10-3 g·L-1NH4F and(d)0.5 mol·L-1HCOOH+2×10-3 g·L-1NH4F+1×10-2g·L-1H3B O3solutions at 30℃
2.4 在电解液中存在NH4F时Pd/C催化剂对甲酸氧化的电催化性能
图6为在含和不含NH4F的H2SO4溶液中的甲酸在Pd/C-a催化剂电极上的线性扫描伏安曲线。由图可见,在含和不含NH4F的H2SO4溶液中,甲酸氧化峰峰电流密度分别为7.4和9.8 mA·cm-2,表明在电解液中NH4F的加入降低了Pd/C-a催化剂电极对甲酸氧化的电催化活性。
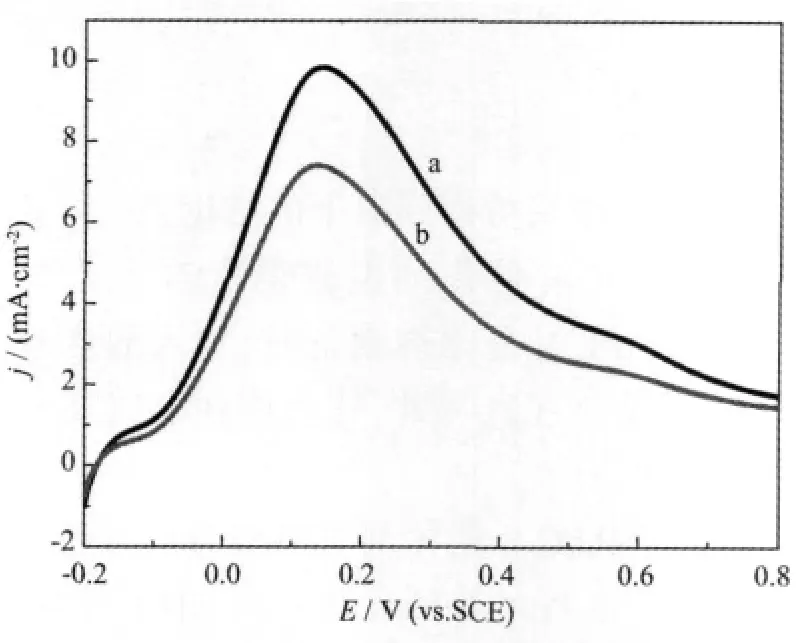
图6 在不含和含NH4F的H2SO4溶液中的甲酸在Pd/C-a催化剂电极上的线性扫描伏安曲线Fig.6 Linear sweeping voltammograms for 0.5 mol·L-1 HCOOH in 0.5 mol·L-1H2SO4solution(a)without and(b)with 0.1 g·L-1NH4F at the Pd/C-a catalyst electrode
图7为在含和不含NH4F的H2SO4溶液中的甲酸在Pd/C-a催化剂电极上,在0.1 V下的计时电流曲线。选择10 s时的电流作为参比初始电流[24],经计算,在6 000 s时,甲酸在含和不含NH4F的Pd/C-a催化剂电极上氧化电流分别衰减到初始电流的4.3%和9.5%,说明在电解液中加入NH4F之后,Pd/C-a催化剂电极对甲酸氧化的电催化稳定性降低了。
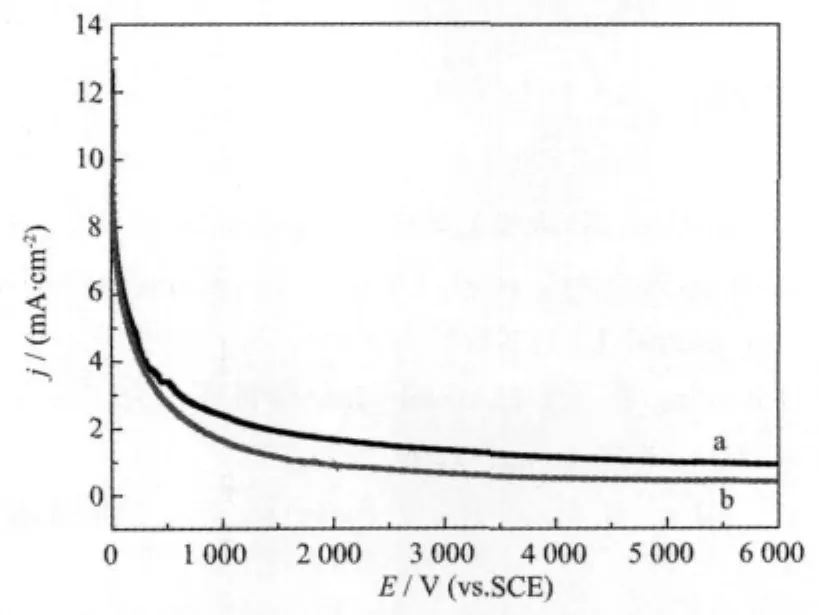
图7 在不含和含NH4F的H2SO4溶液中,甲酸在Pd/C-a催化剂电极上,在0.1 V下的计时电流曲线Fig.7 Chronoamperometric curves for 0.5 mol·L-1 HCOOH in 0.5 mol·L-1H2SO4solution(a) without and(b)with 0.1 g·L-1NH4F at the Pd/ C-a catalyst electrode and at 0.1 V
从图5、6和7的结果来看,在Pd/C催化剂上吸附NH4F和在溶液中加NH4F无论对Pd/C催化剂对甲酸氧化的电催化性能和对Pd/C催化剂对甲酸分解的催化性能的影响很不相同,这是一个很有吸引力的相信。其原因目前还不很清楚,还需进一步的研究。
3 结 论
从上述的结果可得到以下的结论:
(1)在Pd/C-b催化剂上测得含N元素的化合物,由于在Pd/C-b催化剂制备时,加入的含N元素的化合物只有NH4F,因此,这表明在Pd/C-b催化剂上含有NH4F。
(2)由于Pd/C-b催化剂对甲酸分解几乎没有催化性能,表明在Pd/C-b催化剂上的NH4F能抑制Pd/ C催化剂对甲酸分解的催化性能。
(3)由于Pd/C-b催化剂对甲酸氧化的电催化性能要稍好于Pd/C催化剂,表明在Pd/C-b催化剂上的NH4F能稍提高Pd/C催化剂对甲酸氧化的电催化性能。
(3)而加在电解液中的NH4F既能促进Pd/C催化剂对甲酸分解的催化性能,又会降低Pd/C催化剂对甲酸氧化的电催化性能。表明加在电解液中的NH4F和固定在Pd/C催化剂上的NH4F的作用完全不同,其原因在目前还不清楚,需要进一步研究。
[1]LU Tian-Hong(陆天虹),TANG Ya-Wen(唐亚文),ZHANG Ling-Ling(张玲玲),et al.Chinese Battery Industry(Dianchi Gongye),2007,12:412-414
[2]HONG-Ping(洪平),LIAO Shi-Jun(廖世军).Modern Chem. Ind.(Xiandai Huagong),2009,29:15-22
[3]Ha S,Adams B,Masel R I.J.Power Sources,2004,128:119-124
[4]Rhee Y W,Ha S,Rice C,et al.J.Power Sources,2003,117: 35-38
[5]Yu J L,Savage P E.Ind.Eng.Chem.Res.,1998,37:2-10
[6]Lu G Q,Crown A,Wieckowski A.J.Phys.Chem.B,1999, 103:9700-9711
[7]Li H Q,Sun G Q,Jiang Q,et al.J.Power Sources,2007, 172:641-649
[8]Zhu Y,Kang Y Y,Zou Z Q,et al.Eleetroehem.Commun., 2008,10:802-805
[9]Wang X M,Xia Y Y.Electrochimca Acta,2009,54:7525-7530
[10]Ge J J,Zhang Y W,Liu C P,et al.J.Phy.Chem.C,2008, 112:17214-17218
[11]Wang R F,Liao S J,Ji S.J.Power Sources,2008,180:205-208
[12]Wang X,Tang Y W,Gao Y,et al.J.Power Sources,2008, 175:784-788
[13]Zhou W J,Lee J Y.Electrochem.Commun.,2007,9:1725-1729
[14]Alden L R,Han D K,Matsumoto F,et al.J.Chem.Mater., 2006,18:5591-5596
[15]Brandt K,Steinhausen M,Wandelt K.J.Electroanal.Chem., 2008,616:27-37
[16]Yu X W,Pickup P G.Electrochem.Commun.,2010,12:800-803
[17]Zhang L L,Tang Y W,Bao J C,et al.J.Power Sources, 2006,162:177-179
[18]Wang J Y,Kang Y Y,Yang H,et al.J.Phys.Chem.C, 2009,113:8366-8372.
[19]YANG Gai-Xiu(杨改秀),DENG Ling-Juan(邓玲娟),TANG Ya-Wen(唐亚文),et al.Chem.J.Chinese Univ.(Gaodeng Xuexiao Huaxue Xuebao),2009,30:1173-1176
[20]YANG Gai-Xiu(杨改秀),CHEN Ting-Ting(陈婷婷),TANG Ya-Wen(唐亚文),et al.Acta Physico-Chimica Sinica(Wuli Huaxue Xuebao),2009,25:2450-2454
[21]Zhang L L,Lu T H,Bao J C,et al.Electrochem.Commun., 2006,8:16251627
[22]CHEN-Ying(陈滢),TANG Ya-Wen(唐亚文),GAO-Ying (高颖),et al.Chinese J.Appl.Chem.(Yingyong Huaxue), 2009,26:985-988
[23]Antolini E,Cardellini F.J.Alloys.Compd.,2001,315:118-122
[24]Chen W,Kim J M,Sun S H,et al.Langmuir,2007,23: 11303-11310
Catalytic Ability for Formic Acid Decomposition and Electrocatalytic Performance for Formic Acid Oxidation of Carbon Supported Pd Catalyst Prepared with NH4F Complexing Reduction Method
SHEN Juan-Zhang1,2TANG Ya-Wen1LU Tian-Hong*,1,3
(1Jiangsu Key Laboratory of New Power Batteries,School of Chemistry and Material Science,Nanjing Normal University,Nanjing210097,China)
(2Institute of Chemical Industry of Forest Products,Chinese Academy of Forestry,Nanjing210042,China)
(3Changchun Institute of Applied Chemistry,Chinese Academy of Sciences,Changchun 130022,China)
The poor electrocatalytic stability of the Pd/C catalyst and the catalytic decomposition of formic acid by the Pd/C catalyst are two problems for direct formic acid fuel cell (DFAFC).The results show that the electrocatalytic activity of the NH4F modified Pd/C catalyst prepared with NH4F complexing reduction method for formic acid oxidation is about 20%better than that of the Pd/C catalyst.The electrocatalytic stability of the title catalyst is also better than that of the Pd/C catalyst.Furthermore,formic acid can be decomposed on the Pd/C catalyst to produce 38 mL gas in 120 s at 30℃.However,formic acid is almost not decomposed on the NH4F modified Pd/C catalyst.The NH4F modification can mainly inhibit the catalytic ability for the decomposition of formic acid on the Pd/C catalyst.In addition,it can increase in a certain extent the electrocatalytic performance of the Pd/C catalyst for the formic acid oxidation.
carbon supported Pd catalyst;NH4F complexing reduction method;formic acid oxidation;decomposition of formic acid
O646
A
1001-4861(2012)02-0326-05
2011-06-18。收修改稿日期:2011-08-21。
国家自然科学基金(No.20873065、21073094)和江苏高校优势学科建设工程资助项目。*
。E-mail:tianhonglu@263.net
