不同入肝血流阻断方式对大鼠肝切除术后肝再生的影响
2012-11-08王鹏飞李崇辉张爱群蔡守旺董家鸿
王鹏飞,李崇辉,张爱群,蔡守旺,董家鸿
中国人民解放军总医院肝胆外科 全军肝胆外科研究所,北京100853
肝脏是全身唯一的有两套供血系统的器官,其中门静脉供血占70%~80%,肝动脉占20%~30%,正常情况下肝窦内血供主要来源于门静脉,当门静脉阻断时,静脉窦内血流显著降低甚至难以测到,而阻断肝动脉时,肝血窦内仍保留80%的血流[1]。目前大多外科医生进行肝脏手术时为减少离断肝实质时的出血量,采用肝蒂三联阻断 (occlusion of portal triad,OPT)法 (即Pringle法),但该法不可避免会对剩余肝脏造成缺血再灌注损伤,从而影响患者的愈后[2]。同时,笔者临床观察发现,采用保留肝动脉的入肝血流阻断方法同样能达到较好的止血效果。本研究组之前的动物研究也证实该方法可以大大减轻肝脏缺血再灌注损伤[3]。但是该方法与传统Pringle手法对肝再生的影响鲜有报道。本实验以不阻断入肝血流单纯切除大鼠68%肝脏为对照组,对比研究传统的OPT法与保留肝动脉单纯门静脉阻断(occlusion of portal vein,OPV)法对大鼠肝切除术后肝再生的影响。
材料和方法
实验动物健康雄性Wistar大鼠,体重240~260 g,由军事医学科学院实验动物中心提供。自由饮水,随意进食,12 h照明,适应环境1周后开始实验。
动物模型的建立
实验动物分组:采用经尾状叶转流门静脉血流阻断模型,按Higgins法切除大鼠68%肝脏,根据阻断方式将健康雄性Wistar大鼠随机分为3组:对照组、OPT组和OPV组。
手术操作:术前12 h禁食,不禁水。用10%水合氯醛按3 ml/kg剂量腹腔内注射麻醉。仰卧位固定后碘伏消毒,取上腹正中切口约1.5~2.0 cm入腹,充分显露肝区结构,离断肝周韧带,以显微外科方法分离出拟阻断血管。OPT组:为避免肠道淤血干扰研究结果,选择经尾状叶转流门静脉血流阻断模型[4]:用小号动脉夹分别阻断肝左、右叶肝蒂 (约占全肝95%),造成受累肝叶缺血,保留尾状叶(约占全肝5%)血供,作为门静脉血液经肝脏回流入下腔静脉的通道。OPV组:两个血管夹分别只阻断肝左叶、右叶肝蒂内门静脉,达到预定阻断时间后去除阻断夹。OPT组和OPV组达到预定阻断时限后按照Higgins法切除68%肝脏,对照组不阻断血流,仅切除68%肝脏,保证每只大鼠总的手术时间均为60 min。生理盐水灌洗切除肝脏后称取肝脏湿重W1,分层连续缝合关腹。术中腹腔补充5 ml温热生理盐水,术后电热毯保温到苏醒,自由进食水。
标本收集及处理观察3 d、7 d两个时相点,每个时相点保证至少8只大鼠存活。
肝组织放射性活度:每只大鼠二次开腹后于下腔静脉注射0.3 ml药盒法标记的99Tcm-GSA,放射量约37 MBq(高锝酸钠注射液购自原子高科有限公司,GSA购自北京师宏药物研制中心)。注射后15 min断头处死,取出肝脏,生理盐水灌洗后称得重量W2,并在放射性活度计 (CRC-25R,美国CAPINTEC INC.)内测量其放射性计数N,放射性活度=N/W2[5]。用10%福尔马林溶液固定标本,石蜡包埋,切片后免疫组织化学检测。
肝再生度:每只大鼠术后均称取肝脏湿重W1,根据切除肝脏占整体肝脏68%,算得大鼠原肝脏重量W0=W1/0.68,二次手术时切取全部肝脏后称重W2,肝再生度=(W2-W0×0.32)/W0×100%。
增殖细胞核抗原 (proliferating cell nuclear antigen,PCNA)标记指数:石蜡切片按照说明书以PCNA单抗 (DAKO公司)进行免疫组化染色,以联苯二氧胺显色,甲基绿复染。本实验的阳性染色信号呈棕黄色。PCNA标记指数以每例在光镜下随机挑选5个高倍视野 (×400)中至少1000个细胞,计数的PCNA阳性核的百分数来表示 (阳性细胞数目/计数的肝细胞总数×100%)。
Ki-67标记指数:石蜡切片按照说明书以Ki-67单抗 (abcam公司)进行免疫组化染色,以联苯二氧胺显色,甲基绿复染。本实验的阳性染色信号呈棕黄色。Ki-67标记指数以每例在光镜下随机挑选5个高倍视野 (×400)中至少1000个细胞,计数的Ki-67阳性核的百分数来表示 (阳性细胞数目/计数的肝细胞总数×100%)。
统计学处理实验数据以均数±标准差表示。采用SPSS 13.0统计软件进行SNK-q检验,以P<0.05为差异有统计学意义。
结 果
安全阻断时限Higgins法切除大鼠肝脏之前,各组入肝血流阻断时间分别为20、30、40 min时,OPT组术后7 d的存活情况为5/5、3/5、0/5,OPV组术后7 d的存活情况为5/5、4/5、3/5。阻断40 min后行肝切除术,术后1周内OPV组生存率明显高于OPT组。考虑到大鼠生存率,将后续实验的阻断时限设定为30 min。
肝再生度各组大鼠肝切除术后肝再生度结果显示:3 d和7 d两个时相点,OPV组术后肝再生度与对照组接近,两组均高于OPT组,但差异无统计学意义 (P>0.05)(表1)。
放射性活度各组大鼠术后3 d及7 d放射性活度结果显示:术后第3天,对照组和OPV组的肝组织放射性活度均大于OPT组,差异具有统计学意义(P均<0.05);术后第7天,各组之间放射性活度差异无统计学意义 (P>0.05)(表1)。
肝细胞PCNA标记指数各组大鼠术后3 d及7 d PCNA标记指数结果显示:术后第3天,对照组和OPV组的PCNA标记指数均大于OPT组,差异具有统计学意义 (P均<0.01);而对照组和OPV组之间差异无统计学意义 (P>0.05)。术后第7天,对照组、OPV组和OPT组之间的PCNA标记指数差异无统计学意义 (P>0.05)(表1)。免疫组化染色结果见图1。
再生肝脏Ki-67标记指数各组大鼠肝切除术后3 d及7 d Ki-67标记指数结果显示:术后第3天,对照组Ki-67标记指数大于OPT组,差异具有统计学意义 (P<0.01);OPV组Ki-67标记指数亦大于OPT组,差异具有统计学意义 (P<0.05);且对照组和OPV组之间差异无统计学意义 (P>0.05)。术后第7天,对照组、OPV组和OPT组之间的Ki-67标记指数差异无统计学意义 (P>0.05)(表1)。免疫组化染色结果见图2。
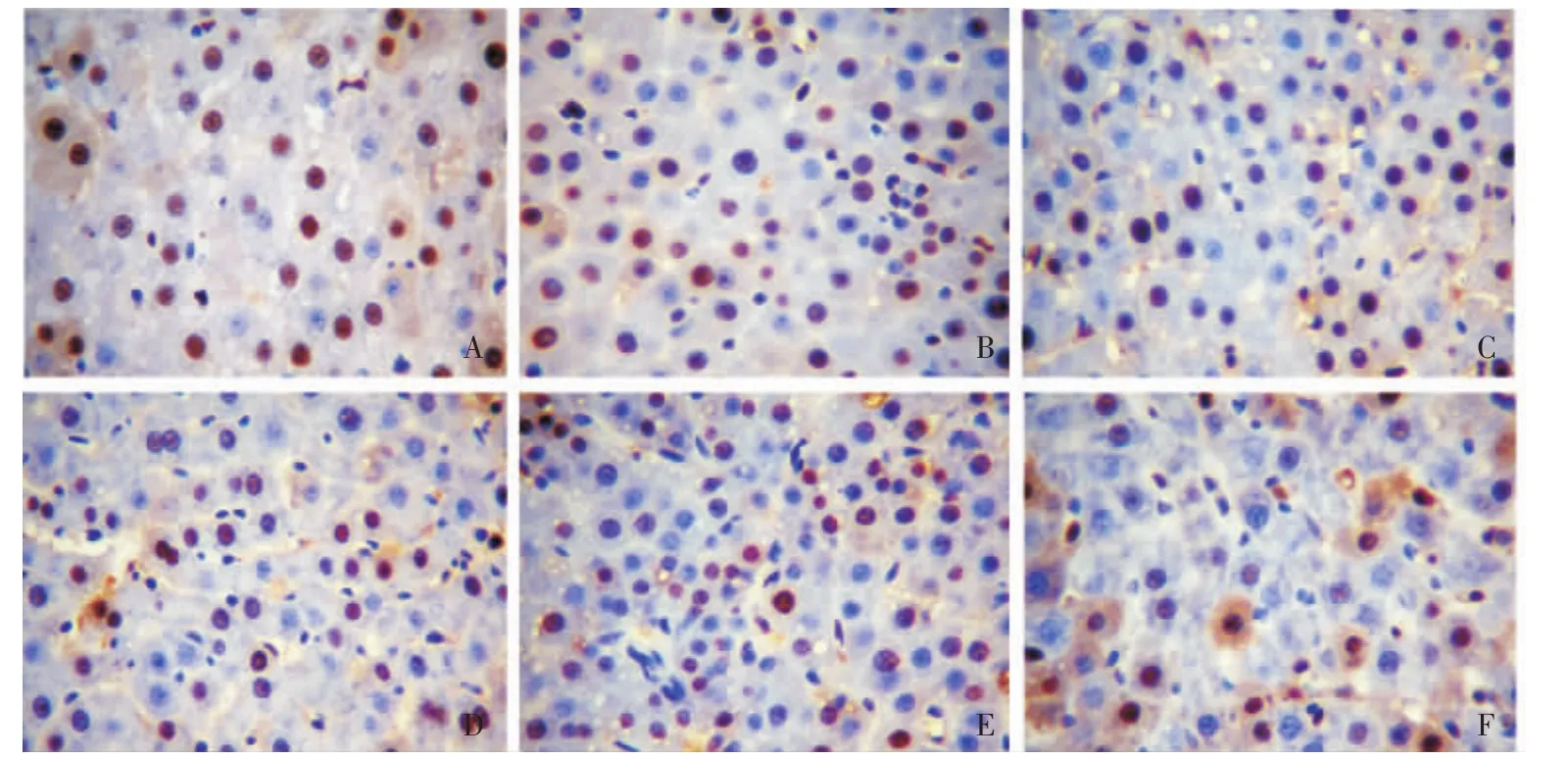
图1 各组大鼠术后剩余再生肝脏PCNA免疫组化染色结果 (×400)Fig 1 Immunohistochemistry of residual liver for PCNA in each group after hepatectomy(×400)
表1 各组大鼠肝切除术后肝再生度、再生肝脏的放射性活度、PCNA标记指数和Ki-67标记指数 (±s)Table 1 Liver regeneration rate,radioactivity,and PCNA and Ki-67 labeling index in each group following hepatectomy(±s)
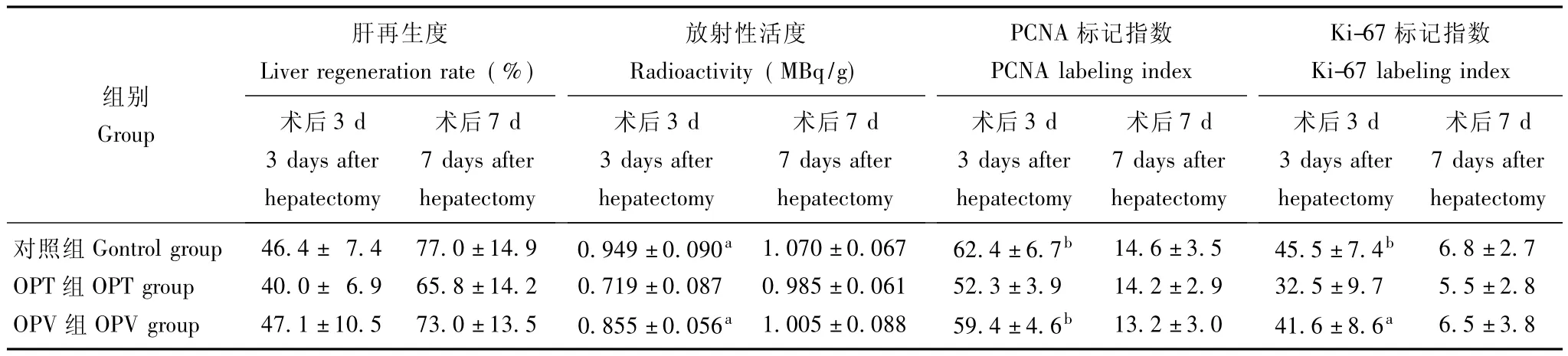
表1 各组大鼠肝切除术后肝再生度、再生肝脏的放射性活度、PCNA标记指数和Ki-67标记指数 (±s)Table 1 Liver regeneration rate,radioactivity,and PCNA and Ki-67 labeling index in each group following hepatectomy(±s)
与 OPT组比较,aP<0.05,bP<0.01aP <0.05,bP <0.01 compared with OPT group
肝再生度Liver regeneration rate(%)放射性活度Radioactivity(MBq/g)PCNA标记指数Ki-67标记指数组别Group 术后7 d 7 days after术后7 d 7 days after术后7 d 7 days after术后7 d 7 days after术后3 d 3 days after hepatectomy hepatectomy术后3 d 3 days after hepatectomy hepatectomy对照组Gontrol group 46.4± 7.4 77.0±14.9 0.949±0.090a 1.070±0.067 62.4±6.7b 14.6±3.5 45.5±7.4b 6.8±2.7 OPT组OPT group 40.0± 6.9 65.8±14.2 0.719±0.087 0.985±0.061 52.3±3.9 14.2±2.9 32.5±9.7 5.5±2.8 OPV组OPV group 47.1±10.5 73.0±13.5 0.855±0.056a 1.005±0.088 59.4±4.6b 13.2±3.0 41.6±8.6a hepatectomy PCNA labeling index术后3 d 3 days after hepatectomy hepatectomy Ki-67 labeling index术后3 d 3 days after hepatectomy 6.5±3.8

图2 各组大鼠术后剩余再生肝脏Ki-67免疫组化染色结果 (×400)Fig 2 Immunohistochemistry of residual liver for Ki-67 in each group after hepatectomy(×400)
讨 论
肝脏是一个血供丰富的内脏器官,肝切除过程中肝创面出血是影响手术及术后患者恢复的重要因素[6]。自1908年Pringle提出通过阻断肝蒂的入肝血流来减少肝脏手术出血的方法后,研究者们又提出多种改良方法,很大程度上提高了肝脏手术的安全性,促进了复杂肝脏手术的开展。然而,这些阻断方法不可避免会对剩余肝脏造成缺血再灌注损伤[2]。正常情况下,肝动脉提供肝脏50%以上的供氧量,有研究表明肝动脉有较高的压力梯度,能充分灌流肝脏血管网络的每一个角落,门静脉阻断时尽管入肝血流量大大降低,但是通过测定组织氧分压,发现肝动脉依然可以满足肝组织代谢所需氧分[7]。笔者通过临床观察发现,手术中保留肝动脉单纯阻断门静脉同样能达到较好的止血效果,并且可以一定程度上延长连续阻断时间,避免了Pringle手法反复阻断开放而增加的手术时间和开放等候时增加的无益出血量,且术后患者恢复良好,未出现严重并发症。本研究所前期的动物研究采用相同的分组方法,比较了血生化指标谷丙转氨酶、谷草转氨酶,氧化应激指标丙二醛、过氧化物歧化酶,细胞能量代谢指标Na-K-ATP酶以及HE染色病理切片,结果显示保留肝动脉的入肝血流阻断方法缓解了由于阻断肝门血流而引起的肝细胞能量匮乏,可稳定细胞结构,减少细胞损伤,大大减少了剩余肝脏的缺血再灌注损伤[3]。肝脏再生能力是肝部分切除术后肝功能恢复的关键因素,本研究的着眼点即对比不同入肝血流阻断方式对肝再生的影响。
评价肝再生的方法有很多,肝再生度表示再生肝重占原肝重的百分率,在一定程度上能较好地反映再生肝脏的增长情况,是一种较直观、简单的方法[8]。此外免疫组织化学方法具有简单、迅速,且能保持组织结构完整性等优点而受到广泛重视,本实验采用了国内外研究通用的PCNA和Ki-67两个肝再生指标,PCNA在细胞周期的S期高峰表达,Ki-67则在M期高峰表达,同时观察上述两项指标,可以较客观地反映肝再生情况[9-10]。从本实验的结果可知,虽然各组在术后3 d、7 d两时相点上肝再生度差异无统计学意义,但是在术后第3天,OPV组PCNA标记指数和Ki-67标记指数显著高于OPT组,且与单纯切肝对照组差异均无统计学意义。说明在保留肝动脉的入肝血流阻断方法下行肝切除术后,虽然在重量和体积方面还没有体现出相对于完全阻断组的明显优势,但早期 (3 d)核蛋白表达明显增强,提示残肝肝细胞增殖活跃,更有利于术后肝再生及早期恢复。
正如临床上经常碰到的问题一样,肝脏的体积大小并不总能代表肝脏功能的好坏,功能性肝再生也不完全同步于体积性肝再生[11]。近些年来,99Tcm-GSA越来越多地被用于评估肝脏功能的动物实验及临床工作。其机制是GSA可以与仅在哺乳动物的肝细胞表面表达的去唾液酸糖蛋白受体特异性结合[12]。日本及国内的多个研究表明,在肝炎、肝硬化或肝癌等肝损伤性疾病发生时,哺乳动物肝细胞膜上的去唾液酸糖蛋白受体数量和活性均受到损害,肝脏组织的放射性活度均降低[5,13]。本研究结果显示术后第3天,OPV组肝脏的放射性活度明显高于OPT组,与对照组差异无统计学意义,表明OPV组肝脏细胞表面去唾液酸糖蛋白受体数量更多,即功能性肝体积要优于OPT组。这提示在肝切除手术中,采用保留肝动脉血供的入肝血流阻断方法在减少缺血再灌注损伤的同时更有利于剩余肝脏早期再生,相比临床常用的Pringle法有较大的优势。
总之,保留肝动脉入肝血流阻断法肝切除组相比完全入肝血流阻断组,术后早期虽然肝脏再生度差异无统计学意义,但是再生核蛋白表达显著增加,功能性肝体积亦显著增大,且与不阻断对照组差异无统计学意义,提示保留肝动脉减轻缺血再灌注损伤的同时也有利于术后早期剩余肝脏再生。这或许提示在临床工作中,保留肝动脉血供的入肝血流阻断法是一个值得推广的更好的肝血流阻断方法。
[1]Oda M,Yokomori H,Han JY.Regulatory mechanisms of hepatic microcirculation [J].Clin Hemorheol Microcirc,2003,29(3):167-182.
[2]Grace PA.Ischemia-reperfusion injury [J].Br J Surg,1994,81(5):637-647.
[3]Wei Chen Y,Hui Li C,Dong JH,et al.Preserving hepatic artery flow during portal triad blood inflow occlusion reduces liver ischemia-reperfusion injury in rats[EB/OL].[2011-05-20].http://dx.doi.org/10.1016/j.jss.2010.11.913.
[4]董家鸿,何效东,李昆,等.大鼠门静脉转流下耐受入肝血流阻断的安全时限[J].中华消化外科杂志,2002,1(1):20-24.
[5]毛一雷,张现忠,董一女,等.99mTc-DTPA-半乳糖人血清白蛋白在不同小鼠肝损伤模型中肝功能显像的应用[J].中国医学科学院学报,2008,30(4):404-408.
[6]Jarnagin WR,Gonen M,Fong Y,et al.Improvement in perioperative outcome after hepatic resection:Analysis of 1803 consecutive cases over the past decade[J].Ann Surg,2002,236(4):397-407.
[7]Richter S,Vollmar B,Mucke I,et al.Hepatic arterioloportal venular shunting guarantees maintenance of nutritional microvascular supply in hepatic arterial buffer response of rat livers [J].J Physiol,2001,531(Pt1):193-201.
[8]Chijiiwa K,Nakano K,Kameoka N,et al.Proliferating cell nuclear antigen,plasma fibronectin,and liver regeneration rate after seventy percent hepatectomy in normal and cirrhotic rats[J].Surgery,1994,116(3):544-549.
[9]Wolf HK,Michalopoulos GK.Hepatocyte regeneration in acute fulminant and nonfulminant hepatitis:a study of proliferation cell nuclear antigen expression [J].Hepatology,1992,15(4):707-713.
[10]Gerlach C,Sakkab DY,Scholzen T,et al.Ki-67 expression during rat liver regeneration after partial hepatectomy[J].Hepatology,1997,26(3):573-578.
[11]Kwon AH,Matsui Y,Ha-Kawa SK,et al.Functional hepatic volume measured by technetium-99m-galactosyl-human serum albumin liver scintigraphy:comparison between hepatocyte volume and liver volume by computed tomography[J].Am J Gastroenterol,2001,96(2):541-546.
[12]Akaki S,Mitsumori A,Kanazawa S,et al.Technetium-99m-DTPA-galactosyl human serum albumin liver scintigraphy evaluation of regional CT/MRI attenuation/signal intensity differences[J].Nucl Med,1998,39(3):529-532.
[13]Vera DR,Hoh CK,Stadalnik RC,et al.Handbook of radiopharmaceuticals[M].New York:Wiley,2002:795-822.
