H2S抑制Ang II引起的神经元活性氧水平升高的机制研究*
2012-11-06于海云曹冬青金惠铭朱依纯
马 红, 于海云, 于 燕, 曹冬青, 黄 莺, 金惠铭, 朱依纯, 卢 宁
(复旦大学上海医学院生理与病理生理学系,上海 徐汇 200032)
1000-4718(2012)05-0865-05
2012-01-16
2012-03-31
国家自然科学基金资助项目(No.81170237);博士点基金优先发展领域课题(No.20110071130009)
△通讯作者 Tel:021-54237452 ;E-mail:luning7@shmu.edu.cn
H2S抑制Ang II引起的神经元活性氧水平升高的机制研究*
马 红, 于海云, 于 燕, 曹冬青, 黄 莺, 金惠铭, 朱依纯, 卢 宁△
(复旦大学上海医学院生理与病理生理学系,上海 徐汇 200032)
目的探讨硫化氢(H2S)对血管紧张素II(angiotensin II,Ang II)所致延髓神经元活性氧(reactive oxygen species,ROS)水平变化的影响,以及H2S抗氧化应激的相关机制。方法采用原代培养的延髓神经元,分组如下:对照组、Ang II处理组、硫氢化钠(NaHS)处理组、NaHS+Ang II处理组和PD98059(p-ERK1/2蛋白的抑制剂)+ Ang II处理组。选用二氢乙啶(DHE)荧光探针法测定各组神经元胞内的ROS水平,Western blotting检测ERK1/2和p-ERK1/2蛋白的表达量,CCK-8法测定神经元的活性。结果Ang II(终浓度为100 nmol/L)引起神经元ROS水平升高;NaHS(50~200 μmol/L)明显抑制Ang II引起的神经元ROS水平升高,但单独给予NaHS并不影响神经元ROS水平;p-ERK1/2蛋白的抑制剂PD98059也能明显抑制Ang II引起的神经元ROS水平的升高;适宜作用浓度的NaHS能够显著降低Ang II引起的神经元p-ERK1/2蛋白表达。结论H2S能够显著抑制Ang II引起的神经元ROS水平升高,其作用机制与MAPK家族中p-ERK1/2蛋白的表达有关。H2S可能通过降低p-ERK1/2的表达量而产生抗氧化应激作用。
硫化氢; 血管紧张素II; 神经元; 活性氧簇
硫化氢(hydrogen sulfide,H2S)是继一氧化氮(nitric oxide,NO)与一氧化碳(carbon monoxide,CO)之后,逐渐被人们所公认的第3类气体信号分子[1],它是一种具有臭鸡蛋气味的无色小分子气体,在体内多个系统中广泛存在。近年来,大量文献提示H2S可增加神经元的还原活性,具有抗氧化应激的功能[2-3],最终对神经元起到保护作用。本课题组已从整体动物实验水平上提示:H2S能够抑制自发性高血压大鼠中枢NADPH氧化酶的活性,引起超氧阴离子等活性氧(reactive oxygen species,ROS)的水平减少,继而抑制交感兴奋,产生降低血压和心率的心血管效应[4]。在此基础上,本工作从细胞分子水平的角度探讨研究,H2S如何抵抗神经元胞内的高浓度ROS水平所致的氧化应激作用。
血管紧张素II(angiotensin II,Ang II)通过增加中枢神经元胞内ROS水平,提高神经元的放电频率,最终引起血压升高,心率加快等整体效应[5]。Ang II主要通过激活神经元胞内的MAPK家族这条信号通路来升高ROS水平,其中主要是超氧阴离子水平,从而产生一系列重要的中枢生理调节功能[6]。因此,本次实验选用Ang II提高神经元胞内的ROS水平,再给予外源性的H2S,观察H2S能否抑制Ang II引起的神经元高ROS水平,以及通过何种机制起作用与何种细胞信号通路有关。
材 料 和 方 法
1主要试剂与仪器
Ang II、硫氢化钠(sodium hydrosulfide,NaHS)、poly-L-lysine和二氢乙啶(dihydroethidium,DHE)均购自Sigma,p-ERK1/2 抗体和ERK1/2抗体购自CST,微管相关蛋白2(microtubule-associated protein 2,MAP-2)抗体与胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体购自Abcam,Neurobasal medium和B27购自Gibco,CCK-8购自上海同仁化学研究所;CO2恒温细胞培养箱、BOXUN无菌超净台、AMG荧光倒置相差显微镜、TECAN酶标仪等。
2原代培养及鉴定延髓神经元
2.1原代延髓神经元的培养 由上海斯莱克实验动物中心提供的孕14~16 d 的SD大鼠,取出胎鼠,在解剖显微镜下剪取延髓组织[7],选用钝头滴管吹打收集细胞,离心条件1 500×g离心5 min,丢弃上清,加入Neurobasal medium 与B27的混合培养液(比例为50∶1),配制成细胞悬液。采用0.4 %台盼蓝对神经元进行染色,测定细胞活性并计数,最后接种到35 mm的培养皿,3 d换1次液,每次半量换液即可,培养8~10 d左右,神经元已经发育成熟,即可进行以下实验。
2.2原代延髓神经元的鉴定 将已培养10 d的神经元进行鉴定,具体步骤如下:(1)用0.01 mol/L PBS 洗3次;(2)4 %多聚甲醛固定细胞20 min;(3)0.01 mol/L PBS洗3次;(4) 5%~7 %动物血清封闭30 min;(5)分别加Ⅰ抗MAP-2抗体(1∶1 000),GFAP抗体(1∶1 000)4 ℃过夜;(6)0.01 mol/L PBS洗3次;(7)加Ⅱ抗荧光工作液室温避光2 h;(8)0.01 mol/L PBS洗3次;(9)DAPI染核5 min;(10)0.01 mol/L PBS洗3次;(11)荧光倒置相差显微镜下拍照鉴定。
3实验分组处理
实验共分4组,分别是:对照组、Ang II组、NaHS组、NaHS+Ang II组。此外在探讨H2S作用的信号通路时分组如下:对照组、Ang II组、PD98059组、PD98059+Ang II组。
4神经元活性的测定
将加有药物的培养液吸出,加入已混匀的含CCK-8的培养液,CCK-8与培养液的体积比例为1∶10,放置37 ℃细胞培养箱中孵育2 h左右,在酶标仪上测定450 nm吸光度,再进行相应的统计分析。
5神经元胞内ROS水平的检测
DHE荧光探针法检测神经元胞内的ROS水平,主要是超氧阴离子的水平,在去除混有药物的培液后,用D-Hanks液洗3遍,加入5 μmol/L DHE ,37 ℃细胞培养箱中孵育30 min,再用D-Hanks液洗3遍,最后各孔中加入等体积的D-Hanks液,用酶标仪检测荧光强度,激发波长488 nm,发射波长525 nm。
6p-ERK1/2与ERK1/2蛋白表达水平的检测
选用Western blotting 法测定。预冷的PBS洗细胞3遍,吸干后加入细胞裂解液,将刮下的蛋白移至预冷的EP管,冰上放置10 min后,沸水煮沸10 min,根据BCA法测定蛋白浓度。蛋白上样量为35 μg,12 %SDS-聚丙烯酰胺凝胶恒压电泳,浓缩胶60 V,分离胶90 V。湿转法将蛋白转移至PVDF膜。5%脱脂牛奶封闭1 h后分别加p-ERK1/2和ERK1/2多克隆抗体(1∶1 000),4 ℃ 孵育过夜;TBST冲洗3次,每次10 min,加上HRP标记的兔抗(1∶1 000),室温孵育2 h,TBST冲洗3次,每次10 min,再进行显影、定影。X光胶片采用Smart View生物电泳图像分析软件进行蛋白半定量分析处理。
7统计学处理

结 果
1原代培养神经元的鉴定
MAP-2是神经元的特异标记抗体,GFAP是神经胶质细胞的特异标记抗体,因Neurobasal medium与B27培养液中无血清,可以抑制神经胶质细胞的生长,故经过8~10 d的培养,最后存活的大都是神经元,鉴定结果见图1:在倒置显微镜下拍摄可见,A图和D图是自然光图;B图是用MAP-2标记的神经元(绿色);E图是用GFAP标记的神经胶质细胞,几乎见不到神经胶质细胞;C图和F图分别是神经元、神经胶质细胞与神经元核的荧光双标图片,其中蓝色都是DAPI染的神经元核。

Figure 1. Primarily cultured rat medullary neurons. A,D:the phase-contrast images of neurons; B,E:immunofluorescence staining of MAP-2 and GFAP, respectively;C:combined image of B and the nuclei of neurons dyed by DAPI;F:combined image of E and the nuclei of neurons dyed by DAPI. Bar=25 μm.
图1鉴定原代培养的延髓神经元
2H2S抑制AngII引起的神经元ROS水平的升高
2.1单独给予不同浓度NaHS对神经元ROS水平的影响 单独给予10~200 μmol/L NaHS处理神经元,DHE荧光探针检测显示,神经元胞内的ROS水平没有明显变化,差异无统计学意义,见图2。


图2不同浓度NaHS对延髓神经元ROS水平的影响
2.2H2S抑制Ang II引起的神经元ROS水平的变化 单独给予Ang II(100 nmol/L)可明显升高神经元的ROS水平,且该浓度Ang II对神经元的活性并没有显著影响,见图3、4;50 μmol/L、100 μmol/L及200 μmol/L NaHS均可显著抑制Ang II引起的神经元ROS水平的升高,其中100 μmol/L NaHS作用最明显,见图4,故以下实验NaHS浓度均选用100 μmol/L。


图3CCK-8检测AngII对神经元活性的影响


图4NaHS对AngII诱导的神经元ROS水平的影响
3H2S显著降低AngII引起的神经元p-ERK1/2蛋白的表达
3.1Ang II引起神经元p-ERK1/2蛋白表达升高 单独给予Ang II(100 nmol/L)引起神经元的ERK1/2蛋白发生快速磷酸化,作用出现在给药后5 min、10 min、15 min和30 min,但1 h后不再改变,其中5 min磷酸化的程度最高,见图5,故以下实验选择5 min作为观察p-ERK1/2蛋白的时点。
3.2H2S降低Ang II引起的神经元p-ERK1/2蛋白表达 100 μmol/L NaHS预处理神经元30 min 后,可显著降低Ang II(100 nmol/L)作用于神经元5 min时引起的p-ERK1/2蛋白的快速磷酸化表达,见图6。


图5AngII不同时间刺激引起的神经元p-ERK1/2蛋白的表达变化


图6NaHS对AngII引起的神经元p-ERK1/2蛋白表达的影响
3.3PD98059抑制Ang II引起的神经元ROS水平的升高 PD98059是p-ERK1/2的抑制剂,结果显示,PD98059(10 μmol/L)可显著抑制Ang II引起的神经元ROS水平的升高,见图7,从而进一步证实了H2S抑制Ang II引起的神经元ROS水平的升高与p-ERK1/2蛋白有关。

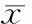
图7PD98059对AngII诱导的神经元ROS水平的影响
讨 论
近年来,H2S作为一种新型的气体信号分子逐渐被人们所重视[1]。它在机体内具有许多重要的生理保护功能,如生理浓度的H2S可以减缓急性心肌梗死所造成的心肌缺血再灌注损伤;对糖尿病肾病也有一定的保护作用;在中枢神经系统中,适宜浓度的H2S可通过提高神经元胞内的谷氨酰胺水平等机制来抵抗氧化应激所造成的损伤[2-3,8-9]。
众所周知,内源性H2S主要由2种5’-磷酸吡哆醛依赖酶胱硫醚 β-合成酶(cystathionine β-synthase,CBS)、胱硫醚 γ-裂解酶(cystathionine γ-lyase,CSE)和一种非磷酸吡哆醛依赖酶 3-巯基丙酮酸转硫酶(3-mercaptopyruvate sulfurtransferase,3-MPST)催化生成[10],中枢神经系统中的H2S主要由CBS催化生成[11]。本实验中,我们选择NaHS作为H2S的供体,NaHS在机体内可解离成Na+和HS-,HS-与体液中的H+结合生成H2S,故NaHS和H2S在机体内形成动态平衡。因NaHS可以保证培养液中H2S浓度的相对稳定,所以目前为止多数文献都选用NaHS作为外源性H2S的供体。
延髓是机体中重要的心血管调节中枢,本课题组的整体实验结果显示:H2S通过降低自发性高血压大鼠延髓腹外侧区的ROS水平而产生降低血压与心率的心血管效应[4],那么H2S是如何降低延髓神经元ROS水平的呢?因此本次实验就选择原代培养的延髓神经元作为研究对象,给予一定浓度的Ang II,造成神经元胞内的ROS水平一定程度的升高,再给予外源性的NaHS,观察H2S通过何种机制及信号通路来抑制Ang II引起的神经元ROS水平的升高,从而保护神经元免受氧化应激等毒副作用。
H2S本身就是一种还原性的气体信号分子,具有一定的抗氧化应激的作用,在维持细胞内环境稳态中发挥了重要的作用。单独给予神经元一定浓度范围的NaHS,神经元的ROS水平没有明显变化,说明了H2S对神经元有一定程度的适应性保护作用。本研究结果显示:H2S与p-ERK1/2蛋白的抑制剂PD98059都能显著抑制Ang II引起的神经元ROS水平的升高;在细胞分子水平上,100 μmol/L NaHS能够显著抑制Ang II引起的神经元p-ERK1/2蛋白的快速磷酸化作用。
ROS是指化学性质比较活跃的含氧原子或原子团,包括超氧阴离子、过氧化氢、羟自由基等等,内源性ROS的来源主要包括NADPH氧化酶、过氧化物酶、细胞色素P450、黄嘌呤氧化酶、γ-谷氨酰转肽酶等,而神经元胞内的ROS主要由NADPH氧化酶催化生成[12]。NADPH氧化酶主要由3个胞浆亚单位(p40phox、p47phox、p67phox)和2个胞膜亚单位(gp91phox、p22phox)组成。据文献报道,Ang II升高神经元胞内的ROS水平与NADPH氧化酶的p47phox亚单位及gp91phox亚单位激活有关[6, 13],且H2S可以通过降低NADPH氧化酶的gp91phox亚单位的表达来减少ROS生成,从而抵抗氧化应激[14]。在本实验中,H2S抑制Ang II引起的神经元ROS水平的升高究竟与NADPH氧化酶的何种亚单位有关,它(们)与p-ERK1/2又是怎样的上下游关系,这正是我们未来研究的重点。
综上所述,H2S能够显著抑制Ang II引起的神经元ROS水平的升高,其作用机制与MAPK家族中p-ERK1/2蛋白表达有关,H2S通过降低p-ERK1/2的表达量而产生抗氧化应激的作用。
[1] Wang R. Two’s company, three’s a crowd: can H2S be the third endogenous gaseous transmitter?[J]. FASEB J,2002,16(13):1792-1798.
[2] Kimura Y, Kimura H. Hydrogen sulfide protects neurons from oxidative stress[J]. FASEB J,2004,18(10):1165-1167.
[3] Umemura K, Kimura H. Hydrogen sulfide enhances reducing activity in neurons: neurotrophic role of H2S in the brain?[J]. Antioxid Redox Signal, 2007,9(11):2035-2041.
[4] 于海云,马 红,曹银祥,等.硫化氢对SHR大鼠的中枢心血管效应及其机制探讨[J].中国分子心脏病学杂志,2011,11(4):235-240.
[5] Sun C, Sellers KW, Sumners C, et al. NAD(P)H oxidase inhibition attenuates neuronal chronotropic actions of angiotensin II[J]. Circ Res,2005,96(6): 659-666.
[6] Chan SH, Hsu KS, Huang CC, et al. NADPH oxidase-derived superoxide anion mediates angiotensin II-induced pressor effect via activation of p38 mitogen-activated protein kinase in the rostral ventrolateral medulla[J]. Circ Res, 2005,97(8):772-780.
[7] Brailoiu GC, Brailoiu E, Parkesh R, et al. NAADP-mediated channel ‘chatter’ in neurons of the rat medulla oblongata[J]. Biochem J, 2009,419(1):91-97.
[8] Elrod JW, Calvert JW, Morrison J, et al. Hydrogen sulfide attenuates myocardial ischemia-reperfusion injury by preservation of mitochondrial function[J]. Proc Natl Acad Sci USA, 2007,104(39):15560-15565.
[9] Gao Y, Yao X, Zhang Y, et al. The protective role of hydrogen sulfide in myocardial ischemia-reperfusion-induced injury in diabetic rats[J]. Int J Cardiol, 2011,152(2):177-183.
[10]Shibuya N, Tanaka M, Yoshida M, et al. 3-Mercaptopyruvate sulfurtransferase produces hydrogen sulfide and bound sulfane sulfur in the brain[J]. Antioxid Redox Signal, 2009,11(4):703-714.
[11]Chen X, Jhee KH, Kruger WD. Production of the neuromodulator H2S by cystathionine β-synthase via the condensation of cysteine and homocysteine[J]. J Biol Chem,2004,279(50):52082-52086.
[12]Bedard K, Krause KH. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology[J]. Physiol Rev,2007,87(1):245-313.
[13]Oliveira-Sales EB, Nishi EE, Carillo BA, et al. Oxidative stress in the sympathetic premotor neurons contributes to sympathetic activation in renovascular hypertension[J]. Am J Hypertens,2009, 22(5):484-492.
[14]Muzaffar S, Jeremy JY, Sparatore A, et al. H2S-donating sildenafil (ACS6) inhibits superoxide formation and gp91phox expression in arterial endothelial cells:role of protein kinases A and G[J]. Br J Pharmacol,2008,155(7): 984-994.
HydrogensulfidesuppressestheincreaseinreactiveoxygenspeciesinneuronsinducedbyangiotensinIIviaERK1/2signalpathway
MA Hong, YU Hai-yun, YU Yan, CAO Dong-qing, HUANG Ying, JIN Hui-ming, ZHU Yi-chun, LU Ning
(DepartmentofPhysiologyandPathophysiology,FudanUniversityShanghaiMedicalCollege,Shanghai200032,China.E-mail:luning7@shmu.edu.cn)
AIM: To investigate the effect of hydrogen sulfide (H2S) on the reactive oxygen species (ROS) level in medullary neurons induced by angiotensin II (Ang II).METHODSPrimarily cultured rat medullary neurons were divided into 5 groups as follows: control group, Ang II group, sodium hydrosulfide(NaHS) group, NaHS with Ang II group, and PD98059 (an inhibitor of p-ERK1/2) with Ang II group. ROS production was measured with dihydroethidium (DHE) staining. The expression of p-ERK1/2 and ERK1/2 was determined by Western blotting. The activity of neurons was detected by CCK-8 assay.RESULTSAng II at concentration of 100 nmol/L significantly increased ROS level in the neurons, but the effect was inhibited by NaHS at concentrations of 50~200 μmol/L, while NaHS alone had no influence on the ROS level in neurons. Additionally, PD98059 also depressed the ROS level in neurons induced by Ang II. Furthermore, the enhanced expression of p-ERK1/2 in the neurons induced by Ang II was significantly reduced by NaHS.CONCLUSIONH2S remarkably inhibits the ROS level in the neurons induced by Ang II via activation of MAPK signal pathways, especially p-ERK1/2, indicating that H2S rescues neurons from oxidative stress through declining the enhanced expression of p-ERK1/2.
Hydrogen sulfide; Angiotension II; Neurons; Reactive oxygen species
R363
A
10.3969/j.issn.1000-4718.2012.05.017
