大鼠自体原位肝移植模型中肠道羟自由基、丙二醛和总抗氧化能力的变化*
2012-11-06池信锦刘德昭黑子清
葛 缅, 池信锦, 刘德昭, 蔡 珺, 黑子清
(中山大学附属第三医院麻醉科, 广东 广州 510630)
1000-4718(2012)04-0723-04
2011-10-27
2012-02-09
国家自然科学基金资助项目(No. 30801080;No. 30972858)
△通讯作者 Tel:020-85252297; E-mail:heiziqing@sina.com
大鼠自体原位肝移植模型中肠道羟自由基、丙二醛和总抗氧化能力的变化*
葛 缅, 池信锦, 刘德昭, 蔡 珺, 黑子清△
(中山大学附属第三医院麻醉科, 广东 广州 510630)
目的建立SD大鼠自体原位肝移植模型,观察自体模拟肝移植后不同时期肠道黏膜病理学变化及肠组织的羟自由基(·OH)、丙二醛(MDA)和总抗氧化能力(T-AOC)的变化。方法SD大鼠36只,随机分为假手术组(S组)和模型组(M组),模型组根据肝脏再灌注时间,再分为再灌注2 h模型组(M1组)、再灌注4 h模型组(M2组)、再灌注8 h模型组(M3组)、再灌注16 h模型组(M4组)和再灌注24 h模型组(M5组)5个亚组。对照组在麻醉后只进行开腹和血管的分离,不进行肝脏的阻断和灌注;模型组则进行自体肝移植手术。分别在肝脏再灌注后2、4、8、16、24 h取肠组织,观察其病理形态学变化及·OH、MDA和T-AOC的变化。结果(1)与S组相比,M组大鼠肠黏膜在肝脏再灌注后出现明显的病理学损伤,可见上皮下间隙的扩大,甚至出现绒毛上皮和固有层分离,再灌注8 h时最为显著,再灌注24 h开始修复;(2)与S组相比,M2、M3和M4组·OH水平明显升高(P<0.05),M1、M2、M3组MDA含量明显升高(P<0.05),M1、M2、M3和M4组T-AOC明显降低(P<0.05)。结论自体原位肝移植可使大鼠肠黏膜·OH和MDA含量增加,T-AOC下降,肠道出现可逆性病理损伤。
肝移植; 缺血再灌注损伤; 羟自由基; 丙二醛; 总抗氧化能力
肝移植手术围术期由于血流动力学的急剧变化以及门静脉淤血等因素均可能导致胃肠黏膜缺血缺氧损伤。黑子清等[1]在模拟肝移植术中阻断猪门静脉和下腔静脉的实验中发现,门静脉和下腔静脉阻断后肠黏膜出现程度不一的病理学损害,证实肝移植中存在肠缺血再灌注损伤。目前国内外关于肝移植动物早期肠道损伤的报道极少,大多研究的是术后某个时点的改变[2-3]。肠缺血再灌注损伤是一个不断发展的过程,了解不同时期肠道损伤的特点对我们在不同时期采取不同手段进行干预有指导价值。本研究将通过复制SD大鼠自体原位肝移植模型,观察肝脏再灌注后不同时期肠道黏膜病理学变化及羟自由基(hydroxyl radical,·OH)、丙二醛(malondialdehyde,MDA)和总抗氧化能力(total antioxidant capacity,T-AOC)的变化规律。
材 料 和 方 法
1仪器和试剂
LD4-2型低速离心机(北京医用离心机厂),漩涡混匀器(江苏金坛市医疗仪器厂),DKB-600型电热恒温水浴箱(上海仪恒实验仪器有限公司),Model-680酶联仪和分光光度计均购自Bio-Rad。BCA法蛋白含量检测试剂盒、·OH 、MDA和T-AOC试剂盒均为南京凯基生物科技发展有限公司。
2动物与分组
健康SPF 级SD 雄性大鼠36 只,重220~280 g,购自广东省实验动物中心。随机均分为假手术组(S组,n=6)和模型组(M组),模型组根据肝脏再灌注时间不同再分为5个亚组:再灌注2 h模型组(M1组,n=6)、再灌注4 h模型组(M2组,n=6)、再灌注8 h模型组(M3组,n=6)、再灌注16 h模型组(M4组,n=6)和再灌注24 h模型组(M5组,n=6)。对照组在麻醉后只进行开腹和血管的分离,不进行肝脏的阻断和灌注。模型组则进行自体肝移植手术,分别在肝脏再灌注后2、4、8、16、24 h时取材。
3自体原位肝移植动物模型的建立[4-5]
大鼠常规禁食12 h, 自由饮水。给予乙醚吸入麻醉后,将大鼠固定在自制的手术台上。 腹部备皮、消毒,采用腹部正中切口入腹,暴露胸骨柄及剑突后,使用自制拉钩拉开腹壁。进入腹腔后逆时针方向游离肝脏,先切断左三角韧带,结扎、切断左膈静脉。然后向左翻转肝脏,并使用大小合适的湿纱布保护肝脏。进一步打开右侧后腹膜,在下腔静脉深面游离肝裸区,解剖出肝上下腔静脉。游离出右肾上腺静脉,给予结扎。在恢复肝脏解剖位置后进一步游离肝下下腔静脉。暴露第一肝门后,剪开肝十二指肠韧带,从脾静脉和肠系膜下静脉汇合处向上游离门静脉到肝门部,并将门静脉壁鞘膜分离干净。因为肝动脉和胆管关系紧密,将两者一起进行游离。在进行阻断前,经尾静脉注射肝素生理盐水1 mL,然后在肝动脉、脾静脉和肠系膜上静脉汇合处夹上微血管夹,使用4 号针头刺入门静脉,然后推注肝素盐水(25 kU/L) 3 mL,从而使肝内血液进入体循环,固定针头。开始冷灌注前,分别在肝上下腔静脉和肝下下腔静脉夹上微血管夹;并且在肝下下腔静脉血管夹稍上方静脉壁剪开大约1 mm 作为灌注液的流出道。使用静脉输液泵以2 mL/min 的速度经门静脉穿刺处缓慢持续灌注0~4 ℃肝素醋酸林格氏液(12.5 kU/L)20 mL,灌注的同时给予冰生理盐水浇注肝脏表面以降温,当肝脏颜色全部变为土黄色表示灌注完成。在灌注完毕后拔出穿刺针,分别使用9-0 Prolene线及8-0 Prolene 线修补门静脉穿刺点和肝下下腔静脉流出道,在检查确认修补成功后,分别松开各处微血管夹,结束无肝期(20 min±1 min),同时给予温热生理盐水浇注肝脏进行快速复温。仔细止血后,腹腔内使用庆大霉素(8×105U/L)生理盐水1 mL,最后行连续全层缝合腹壁切口。使用台灯照射至大鼠苏醒,自由饮水。
4肠组织病理检查方法及评分标准
肝脏再灌注后,于各个时点在距离回肠末端5 cm处取0.5~1 cm小肠,用40 g/L多聚甲醛固定,常规石蜡包埋、切片(片厚3 μm),HE染色,用于小肠黏膜光镜病理观察。肠黏膜病理变化采用Chiu’s评分法[6]进行评分,0 分:正常黏膜绒毛结构;1 分:上皮下间隙增大,通常在绒毛的尖端,常伴随有毛细血管淤血;2分:上皮下间隙扩张伴随上皮层同固有层的中度分离;3 分:绒毛两侧上皮层大量地同固有层分离,部分绒毛顶端破损;4 分:绒毛破损伴随固有层毛细血管暴露,可能观察到固有层的细胞成分增多;5 分:固有层破坏和不完整,出血和溃疡。
5肠组织匀浆和蛋白浓度测定
距回肠末端5 cm开始取大鼠约5 cm小肠,予生理盐水冲洗肠腔,滤纸吸干后置于-80 ℃冰箱中储存。检测前将大鼠小肠标本由-80 ℃冰箱中取出置于冰上,解融后予冰冷的生理盐水冲洗肠腔,以滤纸吸干后取小肠组织约150 mg,制作小肠组织匀浆。以BCA法测定组织总蛋白浓度。
6肠组织·OH、MDA和T-AOC的测定
检测使用南京凯基生物科技发展有限公司的试剂盒,具体操作按说明书要求进行。
7统计学处理
结 果
1一般资料
各组之间SD大鼠的质量以及模型组各亚组之间的无肝期长短相似(P>0.05),见表1。
表1SD大鼠体重、无肝期时间和小肠组织Chiu’s评分变化

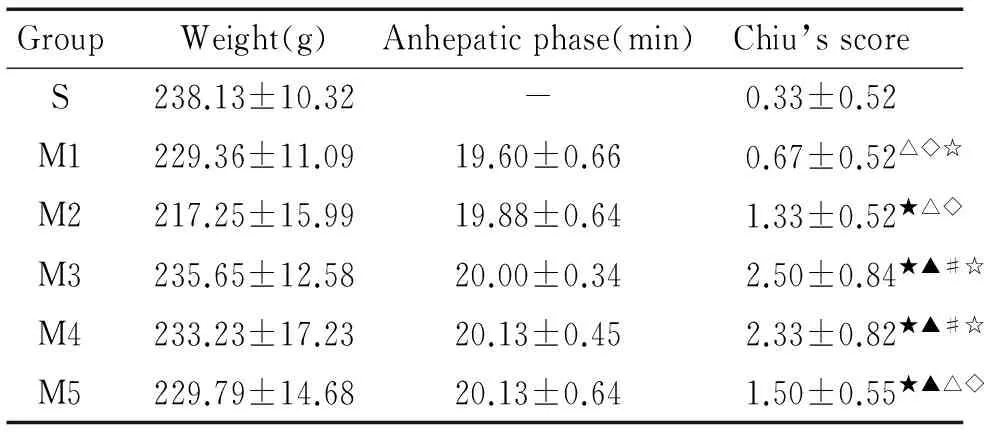
GroupWeight(g)Anhepaticphase(min)Chiu’sscoreS238.13±10.32-0.33±0.52M1229.36±11.0919.60±0.660.67±0.52△◇☆M2217.25±15.9919.88±0.641.33±0.52★△◇M3235.65±12.5820.00±0.342.50±0.84★▲#☆M4233.23±17.2320.13±0.452.33±0.82★▲#☆M5229.79±14.6820.13±0.641.50±0.55★▲△◇
★P<0.05vsS group;▲P<0.05vsM1 group;#P<0.05vsM2 group;△P<0.05vsM3 group;◇P<0.05vsM4 group;☆P<0.05vsM5 group. S:sham; M1:2 h after reperfusion; M2:4 h after reperfusion; M3: 8 h after reperfusion; M4: 16 h after reperfusion; M5: 24 h after reperfusion.
2肠黏膜光镜病理变化
S组大多数黏膜上皮细胞结构完整,排列整齐;少部分出现组织稍充血水肿,未见坏死,见图1 S。M1组多表现为上皮下间隙的扩大,部分黏膜上皮细胞结构完整,排列整齐,见图1 M1。M2组1/3表现为绒毛结构破坏,绒毛上皮和固有层的中度分离,2/3仅表现为上皮下间隙的扩大,见图1 M2;M5组两种表现各占50%,见图1 M5。M3和M4组大多出现绒毛两侧上皮层大量地同固有层分离,部分绒毛顶端破损;少部分仅表现为绒毛上皮和固有层的中度分离,见图1 M3和M4。Chiu’s小肠组织损伤评分中S组最低,M3组最高,两者评分有显著差异(P<0.01);与S组及M1组相比, M3、M4组的Chiu’s评分均明显增高(P<0.05),见表1。
3肠组织·OH水平变化
与S组相比,M2、M3和M4组的小肠组织·OH水平明显升高(P<0.05);分别与M1、 M5组相比,M2、M3和M4组的·OH水平均明显升高(P<0.05),其中M3组·OH水平比M4组升高更为明显(P<0.05);而M2和M3组之间无明显差异(P>0.05);S、M1和M5组之间无明显差异(P>0.05),见表2。

Figure 1. Histological analysis of small intestinal mucosa after HE staining (×100). S: sham operation group; M1:2 h after reperfusion; M2:4 h after reperfusion; M3:8 h after reperfusion; M4:16 h after reperfusion; M5:24 h after reperfusion.
图1各组肠黏膜变化
表2各组SD大鼠小肠组织·OH、MDA和T-AOC的变化

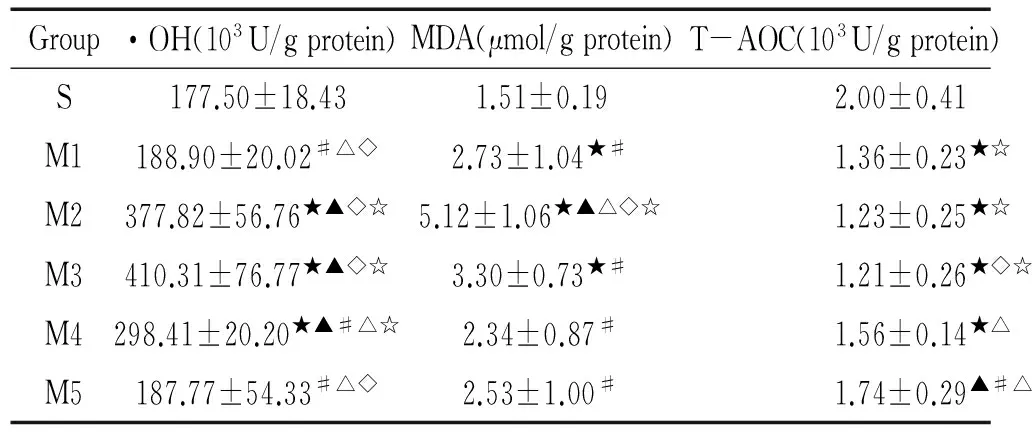
Group·OH(103U/gprotein)MDA(μmol/gprotein)T-AOC(103U/gprotein)S177.50±18.431.51±0.192.00±0.41M1188.90±20.02#△◇2.73±1.04★#1.36±0.23★☆M2377.82±56.76★▲◇☆5.12±1.06★▲△◇☆1.23±0.25★☆M3410.31±76.77★▲◇☆3.30±0.73★#1.21±0.26★◇☆M4298.41±20.20★▲#△☆2.34±0.87#1.56±0.14★△M5187.77±54.33#△◇2.53±1.00#1.74±0.29▲#△
★P<0.05vsS group;▲P<0.05vsM1 group;#P<0.05vsM2 group;△P<0.05vsM3 group;◇P<0.05vsM4 group;☆P<0.05vsM5 group.
4肠组织MDA含量变化
与S组相比,M1、M2和M3组的小肠组织MDA含量明显升高(P<0.05),其中M2组较模型组各组升高更明显(P<0.05);其余各组之间比较无明显差异(P>0.05),见表2。
5肠组织T-AOC变化
同时与S组相比,M1、M2、 M3和M4组的小肠组织T-AOC明显降低(P<0.05);M3组比M4、M5组小肠组织T-AOC明显降低;M4和M5组T-AOC逐渐恢复;与M1、M2和M3组相比,M5组的小肠组织T-AOC明显升高(P<0.05),见表2。
讨 论
小肠绒毛的微动脉、微静脉和毛细血管在肠绒毛的顶端呈弓形的发夹状,同时它们之间还存在着氧的短路交换和距母支较远等特点,常导致绒毛顶部供血供氧较差,在缺血缺氧时更易引起损伤[7-8]。无肝前期的出血、低血压,无肝期门静脉和腔静脉阻断、回心血量骤减,以及新肝期的出血、心功能抑制等均会导致循环波动,反射性交感神经兴奋,肠道血流显著减少,继发性肠道缺血等。特别在无肝期由于阻断肝门部血流导致门脉系统所属静脉回流受阻,广泛的肠系膜静脉淤血,从而减慢小肠壁血流,导致肠黏膜发生淤血性缺血缺氧[9-10]。因此,肝移植过程存在引起肠缺血/再灌注的因素。
目前国内外关于肝移植术后早期肠道损伤研究观察的多数是术后某个时点的改变。Chen等[2]研究表明,行原位肝移植的大鼠术后24 h小肠的运动功能、屏障功能及吸收功能均明显降低,认为该变化可能与小肠组织诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)表达增强及血浆内毒素水平增高相关。但是肝移植围术期肠道损伤是一个渐进的发展过程,动态观察肝移植术后各时点肠道病理学更能准确反映肠道损伤规律;对此,我们观察了肝移植不同时点,根据病理评分判断损伤程度,本研究结果发现自体原位肝移植大鼠肠道在肝脏再灌注后2 h就出现病理学损伤,此时损伤较轻,在再灌注4 h开始损伤逐渐严重,在肝脏再灌注8 h时病理评分最高,损伤最严重;再灌注16 h和24 h病理评分逐渐降低,虽仍存在较明显的病理学改变,但较前面时点肠道病理学损伤明显减轻;研究结果说明正常大鼠肝脏移植术后不同时点肠道损伤表现为早期损伤加重和后期逐渐恢复的特点,表明肠道有较强的自我修复能力。
目前的研究证明[11],氧化应激引发的自由基损伤是造成缺血再灌注损伤的重要机制之一。缺血再灌注产生大量的氧自由基,·OH是其中重要的氧自由基,检测·OH可以反映氧自由基的生成情况。Niwa等[12]研究表明机体具有较强的抗氧化损伤能力,这种能力来自于体内的抗氧化防御系统,包括抗氧化酶和抗氧化物质;而自由基的增多可以使机体T-AOC降低,T-AOC不仅可以精确地反映机体的抗氧化状态,还可以间接评价氧自由基的活性。MDA是不饱和脂肪酸过氧化分解的终产物,其含量的高低不仅可以直接反映体内脂质过氧化的强度和速率,还可以间接反应组织或细胞损伤的严重程度,常被作为判断缺血-再灌注损伤的重要依据。宇汝胜等[13]研究发现大鼠行肝移植术后1 h小肠组织MDA明显升高,证实缺血再灌注损伤、氧自由基与移植后胃肠动力损害可能密切相关。而本实验中在肝脏再灌注后4 h、8 h肠道MDA含量、·OH水平明显升高,其中·OH的增高更持续到术后16h,然后开始逐渐恢复;在肝脏再灌注后2 h肠道T-AOC开始出现明显下降,到再灌注后8h下降最为严重;这些改变与光镜观察到的肠黏膜损伤程度结果一致,证明了肝移植术后肠道损伤与脂质过氧化密切相关。
综上所述,SD大鼠经历自体原位肝移植会引起肠道损伤,该损伤呈现可逆性特点,其改变可能与肠道自由基增多和抗氧化能力下降有关,但其损伤的具体机制有待进一步研究。
[1] 黑子清,郭隽英,陈 宇,等. 门静脉和下腔静脉阻断对猪胃肠氧供需平衡的影响[J].临床麻醉学杂志,2003,6 (19):353-355.
[2] Chen Z,Yan L. Early changes of small intestine function in rats after liver transplantation[J].Transplant Proc, 2006,38(5):1564-1568.
[3] 曹德权,陈艳平,李永国,等.大鼠全肝血流阻断再灌注对肠黏膜屏障的影响[J].中南大学学报(医学版),2005,30(4):433-436.
[4] Leventis I, Andreadou I, Papalois A, et al. A novel antioxidant non-steroidal anti-inflammatory agent protects rat liver against ischemia-reperfusion injury[J]. In Vivo, 2004, 18(2): 161-169.
[5] Carrico CJ, Meakins JL, Marshall JC, et al. Multiple-organ-failure syndrome[J].Arch Surg, 1986,121(2):196-208.
[6] Chiu CJ, McArdle AH, Brown R, et al.Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal[J].Arch Surg, 1970,101(4):478-483.
[7] Secchi A, Ortanderl JM, Schmidt W, et al.Effects of dobutamine and dopexamine on hepatic micro- and macrocirculation during experimental endotoxemia: an intravital microscopic study in the rat[J].Crit Care Med, 2001,29(3):597-600.
[8] 柳家贤,陈金和,吴 勇.肠缺血再灌注时肠粘膜抗氧化系统及肝、肾功能改变的实验研究[J].中国病理生理杂志,2005,21(12):2374-2377.
[9] Albillos A, de la Hera A. Multifactorial gut barrier failure in cirrhosis and bacterial translocation: working out the role of probiotics and antioxidants[J]. J Hepatol, 2002,37(4):523-526.
[10] Johnston TD, Fischer R, Chen Y, et al. Lung injury from gut ischemia: insensitivity to portal blood flow diversion[J]. J Trauma, 1993, 35(4): 508- 511.
[11] Yu LC, Perdue MH. Role of mast cells in intestinal mucosal function: studies in models of hypersensitivity and stress[J]. Immunol Rev, 2001,179(1):61-73.
[12] Niwa Y. Oxidative injury and its defense systeminvivo[J]. Rinsho Byori, 1999, 47(3):189-209.
[13] 宇汝胜,钱海鑫,汪 泳,等.肝移植大鼠胃肠动力改变及机制[J].江苏医药,2008,5(34):472-474.
Changesofhydroxylradical,malondialdehydeandtotalantioxidantcapa-cityinintestinesafterorthotopicliverautotransplantationinrats
GE Mian, CHI Xin-jin,LIU De-zhao, CAI Jun, HEI Zi-qing
(DepartmentofAnesthesiology,TheThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China.E-mail:heiziqing@sina.com)
AIM: To explore the pathological changes of small intestines after orthotopic liver autotransplantation in rats and to analyze the correlation between these changes and the levels of hydroxy radical (·OH),malondialdehyde(MDA)and total antioxidant capacity(T-AOC).METHODSThirty-six Sprague-Dawley rats were randomly divided into sham operation group (group S,n=6) and model group (group M). According to the period after liver reperfusion, the rats in group M were divided into 5 sub-groups: 2 h after reperfusion (group M1,n=6), 4 h after reperfusion (group M2,n=6), 8 h after reperfusion (group M3,n=6), 16 h after reperfusion (group M4,n=6), and 24 h after reperfusion (group M5,n=6). After anesthesia, the rats in group S involved laparotomy and vascular dissection without hepatic vascular exclusion and perfusion. The rats in other groups
orthotopic liver autotransplantation. The intestinal tissues starting from 5 cm to terminal ileum were removed 2 h, 4 h, 8 h, 16 h and 24 h after reperfusion. The morphological changes of intestinal epithelial basement membrane were observed under optical microscope. The levels of ·OH, MDA and T-AOC were detected.RESULTS(1) In model groups, the morphological damages in the intestines were significant compared to group S, especially 8 h after reperfusion. The intestines showed massive epithelial lifting down the sides of villi and a few tips being denuded. The repair of pathological damage in the intestines 24 h after reperfusion was observed. (2) Compared to group S, the levels of ·OH in the intestines significantly increased in group M2, M3 and M4 (P<0.05). The levels of MDA in the intestines significantly increased in group M1, M2 and M3 (P<0.05). The levels of T-AOC significantly decreased in group M1, M2, M3 and M4 (P<0.05).CONCLUSIONOrthotopic liver autotransplantation increases the levels of ·OH and MDA, diminishes T-AOC and induces reversible pathological changes in intestines.
Liver transplantation; Ischemia-reperfusion injury; Hydroxyl radical; Malondialdehyde; Total antioxidant capacity
R363
A
10.3969/j.issn.1000-4718.2012.04.025
