整合素αvβ6对结肠癌细胞中整合素αvβ5内吞胞吐循环的影响*
2012-11-06牛卫博
张 琦, 王 健, 陈 融, 彭 程, 牛卫博, 牛 军
(1山东大学第二医院血液肿瘤生物治疗研究所, 山东 济南 250033; 2浙江大学医学院附属第二医院肿瘤外科,浙江 杭州 310009;山东大学 3医学院机能实验室, 4齐鲁医院肝胆外科, 山东 济南250012)
2012-07-19
2012-09-21
国家自然科学基金资助项目(No.30570833; No.30872460)
△通讯作者 Tel: 0531-85875635; E-mail: ydzhang@sdu.edu.cn
▲并列第1作者
整合素αvβ6对结肠癌细胞中整合素αvβ5内吞胞吐循环的影响*
张 琦1▲, 王 健2▲, 陈 融3△, 彭 程4, 牛卫博4, 牛 军4
(1山东大学第二医院血液肿瘤生物治疗研究所, 山东 济南 250033;2浙江大学医学院附属第二医院肿瘤外科,浙江 杭州 310009;山东大学3医学院机能实验室,4齐鲁医院肝胆外科, 山东 济南250012)
目的探讨整合素αvβ6对结肠癌细胞中整合素αvβ5内吞胞吐循环及细胞黏附、迁移能力的影响。方法采用Western blotting检测不同细胞中整合素αvβ6和αvβ5的表达情况,通过整合素内吞实验、胞吐实验和capture-ELISA实验检测不同细胞中整合素αvβ6和αvβ5的内吞胞吐循环时相,利用细胞黏附实验和细胞迁移实验检测各种细胞在不同基质表面黏附和迁移能力的差异。结果SW480、SW480 wild-type β6和SW480 mock细胞中整合素αv亚基和β5亚基的表达无显著差异(P>0.05),SW480 wild-type β6细胞中整合素β6亚基的表达显著高于另外2种细胞(P<0.05);SW480细胞中整合素αvβ5存在内吞胞吐循环,但当向SW480细胞中转染β6亚基后,整合素αvβ6进行内吞胞吐循环的同时,会对整合素αvβ5的内吞和胞吐过程产生抑制作用,差异有统计学意义(P<0.05);3种细胞中整合素αvβ6和αvβ5的内吞胞吐循环的差异,会影响细胞在纤连蛋白(整合素αvβ6配体)和玻连蛋白(整合素αvβ5配体)表面的黏附和迁移能力。结论整合素αvβ6和αvβ5拥有共同的α亚基,它们在细胞内的内吞胞吐循环存在某种竞争性关系,当二者同时存在时,整合素αvβ6会抑制αvβ5的内吞胞吐循环过程,并由此对细胞在相应基质表面黏附和迁移能力产生影响。
整合素类; 结肠肿瘤; 胞吞作用; 胞吐作用; 细胞运动
整合素是一种由α、β亚单位以非共价键结合组成的重要细胞黏附分子,介导细胞间及细胞与细胞外基质的黏附作用[1]。目前在脊椎动物中共发现18种α亚单位和8种β亚单位,它们通过不同的组合可以形成24种整合素亚型[2]。近年研究发现多数整合素亚型并不是静止在细胞膜上,而是在细胞内进行持续快速的内吞胞吐循环,它们在细胞迁移等生物学过程中发挥重要调控作用[3-5]。整合素αvβ6是一种特殊的上皮细胞限制性整合素亚型,它的主要配体是纤维连接蛋白。在正常上皮组织中无法检测到β6整合素mRNA和蛋白的表达,但是β6整合素却可以出现在胚胎形成、组织损伤修复和一系列上皮源性恶性肿瘤组织中[6-11]。我们的前期研究发现,αvβ6作为一种特殊的整合素亚型,可以通过不同的途径参与上皮源性肿瘤的恶性进展过程,加速癌细胞的生长、侵袭和转移[12-17]。一般情况下,在正常上皮细胞中,整合素αv亚单位可以与β5亚基结合,形成整合素αvβ5,但当细胞发生恶性转化并处于高度增殖迁移状态后,整合素αvβ6的表达就会明显上调,同时伴随整合素αvβ5的表达显著降低[16, 18]。近年来研究发现,整合素是否存在内吞胞吐循环,主要决定于α亚单位的类型,实验研究证实整合素αvβ6和αvβ5均存在内吞胞吐循环过程,它们通过网格蛋白(clathrin)依赖的途径内吞进入细胞内,拥有共同的内吞转运机制。既然整合素αvβ6和αvβ5均包含α亚单位,又通过相同的途径内吞进入细胞内,那么它们在内吞胞吐循环过程可能就会存在一定的相互影响,本研究在此基础上,借鉴目前较为成熟的内吞胞吐循环检测方法[19],验证结肠癌细胞中整合素αvβ6和αvβ5内吞胞吐循环之间的相互作用关系,从而为进一步揭示整合素内吞胞吐循环的分子机制奠定基础。
材 料 和 方 法
1细胞株和试剂
人结肠癌SW480细胞购自ATCC,SW480 wild-type β6和SW480 mock细胞为本课题组前期构建[15];整合素αvβ6单克隆抗体10D5和整合素αvβ5单克隆抗体15F11购自Millipore;整合素αv亚单位单克隆抗体P2W7、整合素β6亚单位单克隆抗体C-19和整合素β5亚单位单克隆抗体E-19购自Santa Cruz;EZ-LinkTMSulfo-NHS-SS-Biotin购自Pierce;mesna、吲哚乙酸(indoleacetic acid,IAA)、纤连蛋白(fibronectin)和玻连蛋白(vitronectin)均购自Sigma-Aldrich;streptavidin-HRP购自GenScript;邻苯二胺(o-phenylene diamine,OPD)购自Amresco;DMEM培养基和胎牛血清(fetal bovine serum,FBS)购自Gibco。
2方法
2.1细胞培养 人类结肠癌SW480、SW480 wild-type β6和SW480 mock细胞均用含有10% FBS、1×105U/L青霉素和100 mg/L链霉素的DMEM培养基,置于37 ℃、5% CO2、湿度饱和的细胞培养箱中培养。
2.2Western blotting实验 收集生长状态良好的SW480、SW480 wild-type β6和SW480 mock细胞,提取蛋白,以30 μg/well上样,电泳(60 V、2.5 h)后转移至硝酸纤维素膜(60 V、1.5 h),脱脂奶粉封闭2 h,Ⅰ抗4 ℃孵育过夜,Ⅱ抗常温孵育1 h,ECL显影,Kodak凝胶成像系统观察照相并分析。
2.3整合素内吞实验 选取生长状态良好的细胞,用PBS冲洗2遍,更换培养基,37 ℃孵育30 min;取出细胞培养瓶,置冰上,用冷PBS冲洗2遍,加入0.2 g/L EZ-LinkTMSulfo-NHS-SS-Biotin溶液,冰上标记60 min;用PBS溶液冲洗2遍,加入预热的培养基,37 ℃孵育一定时间(5 min、15 min、30 min、60 min)后取出并立即置冰上,用冷PBS冲洗2遍;向各瓶中加入含有20 mmol/L MesNa、50 mmol/L Tris(pH 8.6)和100 mmol/L NaCl 溶液,冰上处理15 min,去除仍存在于细胞膜上的生物素;向各瓶中加入20 mmol/L IAA溶液,冰上处理10 min,以清除过量的mesna;收集细胞并裂解,BCA法测定蛋白浓度,进行Capture-ELISA实验。
2.4整合素胞吐实验 选取生长状态良好的细胞,与内吞实验开始阶段的步骤相同,用0.2 g/L EZ-LinkTMSulfo-NHS-SS-Biotin 溶液冰上标记60 min;加入预热的培养基,37 ℃孵育30 min;取出细胞培养瓶置冰上,冷PBS冲洗2遍,各瓶中加入mesna溶液,冰上处理15 min;PBS冲洗2遍,再次加入预热的培养基,37 ℃孵育,指定时间(5 min、15 min、30 min)后,取出培养瓶并立即置冰上,用冷PBS冲洗2遍,再次加入mesna溶液,冰上处理15 min;加入20 mmol/L IAA溶液,冰上处理10 min;收集细胞并裂解,BCA法测定蛋白浓度,进行Capture-ELISA实验。
2.5Capture-ELISA实验 用0.05 mol/L(pH 9.6)的碳酸盐缓冲溶液分别配制含5 mg/L 10D5或15F11的抗体包被液,加入96孔单条可拆酶标板中,100 μL/well,4 ℃包被过夜;用0.1% Tween-20的PBS-T溶液(洗涤液)冲洗1遍,加入含0.1% Tween-20和5% BSA的PBS-T溶液室温封闭1 h;用洗涤液冲洗1遍,拍干,上样,确保各孔蛋白总浓度相同,4 ℃孵育过夜,进行整合素αvβ6或αvβ5的捕捉;取出酶标板,用洗涤液将酶标板冲洗5遍,向各孔中加入含streptavidin-HRP及1% BSA的PBS-T溶液100 μL/well,4 ℃孵育1 h;用洗涤液将酶标板冲洗5遍,拍干,向各孔中加入邻苯二胺显色液100 μL/well,常温避光显色10 min;然后向每孔中加入2 mol/L H2SO4溶液50 μL/well,20 min内通过酶标仪读取各孔492 nmA值,参考波长为630 nm。
2.6黏附实验 向96孔板中加入10 mg/L纤连蛋白或玻连蛋白溶液50 μL/well,4 ℃孵育过夜;倒出孔中溶液,加入100 μL/well包含1%BSA的PBS,室温封闭1 h,PBS冲洗2遍;用含0.53 mmol EDTA的PBS收集生长状态良好的SW480 wild-type β6、SW480 Del. Mutant β6和SW480 mock细胞,吹打为单细胞悬液,细胞黏附缓冲液(包含0.2% BSA的DMEM培养基)冲洗2遍;细胞计数,按5×104cells/well加入96孔板中,37 ℃孵育2 h;用细胞黏附缓冲液轻微冲洗3遍,剩余黏附细胞用1%戊二醛溶液固定;用0.1%结晶紫溶液染色,1%SDS溶液处理后读取600 nmA值。
2.7迁移实验 将8 μm孔径Boyden chamber小室浸泡在包含10 mg/L纤连蛋白或玻连蛋白的PBS溶液中,4 ℃孵育过夜;收集生长状态良好的细胞,计数,用无血清DMEM培养基调整细胞浓度为5×107cells/L,向24孔板Boyden chamber上室中加入2.5×104cells/well,下室中加入包含10% FBS的DMEM培养基1 250 μL/well,置入37 ℃细胞培养箱中孵育;24 h后取出,PBS淋洗,用棉签擦去微孔膜上层细胞,将贴附于微孔膜下层的细胞用4%多聚甲醛固定,0.1%结晶紫染色;上镜观察穿过膜的细胞,随机计数5个视野,每组重复3次,取平均数计算细胞迁移率,数据处理。
3统计学处理
结 果
1结肠癌SW480、SW480wild-typeβ6和SW480mock细胞中整合素αvβ6和αvβ5的表达
Western blotting显示,在SW480、SW480 wild-type β6和SW480 mock细胞中,整合素αv和β5亚基的表达无显著差异(P>0.05);由于转染了包含β6基因的表达载体,所以SW480 wild-type β6细胞中整合素β6亚基的表达量显著高于SW480和SW480 mock细胞,差异有统计学意义(P<0.05),见图1。
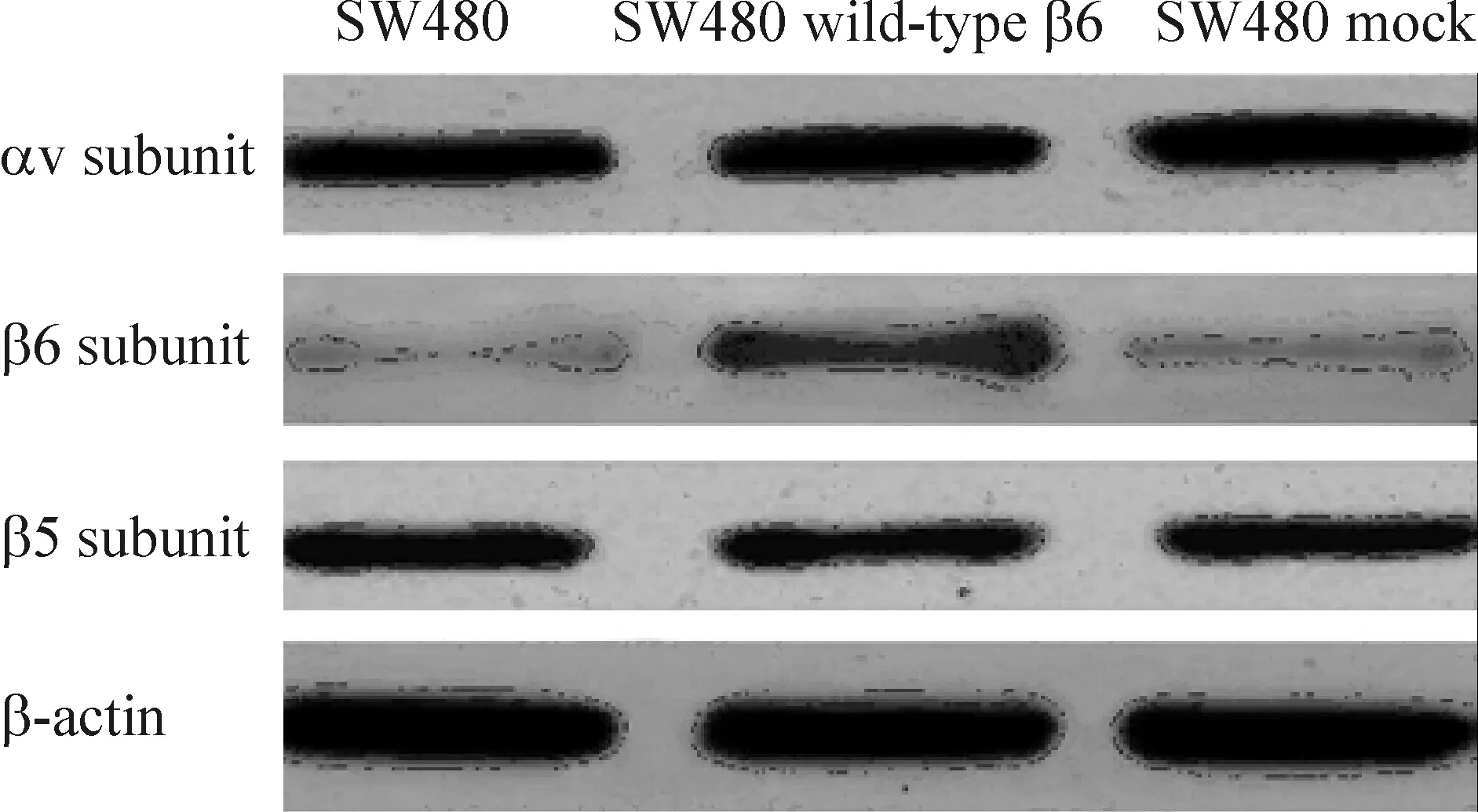
Figure 1. Western blotting analysis of integrin αv, β6 and β5 subunit expression in SW480, SW480 wild-type β6 and SW480 mock colon cancer cells.
图1Westernblotting检测结肠癌SW480、SW480wild-typeβ6和SW480mock细胞中整合素αv、β6和β5亚基表达情况
2结肠癌SW480wild-typeβ6细胞中整合素αvβ6的内吞胞吐循环
整合素内吞实验、胞吐实验和capture-ELISA检测显示,在结肠癌SW480 wild-type β6细胞中,整合素αvβ6进行持续的内吞胞吐循环。如图2A所示,5 min、15 min和30 min时整合素αvβ6的内吞比例分别为28.1%、51.9%和58.8%,60 min时的检测结果为47.1%,低于15 min和30 min时的数据,我们考虑这主要是由于部分整合素αvβ6在60 min内已经完成在胞内一周的循环,重新回到细胞膜上,被随后加入的mesna溶液去生物素化,所以最终检测结果偏低。如图2B所示,5 min、15 min和30 min时整合素αvβ6的胞吐比例分别为39.5%、55.9%和68.5%。
3结肠癌SW480、SW480wild-typeβ6和SW480mock细胞中整合素αvβ5的内吞胞吐循环
在SW480和SW480 mock细胞中,各时点整合素αvβ5的内吞和胞吐比例无显著差异(P>0.05),但是在SW480 wild-type β6细胞中,由于转染了整合素αvβ6,使整合素αvβ5的内吞和胞吐过程均明显减慢,组间数据比较显著差异(P<0.05),见图3。


图2结肠癌SW480wild-typeβ6细胞中整合素αvβ6的内吞胞吐循环情况


图3结肠癌SW480、SW480wild-typeβ6和SW480mock细胞中整合素αvβ5的内吞胞吐循环情况
4结肠癌SW480、SW480wild-typeβ6和SW480mock细胞在纤连蛋白和玻连蛋白表面黏附能力的差异
如图4所示,SW480 wild-type β6细胞在纤连蛋白表面的黏附能力明显强于SW480和SW480 mock细胞,差异显著(P<0.05),但是SW480 wild-type β6细胞在玻连蛋白表面的黏附能力明显弱于SW480和SW480 mock细胞,差异显著(P<0.05)。
5结肠癌SW480、SW480wild-typeβ6和SW480mock细胞在纤连蛋白和玻连蛋白表面迁移能力的差异
SW480 wild-type β6细胞在纤连蛋白表面的迁移能力明显强于SW480和SW480 mock细胞,差异显著(P<0.05),但是SW480 wild-type β6细胞在玻连蛋白表面的迁移能力弱于SW480和SW480 mock细胞,差异显著(P<0.05),见图5。
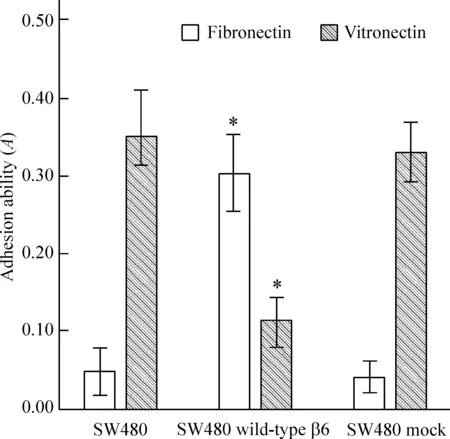

图4结肠癌SW480、SW480wild-typeβ6和SW480mock细胞在纤连蛋白和玻连蛋白表面的黏附能力
讨 论
整合素αvβ6和αvβ5均是重要的整合素亚型,二者拥有共同的αv亚基,目前很多研究均提示它们之间存在密切的关系[16, 18]。我们在前期研究中发现,在结肠癌HT29细胞、WiDr细胞和SW480 wild-type β6细胞中,高细胞密度培养可以通过PKC依赖的途径选择性增加细胞膜上整合素αvβ6的表达,与此同时,细胞膜上整合素αvβ5和αvβ1的数量均明显减少,整合素αvβ3的数量轻微减少或不变,但是整合素αv亚基的数量基本保持不变[16],提示在此情况下,整合素αv亚基可以更多地与β6亚基组合形成整合素αvβ6,参与调节细胞的生物学行为。
近年来,整合素内吞胞吐循环理论的提出为这种现象提供了一种更合理的解释,Tooney等[20]提出一个模型,整合素内吞进入胞质后,细胞会在早期内吞体和溶酶前体中,在分子伴侣的协助下,对各种整合素亚型进行“审查”,α和β亚基解离,根据细胞的需要重新组装出新的整合素亚型,胞吐到细胞膜上,介导细胞与不同细胞外基质的黏附作用。在这个模型基础上,内吞体就像是细胞内各种整合素亚基的储存库和中转站,细胞可以根据外部环境的变化,随时做出快速反应,利用胞内“储存库”中的整合素亚基组装出各种整合素亚型,胞吐到细胞表面,通过调整细胞膜上整合素亚型的种类和数量,调控细胞的生物学行为。我们对在不同密度培养状态下结肠癌细胞中整合素αvβ6分布状态的研究结果也支持这一假说[21]。
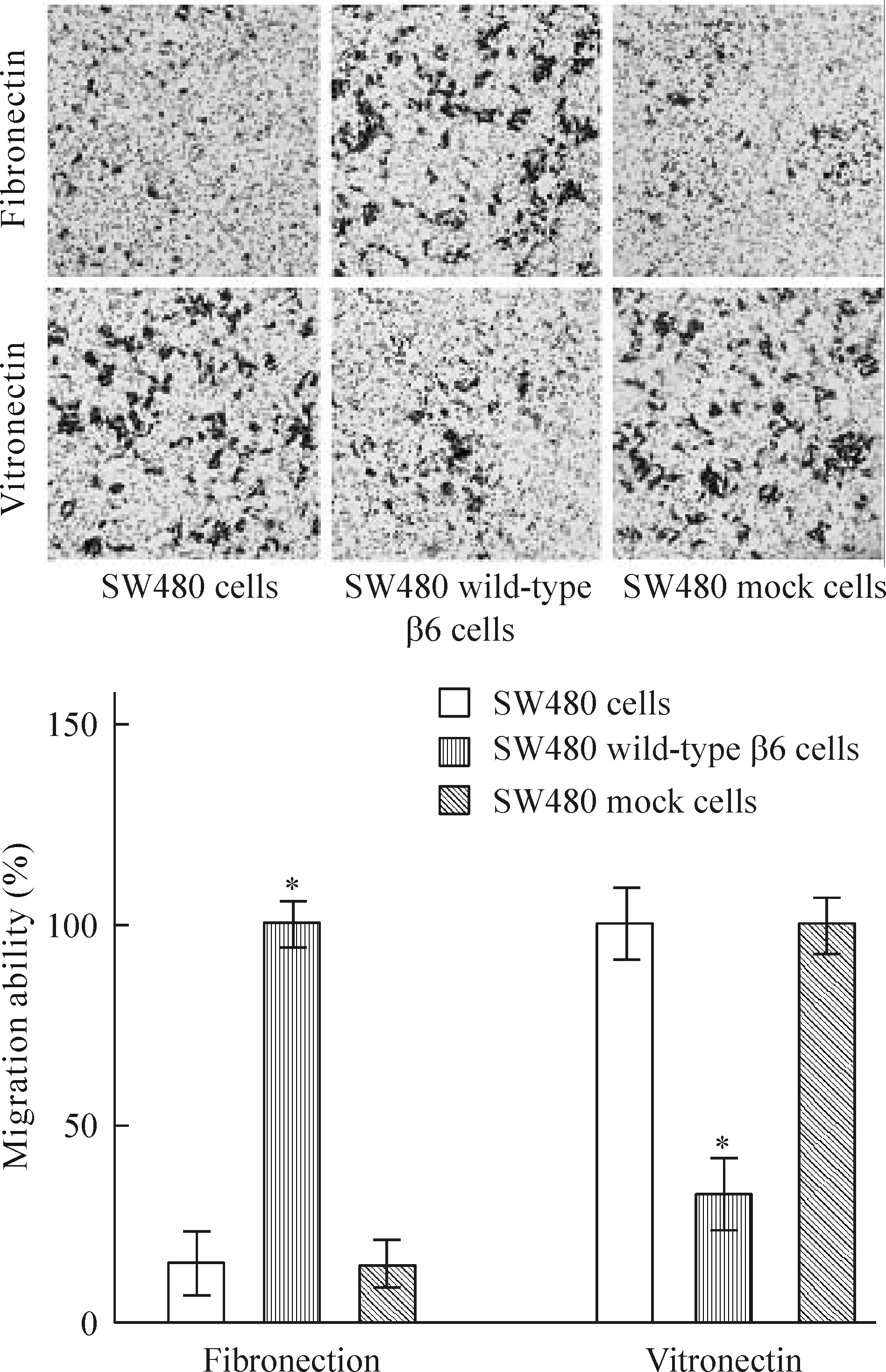

图5结肠癌SW480、SW480wild-typeβ6和SW480mock细胞在纤连蛋白和玻连蛋白表面的迁移能力
我们在本实验中利用了前期构建的SW480、SW480 wild-type β6和SW480 mock细胞,它们之间唯一的区别就是转染质粒的不同,SW480是原始野生型细胞,SW480 wild-type β6是向SW480细胞中转染了整合素β6亚基的细胞,SW480 mock是转染了空质粒的细胞,作为实验的阴性对照,因此,理论上这3种细胞实验结果的差异应该均是由于SW480 wild-type β6细胞中增加了整合素β6亚基的缘故。本实验我们首先利用Western blotting的方法验证了3种细胞中αv、β6和β5亚基的表达情况,并通过内吞胞吐相关实验方法检测了SW480 wild-type β6细胞中整合素αvβ6的循环情况,结果提示整合素αvβ6循环状态良好,可是,与SW480和SW480 mock细胞相比,SW480 wild-type β6细胞中整合素αvβ5的内吞胞吐循环过程明显减慢,并且细胞在玻连蛋白表面的黏附和迁移能力也均受到抑制,提示整合素αvβ6可以竞争性抑制整合素αvβ5的内吞胞吐循环,进而抑制整合素αvβ5介导的细胞生物学过程。
由此可见,作为细胞表面重要的黏附分子,虽然整合素αvβ6和αvβ5均可以与相应配体结合,在细胞黏附、迁移等过程中发挥重要作用,但是作为一种在正常上皮组织中不表达、而在恶性上皮性肿瘤组织中高表达的整合素亚型,整合素αvβ6具有其特殊性,当β6亚基和β5亚基同时存在时,β6亚基与αv亚基具有更强的结合能力,αv亚基可以优先与β6亚基结合组装形成整合素αvβ6,介导肿瘤细胞的黏附和迁移过程。另外,当整合素αvβ6和αvβ5同时存在于癌细胞中时,整合素αvβ6的内吞胞吐循环可以正常进行,但是整合素αvβ5的内吞胞吐循环则明显受到了抑制,二者之间存在竞争性抑制的关系,在此情况下,整合素αvβ6功能的正常发挥更能够促进肿瘤细胞的恶性进展。目前这2种整合素亚型之间竞争性抑制的具体调控机制仍需要进行大量系统、深入的研究。
[1] Hynes RO. Integrins: bidirectional, allosteric signaling machines [J]. Cell, 2002, 110(6): 673-687.
[2] Barczyk M, Carracedo S, Gullberg D. Integrins [J]. Cell Tissue Res, 2010, 339(1): 269-280.
[3] Caswell P, Norman J. Endocytic transport of integrins during cell migration and invasion [J]. Trends Cell Biol, 2008, 18(6): 257-263.
[4] Jones MC, Caswell PT, Norman JC. Endocytic recycling pathways: emerging regulators of cell migration [J]. Curr Opin Cell Biol, 2006, 18(5): 549-557.
[5] Caswell PT, Norman JC. Integrin trafficking and the control of cell migration [J]. Traffic, 2006, 7(1): 14-21.
[6] Sheppard D, Rozzo C, Starr L, et al. Complete amino acid sequence of a novel integrin β subunit (β6) identified in epithelial cells using the polymerase chain reaction [J]. J Biol Chem, 1990, 265(20): 11502-11507.
[7] Breuss JM, Gallo J, DeLisser HM, et al. Expression of the β6integrin subunit in development, neoplasia and tissue repair suggests a role in epithelial remodeling [J]. J Cell Sci, 1995, 108(Pt 6): 2241-2251.
[8] Agrez MV, Bates RC, Mitchell D, et al. Multiplicity of fibronectin-binding αVintegrin receptors in colorectal cancer [J]. Br J Cancer, 1996, 73(7): 887-892.
[9] Jones J, Watt FM, Speight PM. Changes in the expression of αvintegrins in oral squamous cell carcinomas [J]. J Oral Pathol Med, 1997, 26(2): 63-68.
[10]Arihiro K, Kaneko M, Fujii S, et al. Significance of α9β1and αvβ6integrin expression in breast carcinoma [J]. Breast Cancer, 2000, 7(1): 19-26.
[11]Ahmed N, Riley C, Rice GE, et al. αvβ6integrin:a marker for the malignant potential of epithelial ovarian cancer [J]. J Histochem Cytochem, 2002, 50(10): 1371-1379.
[12]Zhang ZY, Xu KS, He QS, et al. Signaling and regulatory mechanisms of integrin αvβ6on the apoptosis of colon cancer cells [J]. Cancer Lett, 2008, 266(2): 209-215.
[13]Gu X, Niu J, Dorahy DJ, et al. Integrin αvβ6-associated ERK2 mediates MMP-9 secretion in colon cancer cells [J]. Br J Cancer, 2002, 87(3): 348-351.
[14]Wang J, Zhang Z, Xu K, et al. Suppression of integrin αvβ6by RNA interference in colon cancer cells inhibits extracellular matrix degradation through the MAPK pathway [J]. Int J Cancer, 2008, 123(6): 1311-1317.
[15]Niu J, Dorahy DJ, Gu X, et al. Integrin expression in colon cancer cells is regulated by the cytoplasmic domain of the β6integrin subunit [J]. Int J Cancer, 2002, 99(4): 529-537.
[16]张 琦,胡燕燕,彭 程,等. αvβ6-ERK直接通路参与去甲斑蝥素诱导HT-29结肠癌细胞凋亡的实验研究[J].中国病理生理杂志,2011, 27(8): 1525-1530.
[17]Ahmed N, Niu J, Dorahy DJ, et al. Direct integrin αvβ6-ERK binding: implications for tumour growth [J]. Oncogene, 2002, 21(9): 1370-1380.
[18]Janes SM, Watt FM. Switch from αvβ5to αvβ6integrin expression protects squamous cell carcinomas from anoikis [J]. J Cell Biol, 2004, 166(3): 419-431.
[19]Ramsay AG, Keppler MD, Jazayeri M, et al. HS1-associated protein X-1 regulates carcinoma cell migration and invasion via clathrin-mediated endocytosis of integrin αvβ6[J]. Cancer Res, 2007, 67(11): 5275-5284.
[20]Tooney PA, Agrez MV, Burns GF. A re-examination of the molecular basis of cell movement [J]. Immunol Cell Biol, 1993, 71 (Pt2): 131-139.
[21]Wang J, Wu J, Hong J, et al. PKC promotes the migration of colon cancer cells by regulating the internalization and recycling of integrin αvβ6[J]. Cancer Lett, 2011, 311(1): 38-47.
Effectsofintegrinαvβ6onendo-exocytoticcycleofintegrinαvβ5incoloncancercells
ZHANG Qi1, WANG Jian2, CHEN Rong3, PENG Cheng4, NIU Wei-bo4, NIU Jun4
(1InstituteofBiotherapyforHematologicalMalignancies,theSecondHospitalofShandongUniversity,Jinan250033,China;2DepartmentofSurgicalOncology,SecondAffiliatedHospital,ZhejiangUniversitySchoolofMedicine,Hangzhou310009,China;3TeachingLaboratoryofFunctionalScience,SchoolofMedicine,4DepartmentofHepatobiliary,QiluHospital,ShandongUniversity,Jinan250012,China.E-mail:ydzhang@sdu.edu.cn)
AIM: To investigate the effects of integrin αvβ6 on the endo-exocytotic cycle of integrin αvβ5 in colon cancer cells.METHODSThe expression of integrin αvβ6 and αvβ5 in SW480 cells, SW480 wild-type β6 cells and SW480 mock cells was detected by Western blotting. The trafficking of integrin αvβ6 and αvβ5 was examined by endocytosis assay, exocytosis assay and capture-ELISA. The adhesive and migration abilities of these 3 cell lines towards fibronectin or vitronectin were measured by cell adhesion assay and cell migration assay.RESULTSThe expression of integrin αv and β5 subunits was similar in these 3 cell lines (P>0.05), while the expression of integrin β6 subunit in SW480 wild-type β6 cells was much higher than that in the other 2 cell lines (P<0.05). The transfection of integrin β6 subunit into SW480 cells was able to slow down the endocytosis and exocytosis of integrin αvβ5, and subsequently inhibited the cellular adhesion and migration abilities towards vitronectin.CONCLUSIONIntegrin αvβ6 and αvβ5 share the same αv subunit. In the process of endocytosis and exocytosis, there might be some competitive relationship between these 2 integrin isoforms. Compared with integrin αvβ5, integrin αvβ6 has the priority to get into the trafficking process, and it has subsequent effects on the adhesion and migration of colon cancer cells.
Integrins; Colonic neoplasms; Endocytosis; Exocytosis; Cell movement
R363
A
10.3969/j.issn.1000-4718.2012.12.008
