不同人结直肠肿瘤细胞系对常用抗肿瘤药物体外化疗敏感性的比较*
2012-11-06张晓莉师宪平曹锦萍宋敏敏卢碧燕黄兰兰温创宇皮荣标黄美近刘焕亮
张晓莉, 师宪平, 曹锦萍, 宋敏敏, 卢碧燕, 李 文, 黄兰兰, 温创宇, 皮荣标, 黄美近, 刘焕亮△
(1中山大学胃肠病学研究所, 2中山大学附属第六医院,广东 广州 570655;3广州医学院生物化学教研室,广东 广州 510182; 4中山大学药学院, 广东 广州 510080)
1000-4718(2012)12-2172-06
2012-09-09
2012-11-16
广州市科技计划项目(No.2011J5200009);中山大学百人计划科研团队建设项目(No.88000-3281302);广东省科技计划项目(No.2011B080701064);广东省自然科学基金资助项目(No.9151008901000196)
△通讯作者Tel: 020-39443272; 黄美近E-mail: maymay0129@21cn.com; 刘焕亮E-mail: Huanliang.Liu@gmail.com
不同人结直肠肿瘤细胞系对常用抗肿瘤药物体外化疗敏感性的比较*
张晓莉1,2, 师宪平3, 曹锦萍1,2, 宋敏敏1,2, 卢碧燕1,2, 李 文1,2, 黄兰兰1,2, 温创宇1,2, 皮荣标4, 黄美近2△, 刘焕亮1,2△
(1中山大学胃肠病学研究所,2中山大学附属第六医院,广东 广州 570655;3广州医学院生物化学教研室,广东 广州 510182;4中山大学药学院, 广东 广州 510080)
目的观察5种常用抗肿瘤药物对这些人结直肠肿瘤细胞系的生长抑制作用,探讨5种常用抗肿瘤药物对11株人结直肠肿瘤细胞系的作用强度以及比较其体外敏感性,研究不同抗肿瘤药物对人结直肠癌细胞系HCT116和SW480热休克蛋白27(HSP27)和HSP70表达水平的影响。方法采用CCK-8(Cell Counting Kit-8)法检测5种常用抗肿瘤药物分别对11株人结直肠肿瘤细胞系的生长抑制效应,计算50%抑制浓度(50% inhibitory concentration, IC50)及敏感指数,并比较不同人结直肠肿瘤细胞系对5种抗肿瘤药物的敏感性,Western blotting检测HSP27和HSP70蛋白表达水平。结果11株人结直肠肿瘤细胞系对5-氟尿嘧啶(5-FU)和奥沙利铂(OHP)均比较敏感,没有明显耐药性;5株人结直肠肿瘤细胞系对丝裂霉素(MMC)敏感,6株中度敏感;除SW1116 外的10株人结直肠肿瘤细胞系都对多西紫杉醇(DXL)敏感,而SW1116细胞对DXL表现出明显耐药性;除LS174T和SW1116外的9株人结直肠肿瘤细胞系都对伊立替康(IFL)表现出中度敏感,LS174T细胞对IFL表现敏感,而SW1116细胞对IFL表现出明显耐药性。抗肿瘤药物作用于人结直肠癌细胞系HCT116和SW480使HSP27的表达上调,但HSP70的表达水平变化不明显。结论LS174T是多药敏感细胞株,SW1116是多药耐药细胞株,5-FU和OHP为广谱抗结直肠肿瘤药物;化疗药物的敏感性及HSP27表达量检测对临床选择化疗药物具有一定的提示意义。
结直肠肿瘤; 化学疗法; 药物筛选; 热休克蛋白70; 热休克蛋白27
结直肠癌(colorectal cancer,CRC)是最常见的消化道恶性肿瘤,严重危害人类的生命和健康,也是目前致死率最高的肿瘤之一,2008年世界范围内大约有120万新发病例,每年因结直肠癌死亡的病例超过60万[1]。据2012年卫生部的统计数据显示,我国结直肠癌病死率已位居恶性肿瘤第5位[2]。近年来,包括手术切除、放化疗以及新辅助治疗在内的结直肠肿瘤的各种治疗手段,都取得了显著的进步[3]。随着抗肿瘤药物的不断出现,化疗在综合治疗中占有越来越重要的地位,然而化疗药物毒性并且存在明显的个体差异。同时,结直肠肿瘤化疗耐药现象十分常见,很大程度上影响化疗效果,因此深入系统的研究探讨结直肠肿瘤细胞对化疗药物的敏感性是提高结直肠肿瘤化疗疗效及安全性的一个重要问题。
热休克蛋白(heat-shock protein, HSP)是一组生物体内普遍存在、进化上高度保守的蛋白质家族,又被称为分子伴侣(molecular chaperone),是在生理应激或病理状态等环境因素的刺激下,细胞内诱导合成的一组高度保守的蛋白质。其基本作用是作为分子伴侣参与蛋白质的合成、折叠、积聚、装配、运输和降解,在应激状态下HSP的含量会显著增加并起到保护细胞的作用[4]。其中肿瘤细胞内诱导表达的HSP27和HSP70一方面可能与多种原癌基因互相作用,调节细胞增殖[5],另一方面还参与了肿瘤细胞抗凋亡过程[6]从而增强细胞对损害的耐受力,维持细胞正常功能,提高生存能力。Mazurov等[7]证实了结直肠癌细胞HSP27的诱导性表达使肿瘤细胞获得对顺铂等药物产生获得性耐受。Venkatakrishnan等[8]也证明外源性或内源性HSP27表达上调可提高肿瘤细胞耐药性。HSP70家族是热休克蛋白中最保守的一族,在生物的应激反应中最敏感。当受外界刺激特别是热冲击后,细胞内其它大部分基因的转录和蛋白合成降低,而HSP70蛋白合成增加并与肽链结合,发挥分子伴侣的作用,稳定肽链的空间结构和分布,增加细胞对外界刺激的耐受性,同时也对某些细胞内转录通路进行调节[9]。因此研究不同抗肿瘤药物对人结直肠癌细胞HSP27和HSP70蛋白表达水平的影响,对在临床用药过程中有很重要的提示意义。
本实验选用简便、准确性高的CCK-8(Cell Counting Kit-8)法,系统检测11株人结直肠肿瘤细胞系SW480、HT-29、HCT116、LoVo、SW1116、HCT-8、HCT15、DLD-1、LS174T、SW620和Caco-2对5-氟尿嘧啶(fluorouracil,5-FU)、奥沙利铂(oxaliplatin,OHP)、多西紫杉醇(docetaxel,DXL)、伊立替康(irinotecan,IFL)和丝裂霉素(mitomycin,MMC)5种临床常用抗肿瘤药物的敏感性,同时分析了化疗药物对HCT116和SW480细胞内HSP27及HSP70表达水平的影响,为进一步探讨热休克蛋白与肿瘤细胞耐药性的内在联系奠定基础。
材 料 和 方 法
1材料
人结直肠肿瘤细胞系SW480、HT-29、HCT116、LoVo、SW1116、HCT-8、HCT15、DLD-1、LS174T、SW620和Caco-2购买于中国科学院上海细胞生物学研究所。
2主要试剂与仪器
CCK-8试剂盒购自Dojindo Molecular Technologies;RPMI-1640培养基购自Gibco; 胎牛血清(fetal bovine serum,FBS)购自Gibco;青霉素、链霉素购自Gibco;0.25%胰酶+EDTA购自Gibco;96孔培养板购自Corning;5-FU购自杭州赛诺菲安万特民生制药有限公司;OHP购自杭州赛诺菲安万特民生制药有限公司;DXL购自江苏恒瑞医药股份有限公司;IFL购自Pfizer(Perth) Pty Limited;MMC购自浙江海正药业有限公司;兔抗人HSP70 IgG抗体和兔抗人HSP27 IgG抗体购自武汉博士德生物工程有限公司;兔抗GAPDH IgG抗体购自杭州贤至生物科技有限公司;羊抗兔IgG荧光Ⅱ抗购自LI-COR;细胞裂解液购自碧云天生物技术研究所;Odyssey红外成像系统购自LI-COR;Model680酶标仪购自Bio-Rad;CO2恒温培养箱购自Thermo;Forma ClassⅡA2生物安全柜。
3试剂和药物配制
3.1RPMI-1640完全培养基的配制 在基础RPMI-1640培养基中加入10%FBS、1×105U/L青霉素和100 mg/L链霉素。
3.2CCK-8测定液的配制 按照CCK-8∶无血清培养基=1∶9的比例配制CCK-8测定液,现配现用,避光操作。
3.3药敏实验所用药物的配制 5-FU的浓度分别是500 μmol/L、125 μmol/L、31.25 μmol/L、7.81 μmol/L和1.95 μmol/L;OHP的浓度分别是100 μmol/L、25 μmol/L、6.75 μmol/L、1.688 μmol/L和0.422 μmol/L;DXL的浓度分别为50 nmol/L、12.5 nmol/L、3.375 nmol/L、0.844 nmol/L和0.211 nmol/L;IFL的浓度分别是100 μmol/L、25 μmol/L、6.75 μmol/L、1.686 μmol/L和0.422 μmol/L;MMC的浓度分别是1 000 nmol/L、250 nmol/L、62.5 nmol/L、15.875 nmol/L和3.969 nmol/L。
4主要方法
4.1细胞培养 取液氮冻存的各细胞,37~38 ℃水温迅速融化后900 r/min离心3 min,去上清,接种于培养瓶中,37 ℃恒温恒湿、5% CO2培养箱中培养。毎3~4 d传代1次,用0.25%胰蛋白酶和0.02% EDTA消化后传代或收集对数生长期的细胞进行实验。
4.2细胞生长曲线测定 取生长状态良好处于对数生长期各细胞,制成单细胞悬液,台盼蓝染色进行细胞计数后按1 000 cells/well、2 000 cells/well、3 000 cells/well、4 000 cells/well和5 000 cells/well接种于96孔培养板,培养基为RPMI-1640完全培养基,边缘孔用无菌的PBS填充,毎孔100 μL,设3个复孔,37 ℃培养24 h至贴壁。更换新鲜的培养基,继续培养24 h、48 h、72 h后分别用CCK-8测定法测定吸光度(absorbance,A)值。
4.3体外药物敏感性实验 用生长曲线所确定的细胞浓度,接种于96孔培养板,培养基为RPMI-1640完全培养基,边缘孔用无菌的PBS填充,毎孔100 μL,37 ℃、5% CO2培养箱孵育24 h后,用各梯度浓度的药物作用72 h,每个浓度设3个复孔,对照组的药物浓度为0,作用72 h后,用CCK-8法测定A值。
4.4CCK-8测定 弃去96孔板中原有的培养基,每孔加入100 μL CCK-8测定液,以仅含CCK-8测定液的无细胞孔为空白调零孔。37 ℃避光孵育0.5~4 h,分别于0.5 h、1 h、2 h、3 h和4 h时点在酶标仪上测定A值,测定波长为450 nm,参比波长为630 nm。
4.5敏感性判定[10]敏感指数(耐药指数)根据IC50与最高血浆浓度(peak plasma concentration,PPC)的比值来确定。即敏感指数(耐药指数)=IC50/PPC。有敏感性:IC50低于PPC者(敏感指数<1者);中等敏感性:IC50为PPC的1~10倍(耐药指数为1~10者);无敏感性即耐药性:IC50超过PPC的10倍者(耐药指数>10者)。
4.65种抗肿瘤药物的PPC 所用化疗药物的100%测试药物浓度(TDC)为按国人药物常规用量(毫克/体表面积),在药物的药代动力学指导下测出的血液内峰值浓度PPC,分别为:5-FU(192.189 μmol/L);OHP(12.585 μmol/L);DXL(12.387 μmol/L);IFL(6.940 μmol/L);MMC(0.688 μmol/L)。
4.7Western blotting检测 将对数生长期的HCT116细胞和SW480细胞分别用IC50对应浓度的化疗药物处理24 h后提取细胞总蛋白,10% SDS-PAGE凝胶分离蛋白,通过半干转方式将蛋白转至0.22 μm孔径的硝酸纤维膜上,用Ⅰ抗封闭液室温封闭2 h后,分别加入含HSP70(1∶400)、HSP27(1∶400)和GAPDH(1∶500)的Ⅰ抗稀释液(PBST配制),4 ℃过夜孵育,PBST洗膜3次,每次10 min,分别滴加羊抗兔IgG荧光Ⅱ抗(1∶10 000)(PBST配制)稀释液,室温避光孵育1 h,PBST洗膜4次,每次10 min,利用Odyssey红外成像系统仪检测目标条带并测定条带灰度值,通过计算HSP70和HSP27分别与GAPDH灰度值的比值考察蛋白表达水平。
5统计学处理

结 果
111株人结直肠肿瘤细胞系种板浓度
所得A值保证3个复孔标准差不大于均数的10%,以3个复孔平均A值为纵坐标,毎孔的种板细胞数量为横坐标绘制细胞生长曲线,得到11株人结直肠肿瘤细胞系的药物敏感性实验种板浓度。根据细胞的生长曲线,SW480、HCT116、LoVo、HCT-8、HCT15、LS174T、Caco-2和SW620细胞的种板密度均为4 000 cells/well,HT-29和DLD-1细胞的种板密度均为5 000 cells/well,SW1116细胞的种板密度为6 000 cells/well。
25种常用抗肿瘤药物对11株人结直肠肿瘤细胞系的IC50
5-FU对11株人结直肠肿瘤细胞系的IC50为0.108~651.537 μmol/L,以Caco-2细胞对药物最为敏感,SW1116细胞最不敏感;OHP的IC50为0.558~16.618 μmol/L,以HCT116细胞对药物最为敏感,SW620细胞最不敏感;DXL的IC50为0.001~461.090 μmol/L,以LS174T细胞对药物最为敏感,SW1116细胞最不敏感;IFL的IC50为8.378~1 256.187 μmol/L,以LS174T细胞对药物最为敏感,SW1116细胞最不敏感;MMC的IC50为0.151~4.445 μmol/L,以HCT15细胞对药物最为敏感,SW1116细胞最不敏感,见表1。

表1 5种常用化疗药物对11株人结直肠肿瘤细胞系的IC50
aRepresentative IC50values of DXL for Caco-2, HCT15, HCT116, HT29, DLD-1 and LS174T cells were 0.00344 μmol/L, 0.001352 μmol/L, 0.003883 μmol/L, 0.003596 μmol/L, 0.001217 μmol/L and 0.000548 μmol/L, respectively.*P<0.05vsother groups.
311株人结直肠肿瘤细胞系对5种常用抗肿瘤药物的敏感指数
11株人结直肠肿瘤细胞对5-FU和OHP比较敏感,没有表现出耐药性;5株人结直肠肿瘤细胞对MMC敏感,6株中度敏感;除SW1116外的10株人结直肠肿瘤细胞系都对DXL敏感,而SW1116细胞对DXL表现出明显耐药性;除LS174T和SW1116外的9株人结直肠肿瘤细胞系都对IFL表现出中度敏感,LS174T细胞对IFL表现敏感,而SW1116细胞对IFL表现出明显耐药性。LS174T是多药敏感细胞株,SW1116是多药耐药细胞株,5-FU和OHP为广谱抗结直肠肿瘤药物,见表2。
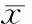
表2 11株结直肠肿瘤细胞对5种常用化疗药物的敏感指数
aRepresentative sensitivity indexes of Caco-2, HCT15, HCT116, HT29, DLD-1, LS174T, LoVo and SW620 cells to DXL were 0.000277912, 0.000109226, 0.000313702, 0.000290515, 9.83196×10-5, 4.42721×10-5, 0.001426967 and 0.000883907, respectively.*P<0.05vsother groups.
4HCT116细胞中HSP27和HSP70的表达
Western blotting结果显示,HCT116细胞在各化疗药物IC50浓度的作用下,HSP27的表达有不同程度的增高,而HSP70表达量的变化不明显,见图1。
5SW480细胞中HSP27和HSP70的表达
Western blotting结果显示,SW480细胞在各化疗药物IC50浓度的作用下,HSP27在5-FU、OHP和DXL IC50的作用下有不同程度的上调,但是在IFL和MMC的作用下表达量下调;HSP70在5-FU IC50的作用下表达上调,在其它药物的IC50作用都有不同程度的下调。


图1化疗药物对HCT116细胞中HSP70和HSP27表达的影响


图2化疗药物对SW480细胞中HSP70和HSP27表达的影响
讨 论
由于肿瘤是一个异质性、多态性、分化不均的细胞群体,临床上常发现同一组织学类型的肿瘤对同一化疗药物敏感性存在着差异,而且肿瘤多药耐药(multidrug resistance, MDR)也普遍存在,这些因素直接影响肿瘤的化疗效果。目前临床上使用的抗肿瘤药物多达上百种,而不同的组织学类型的肿瘤甚至来自同一脏器具有相同组织学类型的肿瘤对抗肿瘤药物的敏感性也不尽相同。提高肿瘤化疗效果的一个关键性问题是克服化疗药物的耐药性。根据药物敏感性进行个体化治疗,可以提高治疗效果,因此,通过药物敏感性试验来选择药物,不仅可以提高疗效,而且也可以避免无效的抗肿瘤药物带来的毒副作用。本实验采用5种临床常用的化疗药物,以系统的确定和比较体外人结直肠肿瘤细胞系对化疗药物的敏感性。
从上述体外药物敏感性实验结果可以看出大部分人结直肠肿瘤细胞系对5种常规临床抗肿瘤药物比较敏感,LS174T细胞对5种抗肿瘤药物都具有敏感性;Caco-2、HCT15、HCT116和HT29细胞对5-FU、OHP、DXL和MMC均具有敏感性,但是对IFL中度敏感;DLD-1、LoVo、SW480和HCT-8细胞对5-FU、OHP和DXL均具有敏感性,但是对IFL和MMC中度敏感;SW620细胞对5-FU和DXL均具有敏感性,但是对OHP、IFL和MMC中度敏感;SW1116细胞对DXL和IFL产生耐药,对5-FU、OHP和MMC具有中度敏感性。人结直肠肿瘤细胞系对各种抗肿瘤药物的敏感性不同,存在自然耐药性,可根据不同的人结直肠肿瘤细胞系对抗肿瘤药物的敏感性来选择不同的抗肿瘤药物。11株结直肠肿瘤细胞对5-FU和OHP比较敏感,没有表现出耐药性,因此5-FU和OHP可以考虑作为治疗结直肠肿瘤的广谱性化疗药物。体外抗肿瘤药物敏感性试验结果为临床选择有效的抗肿瘤药物,开展结直肠肿瘤的个体化治疗从而明显改善结直肠肿瘤患者的预后有一定的提示作用。
热休克蛋白是一组广泛存在于原核细胞和真核细胞中,在生理、病理及应激状态下,于细胞内合成的具有高度保守的氨基酸序列及其编码基因的蛋白质,在应激状态下提高细胞对应激损伤的耐受性[11-12]。本研究发现,不同抗肿瘤药物作用对不同人结直肠癌细胞(HCT116和SW480)中HSP70和HSP27表达水平的影响不同,这可能与不同肿瘤细胞的基因型不同以及不同药物的作用机制不同有关,同时HSP27和HSP70对化疗药物的响应浓度和响应时间存在差异。HSP27与细胞耐药性密切相关[13-14],而本研究发现5种化疗药物均诱导HCT116细胞内HSP27的表达,同时HCT116细胞对化疗药物均比较敏感。这主要是因为本研究使用的药物浓度是IC50对应浓度,该浓度下对药物敏感的细胞株HCT116仍对药物有一定的耐受性,可见化疗药物的临床使用不仅要选择合适的药物,同时要确定合适的药物浓度。
从实验结果可以看到,不同抗肿瘤药物作用人结直肠癌细胞HCT116使HSP27表达量有不同程度的增加。可能是因为HSP27磷酸化形成二聚体可以通过三方面稳定细胞结构:(1)与微管蛋白相结合增加微管的稳定性和完整性;(2) 使肌动蛋白(F-actin)磷酸化,阻止微丝的分裂以促进微丝多聚化以保持微丝的稳定,HSP27同一种体外肌动蛋白聚合抑制剂有着高度序列相似性,能够稳定肌动蛋白细胞骨架来抵抗外界应激;(3) 还通过与中间丝相互作用来避免中间丝异常聚合[15],所以HSP27在细胞中的表达会有不同程度的升高,但是在IFL和MMC作用下SW480细胞HSP27的表达是下调的,可能还有其它的作用机制有待于进一步的研究。
HSP27在HCT116细胞系中在受到各抗癌药物的IC50浓度作用后,均有不同程度的上调,说明HCT116本身对各化疗药物敏感的特性在受到化疗药物刺激后发生改变。由于多数耐药肿瘤细胞中存在HSP27表达上调,并且体外阻断HSP27表达可逆转药物耐受性,因此,可以认为HSP27表达可作为预测抗癌药物疗效的指标。虽然体外研究提示阻断HSP27表达可逆转耐药,但如何通过其它方法抑制HSP27基因的保护功能,更有效地发挥化疗药物的抗癌作用需要进一步的深入的研究,其临床应用尚存在许多问题,作为一类在机体大多数正常细胞持续表达、生物学作用广泛的小分子蛋白,HSP27的表达一旦被阻断后,是否会对机体产生严重的不良影响?所有这些均需要学者们在基础和临床领域的继续探索。
本实验是将肿瘤细胞完全暴露在药物下进行的,而药物在体内分布、代谢、排泄速度与体外实验具有较大差异,因此,对于此类细胞毒类抗肿瘤药物有效性研究的结果并不能准确地预测受试物的临床疗效。然而,体外药敏实验结果的初步筛选可为临床治疗提供线索。因此,我们将进一步对影响人结直肠肿瘤细胞的功能化合物进行研究,深入探讨热休克蛋白等肿瘤细胞耐药相关蛋白的作用机制,为结直肠肿瘤药物开发提供新靶点,同时也为结直肠肿瘤的综合防治提供新思路。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011,61(2):69-90.
[2] 中华人民共和国卫生部. 2012年中国卫生统计提要[EB/OL].[2012-06-06] http://www.moh.gov.cn/publicfiles/business/htmlfiles/mohwsbwstjxxzx/s9092/201206/55044.htm
[3] Gill S, Blackstock AW, Goldberg RM. Colorectal cancer[J]. Mayo Clin Proc, 2007,82(1):114-129.
[4] Wynn RM, Davie JR, Cox RP, et al. Molecular chape-rones: heat-shock proteins, foldases, and matchmakers[J]. J Lab Clin Med, 1994, 124(1):31-36.
[5] Cardoso F, Di Leo A, Larsimont D, et al. Evaluation of HER2,p53,bcl-2, topoisomerase II-α, heat shock proteins 27 and 70 in primary breast cancer and metastatic ipsilateral axillary lymph nodes[J]. Ann Oncol, 2001, 12(5):615-620.
[6] Nylandsted J, Brand K, Jäättelä M. Heat shock protein 70 is required for the survival of cancer cells[J]. Ann N Y Acad Sci, 2000, 926: 122-125.
[7] Mazurov VV, Edelweiss EF, Akatov VS, et al. Small heat shock protein hsp27 as a possible mediator of intercellular adhesion-induced drug resistance in human larynx carcinoma HEp-2 cells[J]. Biosci Rep, 2003, 23(4):187-197.
[8] Venkatakrishnan CD, Kuppusamy P, Ilangovan G, et al. Heat shock protects cardiac cells from doxorubicin-induced toxicity by activating p38 MAPK and phosphorylation of small heat shock protein 27[J]. Am J Physiol Heart Circ Physiol, 2006, 291(6):H2680-H2691.
[9] Choi SR, Lee SA, Kim YJ, et al. Role of heat shock proteins in gastric inflammation and ulcer healing [J]. J Physiol Pharmacol,2009, 60(Suppl 7):5-17.
[10]Barilero I, Gandia D, Armand JP, et al. Simultaneous determination of the camptothecin analogue CPT-11 and its active metabolite SN-38 by high-performance liquid chromatography: application to plasma pharmacokinetic studies in cancer patients[J]. J Chromatogr,1992,575(2):275-280.
[11]Finkel T,Serrano M,BlascoLASCO MA. The common biology of cancer and ageing[J]. Nature,2007,448(7155):767-774.
[12]Mosser DD,Morimoto RI. Molecular chaperones and the stress of oncogenesis[J]. Oncogene, 2004, 23(16):2907-2918
[13]ArrigoRRIGO AP, FirdausIRDAUS WJ, MellierELLIER G. Cytotoxic effects induced by oxidative stress in cultured mammalian cells and protection provided by Hsp27 expression[J]. Methods, 2005, 35(2):126-138.
[14]李达君,袁 君,朱 江,等.NMP238,HSP70在宫颈鳞癌中的表达及意义[J].中国医学工程, 2007,15(4):320-322,326.
[15]Sun Y, MacRae TH. Small heat shock proteins: molecular structure and chaperone function[J]. Cell Mol Life Sci, 2005, 62(21):2460-2476.
Sensitivityofdifferenthumancolorectaltumorcelllinestocommonlyusedchemotherapeuticdrugsinvitro
ZHANG Xiao-li1,2, SHI Xian-ping3, CAO Jin-ping1, 2, SONG Min-min1, 2, LU Bi-yan1, 2, LI Wen1, 2, HUANG Lan-lan1, 2, WEN Chuang-yu1, 2, PI Rong-biao4, HUANG Mei-jin2, LIU Huan-liang1,2
(1InstituteofGastroenterology,SunYat-senUniversity,2theSixthAffiliatedHospital,SunYat-senUniversity,Guangzhou510655,China;3DepartmentofBiochemistry,GuangzhouMedicalUniversity,Guangzhou510182,China;4SchoolofPharmaceuticalSciences,SunYat-senUniversity,Guangzhou510080,China,E-mail:maymay0129@21cn.com,Huanliang.Liu@gmail.com)
AIM: To observe the antitumor effect of 5 commonly used chemotherapeutic drugs on 11 human colorectal cancer cell linesinvitro.METHODSCCK-8 method was used to determine the growth inhibitory effects of 5 antitumor drugs, which were expressed as the half growth inhibitory concentration (IC50) and sensitivity index IC50/PPC (peak plasma concentration) on 11 human colorectal cancer cell lines. The expression variations of heat-shock protein 27 (HSP27) and HSP70 at protein levels in human colorectal tumor cell lines treated with different chemotherapeutic drugs were observed by Western blotting.RESULTSAll the 11 colorectal cancer cell lines were sensitive to 5-fluorouracil (5-FU) and oxaliplatin (OHP) without drug resistant. Five colorectal cancer cell lines were sensitive to mitomycin (MMC), while the other 6 cell lines were moderately sensitive. Ten colorectal cancer cell lines except SW1116 were sensitive to docetaxel (DXL), while SW1116 cells were resistant to DXL. Nine colorectal cancer cell lines except LS174T and SW1116 were moderately sensitive to irinotecan (IFL), and SW1116 cells were also resistant to IFL, while LS174T cells were sensitive to IFL. After treated with the antitumor drugs, HSP27 was up-regulated in HCT116 cells and SW480 cells, while the expression of HSP70 didn’t change.CONCLUSIONLS174T cells are multidrug-sensitive, while SW1116 cells are multidrug-resistant. 5-FU and OHP are the wide-spectrum anti-colorectal cancer drugs. Determining the sensitivity to chemotherapeutic drugs and the expression level of HSP27 can improve the accuracy in drug selection.
Colorectal neoplasms; Chemotherapy; Drug screening; Heat-shock protein 70; Heat-shock protein 27
R735.3
A
10.3969/j.issn.1000-4718.2012.12.011
