肿瘤相关巨噬细胞在晚期卵巢癌组织中的浸润与肿瘤浸润淋巴细胞表型、免疫效能之间的关系*
2012-11-06徐丽南杨建波
徐丽南, 林 楠, 何 科, 蔡 坚, 杨建波
(1中山大学附属第一医院妇产科,广州 广东 510080; 2中山大学附属第三医院肝胆外科, 广州 广东 510630)
1000-4718(2012)09-1618-05
2012-05-13
2012-07-16
广东省科技计划项目(No. 2010B031600313)
△通讯作者 Tel:020-87334870;E-mail:drxulinan@gmail.com
肿瘤相关巨噬细胞在晚期卵巢癌组织中的浸润与肿瘤浸润淋巴细胞表型、免疫效能之间的关系*
徐丽南1△, 林 楠2, 何 科1, 蔡 坚1, 杨建波1
(1中山大学附属第一医院妇产科,广州 广东 510080;2中山大学附属第三医院肝胆外科, 广州 广东 510630)
目的探讨晚期卵巢癌组织中浸润的肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)与肿瘤浸润淋巴细胞(tumor-infiltrating lymphocyte,TIL)表型及免疫效能的关系。方法免疫组化方法分析175例低分化卵巢癌组织病理切片中TAM分布密度,以中位数为界限将病例分为TAM高密度组和TAM低密度组,对照组为32例良性卵巢病变组织;应用流式细胞术分析TAM高密度组与TAM低密度组中TIL的CD8+和CD25+表型变化情况;体外扩增培养TIL后取细胞培养上清液,ELISA法分析各组TIL中白细胞介素2(IL-2)、白细胞介素-10(IL-10)、转化生长因子β(TGF-β)和干扰素γ(IFN-γ)细胞因子表达变化。结果175例低分化卵巢癌组织中TAM平均浸润密度为62.8/高倍镜视野(HP,×400),中位数为53.3/HP,其中TAM高密度组87例,TAM低密度组88例;对照组TAM平均浸润密度10.5/HP(P<0.05)。CD8+在TAM高密度组中表达平均值为24%,在TAM低密度组中表达平均值为52%(P<0.05);CD25+在TAM高密度组中表达平均值为48%,在TAM低密度组中表达平均值为25%(P<0.05);对照组中CD8+和CD25+的TIL平均浸润密度为7%, TAM高密度组及TAM低密度组中CD8+和CD25+的TIL平均浸润密度显著高于对照组(P<0.05)。与TAM低密度组比较,TAM高密度组中TIL的杀伤性细胞因子IL-2和IFN-γ表达明显减少(P<0.05),而抑制性细胞因子IL-10和TGF-β表达明显增加(P<0.05)。结论高密度TAM浸润的卵巢癌组织中,CD25+的TIL表型增多,CD8+的TIL表型减少,抑制性细胞因子IL-10和TGF-β表达增加,杀伤性细胞因子IL-2和IFN-γ表达减少,提示TAM浸润密度与TIL表型及免疫效能相关。
肿瘤相关巨噬细胞; 肿瘤浸润淋巴细胞; 卵巢肿瘤; 肿瘤逃逸
近年来针对肿瘤的免疫方法取得了一定的疗效。肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TIL)就是其中一类重要细胞[1-2],将体外激活并扩增的TIL回输至患者体内后,杀瘤效应明显,且副作用相对较小。但实验研究也发现应用TIL治疗晚期肿瘤效果并不明显,个体差异较大,疗效的差异与TIL的表型及免疫效能的差异相关[3]。同时相关研究也发现,在晚期肿瘤组织中均出现肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)的浸润[4],而TAM浸润程度与TIL表型及免疫功能的关系,及其与预后的相关性尚有待进一步研究。本文拟通过观察晚期卵巢癌组织中TAM浸润程度与TIL的表型及免疫效能变化的关系,探讨卵巢癌组织中TAM协助肿瘤免疫逃逸的可能机制。
材 料 和 方 法
1病例选择
选取2010年3月至2011年6月期间于中山大学附属第一医院妇科就诊的卵巢恶性肿瘤患者,按准入标准选择175例用于相关研究:(1)首次治疗的上皮性卵巢癌病例,术后病理提示为低分化;(2)手术后分期为III期或IV期;(3)从未进行过化疗或放疗治疗的病例;(4)从未接受相关免疫学治疗的病例;(5)无合并其它免疫系统疾病。同时选择同期在中山大学附属第一医院妇科就诊并行手术切除的卵巢良性肿物病例(32例)作为对照组。
2方法
2.1免疫组化检测肿瘤组织中TAM浸润情况 常规方法切片脱蜡,微波修复抗原后将组织切片放入已预热至100 ℃的EDTA修复液(1 mmol/L,pH 8.0)浸泡15 min,孵Ⅰ抗(鼠抗人CD68购于Santa Cruz)4 ℃过夜,DAB显色,苏木精复染,中性树胶封片,PBS为阴性对照。高倍镜下(×400)观测5个视野下TAM,取平均值为此例病理切片的TAM浸润密度。
2.2TIL细胞分离培养 见参考文献[1]。
2.3TIL细胞表型分析 取生长旺盛,处于对数生长期,且存活率为95%以上的TIL细胞长至80%以上融合后,弃去培养液,加入PBS液洗涤细胞2次,加入0.25%胰蛋白酶+0.01% EDTA将TIL消化下来并离心,弃上清液后再用PBS重悬细胞,制成1×109cells/L的细胞悬液,将其分装至1.5 mL的EP管内后,加入10 μL荧光标记抗体CD8-FITC、CD25-FITC,另设1管为空白对照,室温避光孵育30 min;PBS再洗2~3次,减少非特异性结合;加入200 μL PBS混匀细胞,4 ℃保存,上流式细胞仪检测。
2.4ELISA法检测TIL培养液上清中白细胞介素2(interleukin-2,IL-2)、白细胞介素10(interleukin-10,IL-10)、转化生长因子β(transforming growth factor β, TGF-β)和干扰素γ(interferon γ, IFN-γ)细胞因子的表达 体外扩增培养TIL并应用植物凝集素刺激(2 mg/L)后将生长良好的TIL培养液上清收集起来,12 000 r/min 离心10 min去除细胞碎片。按ELISA试剂盒(购自R&D,灵敏度=150 ng/L)说明书分别设空白孔、标准孔、待测样品孔。空白孔加样品稀释液100 μL,余孔分别加标准品或待测样品100 μL,轻轻晃动混匀,酶标板加上盖或覆膜,37 ℃反应120 min。甩干弃去液体。每孔加配置好的生物素标记的抗体工作液100 μL,37 ℃反应60 min。后甩干弃去液体,洗板3次,每次浸泡1~2 min,350 μL/well,甩干。每孔加辣根过氧化物酶标记亲和素工作液100 μL,37 ℃、60 min。后甩干弃去液体,洗板5次,每次浸泡1~2 min,350 μL/well,甩干。依序每孔加底物溶液90 μL,37 ℃避光显色。依序每孔加终止溶液50 μL,终止反应。酶联仪450 nm波长依序测量各孔的吸光度。每个样本检测重复3次。
3统计学处理
结 果
1卵巢癌组织及卵巢良性组织中TAM浸润情况
本组所有病例的癌组织中均可见TAM浸润,在间质及癌巢中均可见棕色(CD68+)的阳性TAM分布,高倍镜下(×400)可见TAM胞浆中表达棕黄色颗粒。175例卵巢癌病理切片中TAM平均浸润密度62.8/高倍镜视野(high power, HP)(×400),中位数为53.3/HP(×400)。以中位数为界将卵巢癌组分为两亚组:TAM高密度组(88例)和TAM低密度组(87例)。卵巢良性病变组织切片中可见巨噬细胞稀疏散在浸润,数量少,TAM平均浸润密度10.5/HP(×400),见图1;卵巢良性组织中浸润的TAM与卵巢癌组织中浸润的TAM相比,差异有统计学意义(P<0.05),见图2。
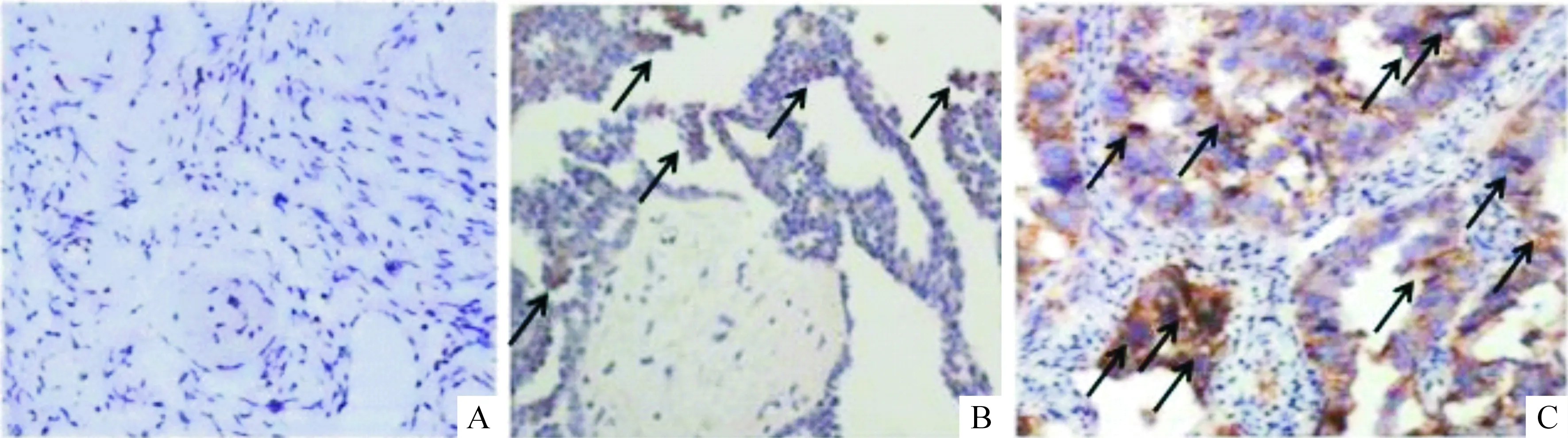
Figure 1. The immunohistochemistry photographs of tumor-associated macrophage according to infiltraion density.A: the representative immunohistochemistry image of TAM in benign ovarian tissue, few positive results were showed;B: the representative immunohistochemistry image of TAM in malignant ovarian cancer tissue,there were lesser positive results (black arrows);C:the representative immunohistochemistry picture of TAM in malignant ovarian cancer tissue,there were major positive results (black arrows).
图1不同浸润密度的TAM免疫组化图片


图2恶性肿瘤组与良性肿瘤组浸润巨噬细胞的比较
2流式细胞术分析TIL表型变化情况
TAM高密度组中CD8+表达平均值为24%,CD25+表达平均值为35%;TAM低密度组中CD8+表达平均值为38%,CD25+表达平均值为18%;对照组中CD8+及CD25+表达平均值均为7%;3组间CD8+及CD25+的TIL比较均有显著差异(P<0.05),见图3。


图33组中肿瘤浸润淋巴细胞的表型变化情况
33组中TIL培养液上清中IL-2、IL-10、TGF-β和IFN-γ的表达情况
随着TAM浸润密度的增加,TIL表达的IL-2和IFN-γ细胞因子表达减少(对照组> TAM低密度组> TAM高密度组,P<0.05),同时TIL表达的IL-10和TGF-β抑制性细胞因子表达增多(TAM高密度组> TAM低密度组> 对照组,P<0.05),见图4。
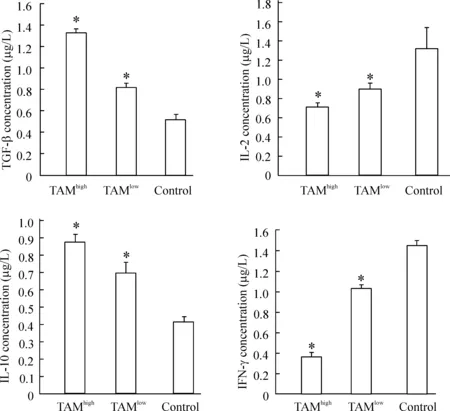

图43组中IL-2、IL-10、TGF-β和IFN-γ的表达水平
讨 论
巨噬细胞是一类重要的免疫细胞,广泛参与免疫应答、免疫效应与免疫调节。一般认为,激活的巨噬细胞能更有效地发挥杀瘤作用,但是相关研究却发现肿瘤部位浸润的巨噬细胞量越大,活性越强,其抗肿瘤效果却越差,TAM的浸润却与肿瘤的预后不良明显相关[4]。Takanami等[5]在检测了113名肺腺癌患者的手术标本内TAM浸润密度后,发现TAM浸润密度高的患者预后较差。我们的研究发现在恶性卵巢癌组织中,TAM的平均浸润数目达到62.8/HP,而在对照组良性卵巢肿瘤组织中,这一数目仅为10.5/HP,两者差别显著,但我们未作TAM浸润数目与卵巢癌预后之间的关系分析,但万挺等[6]通过对67例晚期卵巢上皮癌组织中的TAM进行分析,发现TAM浸润密度的高低是影响晚期上皮性卵巢癌生存的独立预后因子。
1967年Burnett提出的免疫监视学说认为在正常情况下机体的免疫系统可以识别并特异性杀灭恶变的肿瘤细胞,但是在实际情况中,肿瘤细胞常常能够逃脱淋巴细胞的监视,达到免疫逃逸,这也是促进肿瘤组织生长进展的重要因素之一。肿瘤细胞表面抗原虽然可致敏T细胞杀伤、溶解肿瘤细胞,但激活T细胞至少需要双重激活信号,而肿瘤细胞刺激的T细胞则往往由于缺乏第二共刺激信号,结果导致T细胞不能顺利致敏。CTL细胞则可以通过溶细胞作用直接杀伤肿瘤细胞,但肿瘤局部的微环境包含的大量细胞因子,会单独或协同地影响CTL的活化,降低CTL杀伤细胞的敏感性,影响CTL的抗瘤作用[7]。
此外研究表明肿瘤组织中淋巴细胞的亚群比例会发生变化也是引起免疫逃逸的机制之一,在肿瘤组织中,调节性T细胞(regulatory T cells,Treg)往往呈升高趋势,这类以CD25+为标记的Treg细胞主要司职免疫抑制作用,可抑制CD4+和CD8+反应性T细胞的活化及增殖,并可通过分泌免疫抑制性细胞因子(IL-10、IL-4、TGF-β等)进一步降低免疫效能[8-9]。我们在研究中也发现晚期肿瘤组织中CD4+及CD8+细胞亚型表达降低,而Treg亚型细胞则表达升高,而更令人感兴趣的是这种降低/升高趋势可随TAM浸润密度不同而发生相应的变化,TAM浸润密度越高,引起CD4+及CD8+效应性淋巴细胞降低,CD25+调节性淋巴细胞增多。这也许也解释了在临床上TAM浸润增多引起预后不良的现象。
肿瘤组织中的淋巴细胞效能低下的机制还可能是由于肿瘤基质影响了免疫细胞因子的表达导致的。TGF-β是一类作用广泛的细胞因子,对机体的免疫系统具有全面的抑制作用,相关研究则证实TGF-β不但对机体的免疫系统产生多方面抑制,同时还能保护肿瘤细胞避免被免疫细胞识别[10-11];IL-10则常常通过阻抑抗原呈递细胞(APC)的浸润、分化、成熟等,促使CD80、CD86、CD40、CD54等低表达或不表达,从而导致CTL处于免疫无能状态或低效能状态,同时这种功能失调的T细胞还可下调IFN-γ的产生,诱导Th0向Th2转化[12],因此肿瘤组织中IL-10常呈现高表达状态。Loser等[13]通过将正常组织中IL-10 mRNA同多种癌症组织中的IL-10 mRNA进行比较,结果发现多种肿瘤组织(宫颈癌、淋巴瘤和黑色素瘤等)中均可检测到IL-10,而正常组织中则不表达或表达量极少。我们研究则发现与之相一致的现象,晚期卵巢癌患者TIL表达的免疫细胞因子受到TAM浸润密度多少的影响,随着TAM浸润密度的增加,TIL表达的杀伤性细胞因子IL-2和IFN-γ表达明显减少(对照组> TAM低密度组> TAM高密度组,P<0.05),而抑制性的细胞因子IL-10和TGF-β则表达明显增多(TAM高密度组> TAM低密度组> 对照组,P<0.05)。
结合细胞表型的研究我们有理由相信晚期卵巢癌组织中的TIL细胞表型容易受到高密度浸润的TAM影响,导致调节型T细胞增多,而效应性T细胞减少,从而影响TIL抗肿瘤效能。因此TAM通过调控TIL表型变化,致使TIL对卵巢癌细胞的“杀伤作用”减弱,从而“协助”卵巢癌细胞免疫逃逸。
[1] 秦迎松, 冯盼盼, 李 俐. 基质胶原蛋白降解产物参与瘤内浸润淋巴细胞的趋化[J]. 中国病理生理杂志,2010, 26(10):1451.
[2] 李彪如, 沈鼎鸿. 肿瘤浸润淋巴细胞生物学性状初步研究[J]. 中华微生物和免疫学杂志,1994, 14(6):399-402.
[3] Van Ravenswaay Claasen HH, Kluin PM, Fleuren GJ. Tumor infiltrating cell in human cancer. On the possible role of CD16+macrophage in antitumor cytotoxity[J]. Lab Invest,1992, 67(2):166-174.
[4] Tanaka Y, Kobayashi H, Suzuki M, et al. Thymidine phosphorylase expression in tumor-infiltrating macrophages may be correlated with poor prognosis in uterine endometrial cancer[J]. Hum Pathol,2002, 33(11): 1105-1113.
[5] Takanami I, Takeuchi K, Kodaira S, et al. Tumor-associated macrophage infiltration in pulmonary adenocarcinoma:association with angiogenesis and poor prognosis[J].Oncology,1999, 57(2):138-142.
[6] 万 挺,刘继红,郑利民,等. 肿瘤相关巨噬细胞在晚期上皮性卵巢癌组织中的浸润及其与预后的关系[J]. 癌症,2009, 28(3): 323-327.
[7] Nagaraj S, Gupta K, Pisarev V, et al. Altered recognition of antigen is a mechanism of CD8+T cell tolerance in cancer[J]. Nat Med, 2007, 13(7): 828-835.
[8] Hoechst B, Ormandy LA, Ballmaier M, et al. A new population of myeloid-derived suppressor cells in hepatocellular carcinoma patients induces CD4+CD25+Foxp3+T cells[J]. Gastroenterology, 2008, 135(1): 234-243.
[9] Lesokhin AM, Hohl TM, Kitano S, et al. Monocytic CCR2+myeloid-derived suppressor cells promote immune escape by limiting activated CD8 T-cell infiltration into the tumor microenvironment[J]. Cancer Res,2012,72(4): 876-886.
[10]Kim S, Buchlis G, Fridlender ZG, et al. Systemic blockade of transforming growth factor-β signaling augments the efficacy of immunogene therapy[J]. Cancer Res,2008, 68(24): 10247-10256.
[11]Garnier D, Milsom C, Magnus N, et al. Role of the tissue factor pathway in the biology of tumor initiating cells[J]. Thromb Res,2010,125(Suppl 2): S44-S50.
[12]Li MO, Sanjabi S, Flavell RA, et al. Transforming growth factor-β controls development, homeostasis, and tolerance of T cells by regulatory T cell-dependent and -independent mechanisms[J]. Immunity,2006, 25(3):455-471.
[13]Loser K, Apelt J, Voskort M, et al. IL-10 controls ultraviolet-induced carcinogenesis in mice[J]. J Immunol, 2007, 179(1):365-371.
Relationshipbetweeninvasionoftumor-associatedmacrophagesandphenotypeandimmuneefficacyoftumor-infiltratinglymphocytesinadvancedovariancarcinoma
XU Li-nan1, LIN Nan2, HE Ke1, CAI Jian1, YANG Jian-bo1
(1DepartmentofObstetrics&Gynecology,theFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China;2DepartmentofHepatobiliarySurgery,theThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China.E-mail:drxulinan@gmail.com)
AIM: To explore the relationship between the invasion of tumor-associated macrophages (TAM) and the phenotype and immune efficacy of tumor-infiltrating lymphocytes (TIL) in advanced ovarian carcinoma.METHODSImmunohistochemical analysis of TAM density in 175 cases of poorly-differentiated ovarian cancer tissue biopsy was performed. The cases were divided into TAM high-density (TAMHigh) group and TAM low-density (TAMLow) group according to the median of TAM density. The control group included 32 cases of benign ovarian lesions. The changes of CD8+and CD25+phenotypes of TIL were detected by flow cytometry analysis. TIL in the 2 groups were culturedinvitroand the conditioned-medium was collected for detecting the expression of IL-2, IL-10, TGF-β and IFN-γ by ELISA.RESULTSThe average TAM infiltration density was 62.8/high-power field (HP, ×400) in 175 cases of poorly-differentiated ovarian carcinoma, and the median was 53.3/HP. TAMHighgroup was 87 cases and TAMLowgroup was 88 cases. A significant difference between malignant ovarian carcinoma group and control group (10.5/HP) was observed. The mean expression of CD8+TIL in TAMHighgroup was 24%, and CD8+TIL in TAMLowgroup was 52% (P<0.05). The mean expression of CD25+TIL in TAMHighwas 48%, and CD25+TIL in TAMLowwas 25% (P<0.05). The average infiltration density of CD8+and CD25+TIL in control group was 7%. The average infiltration density of CD8+and CD25+TIL in TAMHighand TAMLowgroups was significantly higher than that in control group (P<0.05). Compared with TAMLowgroup, TIL destruction cytokines IL-2 and IFN-γ were significantly decreased in TAMHighgroup (P<0.05), while the inhibitory cytokines IL-10 and TGF-β were significantly increased (P<0.05).CONCLUSIONIn high-density TAM infiltration of ovarian cancer tissues, CD25+TIL type and inhibitory cytokines IL-10 and TGF-β increase, while CD8+TIL type and destruction cytokines IL-2/IFN-γ decrease, suggesting that the high-density TAM has relationship with the phenotype and immune efficacy of TIL.
Tumor-associated macrophages; Tumor-infiltrating lymphocytes; Ovarian neoplasms; Tumor escape
R711.75
A
10.3969/j.issn.1000-4718.2012.09.014
