阿托伐他汀通过抑制PKC的激活对抗高糖诱导的人脐静脉内皮细胞氧化应激反应*
2012-11-06柴大军宁若冰许昌声林金秀
柴大军, 宁若冰, 祝 江, 许昌声, 谢 泓, 林金秀
(福建医科大学附属第一医院心内科,福建省高血压研究所,福建 福州 350005)
1000-4718(2012)09-1537-06
2012-04-17
2012-07-18
国家自然科学基金青年基金资助项目 (No.30900586)
△通讯作者 Tel: 0591-87982516; E-mail: caidajun@medmail.com.cn
·论著·
阿托伐他汀通过抑制PKC的激活对抗高糖诱导的人脐静脉内皮细胞氧化应激反应*
柴大军△, 宁若冰, 祝 江, 许昌声, 谢 泓, 林金秀
(福建医科大学附属第一医院心内科,福建省高血压研究所,福建 福州 350005)
目的探讨阿托伐他汀对高糖诱导的人脐静脉血管内皮细胞(HUVECs)产生氧化应激的影响及其作用机制。方法体外培养HUVECs,以25 mmol/L葡萄糖干预,模拟糖尿病患者体内环境,通过流式细胞术和共聚焦显微镜检测细胞内的活性氧(ROS)水平,采用Lucigenin分析方法测定还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶活性,分别应用实时荧光定量PCR和免疫印迹杂交的方法检测 NADPH氧化酶亚基Nox4和Nox2/gp91phox的表达水平,用免疫印迹杂交方法检测蛋白激酶C (PKC)蛋白的磷酸化水平。结果(1)在高糖环境(终浓度为25 mmol/L)下,HUVECs内ROS生成显著增加,NADPH氧化酶的活性显著增强,NADPH 氧化酶Nox4和Nox2/gp91phox亚基的mRNA和蛋白表达水平显著上调;(2)阿托伐他汀可显著抑制高糖诱导的ROS 生成、NADPH氧化酶活性的增强及NADPH 氧化酶Nox4和Nox2/gp91phox亚基表达水平的增加幅度,且具有浓度依赖性;(3) PKC抑制剂(PKC inhibitor peptide, 20 μmol/L)可显著抑制高糖环境下ROS的生成、NADPH氧化酶活性的增强及NADPH 氧化酶Nox4和Nox2/gp91phox亚基表达水平的增加幅度;(4) 阿托伐他汀可抑制高糖诱导的PKC蛋白的磷酸化。结论PKC的活化参与了高糖诱导的HUVECs产生的氧化应激反应。阿托伐他汀通过抑制PKC蛋白的活化对抗高糖诱导的内皮细胞产生的氧化应激反应。
高糖; 氧化应激; 他汀类; 蛋白激酶C
糖尿病已成为全球性的健康问题,而糖尿病患者体内血糖升高能通过多种信号途径激活还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)氧化酶的活化增加,进而引起活性氧(reactive oxygen species, ROS)的生成增加,对血管内皮细胞产生氧化应激损伤,加速了动脉粥样硬化的形成[1]。NADPH氧化酶是血管内皮细胞ROS的主要来源,由NADPH氧化酶4 (NADPH oxidase 4, Nox4)、NADPH氧化酶2( NADPH oxidase 2, Nox2/gp91phox)和p22phox蛋白等多个亚基组成[2]。有许多研究表明ROS产生过多与心血管疾病的发生和发展密切相关。蛋白激酶C(protein kinase C,PKC)不仅是二酰甘油(diacylglycerol, DAG) 和佛波酯肿瘤启动子的下游靶点,也参与了对血管内皮细胞NADPH氧化酶的调控[3]。高血糖能引起血管组织中DAG-PKC通路的激活,抑制PKC的活化可以显著改善糖尿病和高糖对血管内皮功能的损伤[3-4]。 他汀类药物作为目前降脂治疗的关键用药,其在降脂作用之外所具有的抗动脉粥样硬化等作用可能与其抗氧化能力有关[5-6]。本研究将讨论阿托伐他汀在高糖诱导的人血管内皮细胞产生的氧化应激反应过程中的作用及相关机制,为阿托伐他汀心血管保护作用的发挥寻求新的分子机制。
材 料 和 方 法
1材料
M199培养基,胎牛血清(fetal bovine serum, FBS)、胰蛋白酶、磷酸盐缓冲液、Trizol和Opti-MEM购自Invitrogen;real-time PCR试剂盒购自TaKaRa; 2’,7’-二氯二氢荧光素二乙酯(2’,7’-dichlorodihydrofluorescein diacetate,H2-DCFDA)、二氢乙啶(dihydroethidium,DHE)和I型胶原酶购自Sigma;PKC抑制剂(PKC inhibitor peptide)购自Millipore;鼠抗人β-actin单克隆抗体、鼠抗人PKC单克隆抗体、羊抗人p-PKC多克隆抗体和羊抗人Nox4多克隆抗体购自 Santa Cruz;兔抗人Nox2/gp91phox多克隆抗体购自Abcam。
2方法
2.1人脐静脉血管内皮细胞(human umbilical vein endothelial cells, HUVECs)的培养 参照文献[7]的方法,从健康脐带的脐静脉应用0.1% I型胶原酶消化和分离内皮细胞,细胞离心收集后接种于预先用0.1%明胶包被的培养瓶内并用M199培养基+20% FBS+25mg/L内皮细胞生长因子+90 mg/L肝素在37 ℃、5%CO2的培养箱内进行培养。依据细胞典型的铺路石样生长形态,免疫荧光法检测细胞Ⅷ因子抗原等方法鉴定HUVECs,细胞的纯度在95%以上。为避免多次传代过程中细胞发生与存活时间相关的变化,本研究中仅选用1~3代细胞用于研究。
2.2HUVECs的干预和分组 25 mmol/L高浓度葡萄糖常被用来刺激内皮细胞,体外模拟糖尿病患者的体内高糖环境[8]。等摩尔甘露醇作为对照以排除高糖干预时因细胞外渗透压急性改变产生的细胞学效应。将细胞分为正常组(葡萄糖终浓度为5.5 mmol/L)、25 mmol/L甘露醇组和高糖组(葡萄糖终浓度为25 mmol/L)、高糖+阿托伐他汀(0.01 μmol/L)组、高糖+阿托伐他汀(0.1 μmol/L)组、高糖+阿托伐他汀(1 μmol/L)组和高糖+PKC抑制剂组。
2.3流式细胞术检测细胞内活性氧离子的水平 H2-DCFDA是一种脂溶性荧光底物,能顺利通过细胞膜。进入细胞后,被细胞内的ROS氧化后变成2’,7’-dichlorodihydrofluorescein,后者产生可被流式细胞仪检测到绿色荧光。细胞干预结束后,于培养液内加入10 μmol/L H2-DCFDA, 37 ℃、5%CO2培养箱内培养60 min,吸去培养液,用预温的PBS洗细胞1次,用0.25%胰酶-EDTA消化细胞制成细胞悬液。采用525 nm波长滤光片进行流式细胞仪检测各标本的阳性细胞比例和荧光强度。
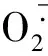
2.5NADPH氧化酶活性测定 NADPH氧化酶活性测定采用Lucigenin分析方法,具体方法参照我们已发表文献[9]。
2.6逆转录和real-time PCR HUVECs被干预结束后,采用real-time PCR试剂盒依据产品说明进行细胞RNA的提取、逆转录和real-time PCR。Nox4引物序列:正义链 5′- AGG GCC AGA GTA TCA CTA CCT CCA C-3′,反义链5′- TGA TCC TCG GAG GTA AGC CAA G -3′; Nox2/gp91phox引物序列: 正义链5’-AAA TGG ATC GCA TCT GTG AC-3’,反义链5’-TGG CCA CAC TAA CAG TGA TTT AGA G-3’; 内参照GADPH引物序列: 正义链5’-GCA CCG TCA AGG CTG AGA AC-3’,反义链5’-TGG TGA AGA CGC CAG TGG A-3’。所有引物序列由TaKaRa公司合成。
2.7细胞蛋白的提取和免疫印迹杂交 提取细胞总蛋白,煮沸变性10 min,采用12% SDS-PAGE电泳分离50 μg细胞蛋白样品,转至PVDF膜后用特异的抗Nox4、Nox2/gp91phox及p-PKC抗体进行免疫杂交检测,β-actin作为内参照。
3统计学处理
结 果
1阿托伐他汀呈浓度依赖性下调高糖诱导内皮细胞产生的ROS水平
流式细胞术的结果显示,高糖(25 mmol/L)干预8 h后内皮细胞内ROS水平显著增加(8.04±0.45vs1.30±0.38,P<0.05),甘露醇干预8 h未显著增加细胞内的ROS生成,阿托伐他汀呈浓度依赖性(10-8mol/L~10-6mol/L)地抑制高糖环境下 HUVECs内ROS的生成,见图1。荧光显微镜观察结果也显示,高糖干预使得内皮细胞内DHE产生的红色荧光强度显著增强,阿托伐他汀(10-6mol/L)显著降低高糖诱导下内皮细胞ROS的生成,见图2。
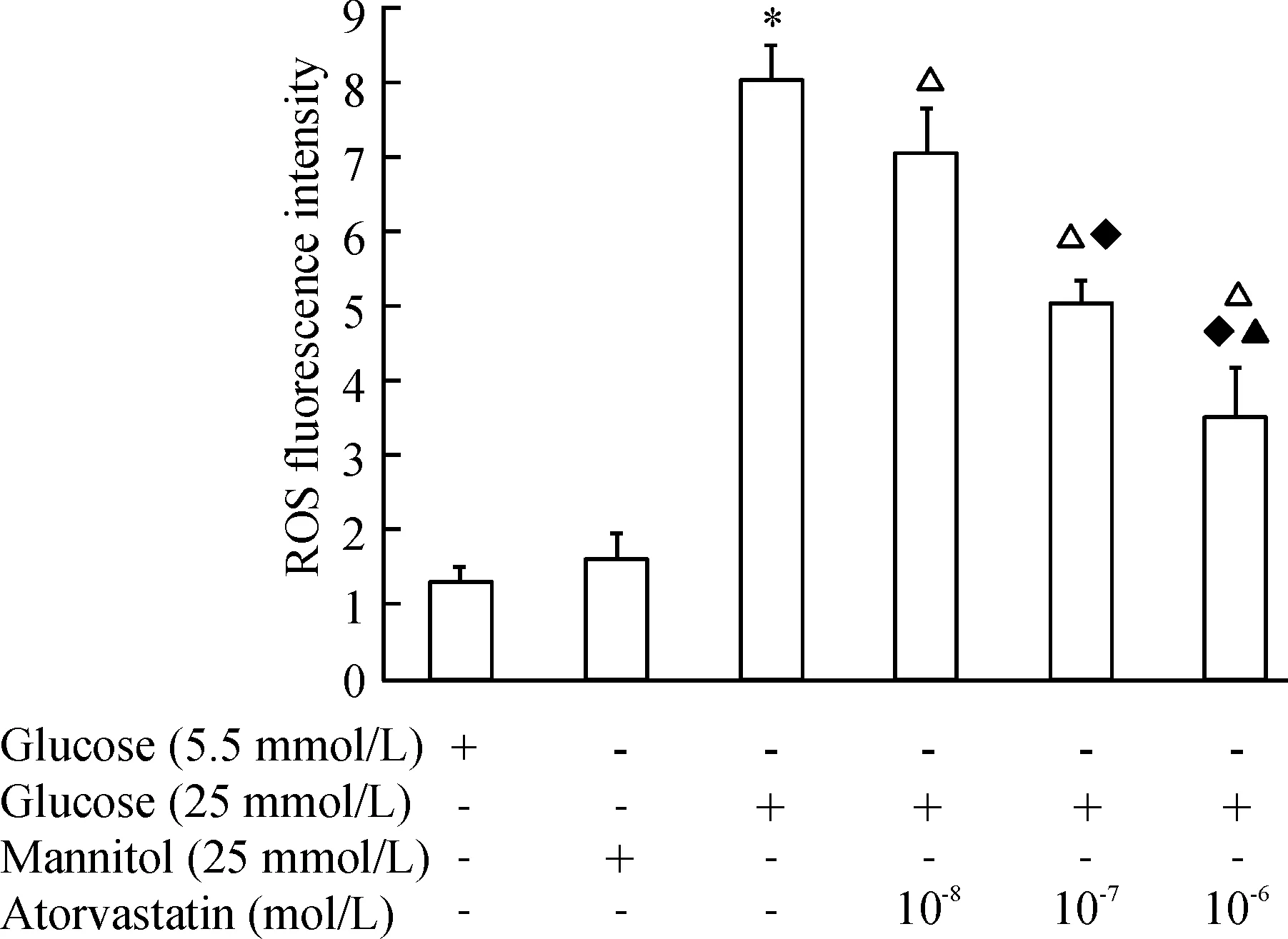

图1阿托伐他汀抑制高糖环境下人脐静脉血管内皮细胞内ROS的水平
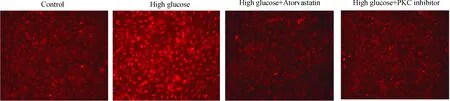
Figure 2. Effects of atorvastatin and PKC inhibitor on high glucose-induced ROS production in HUVECs.
图2阿托伐他汀和PKC抑制剂抑制高糖环境下HUVECs内ROS的水平
2阿托伐他汀呈浓度依赖性抑制NADPH氧化酶活性
不同浓度(10-8mol/L~10-6mol/L)的阿托伐他汀预处理HUVECs 1 h后,再给予高糖干预8 h,结果发现阿托伐他汀呈浓度依赖性地抑制NADPH氧化酶的活性,见图3。
3阿托伐他汀抑制高糖诱导的内皮细胞NADPH氧化酶Nox4和Nox2/gp91phox亚基的表达
阿托伐他汀呈浓度依赖性下调高糖诱导下Nox4(图4A)和Nox2/gp91phox(图4B)mRNA增加的幅度。10-7mol/L浓度阿托伐他汀干预时呈现出抑制效应, 10-6mol/L浓度阿托伐他汀的抑制作用较10-7mol/L浓度显著增强。我们采用免疫印记杂交方法进一步证实了阿托伐他汀对高糖环境下Nox4(图4C)和Nox2/gp91phox(图4D)亚基蛋白表达的抑制效应。
4PKC参与高糖诱导HUVECs产生的氧化应激反应
分别用2 μmol/L和20 μmol/L PKC抑制剂预处理HUVECs 45 min后,再进行高糖干预。PKC抑制剂呈浓度依赖性(2~20 μmol/L)地抑制高糖环境下ROS的生成(图5A)及NADPH氧化酶的活化(图5B),共聚焦显微镜检测结果显示20 μmol/L PKC可显著降低高糖环境下细胞内的ROS荧光强度(图2);同样,20 μmol/L PKC抑制剂显著抑制高糖诱导NADPH氧化酶Nox4(图5C)和Nox2/gp91phox(图5D)的表达
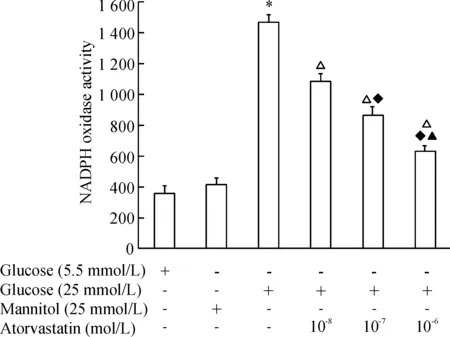
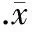
图3阿托伐他汀抑制高糖环境下人脐静脉血管内皮细胞内NADPH氧化酶活性
。
5阿托伐他汀抑制高糖诱导下PKC的活化
如图6所示,10-8mol/L~10-6mol/L阿托伐他汀预处理HUVECs 1 h后,再暴露于高糖环境15 min,发现阿托伐他汀呈浓度依赖性抑制高糖诱导的PKC的磷酸化水平。
讨 论
糖尿病患者体内具有较高的氧化应激水平,氧化应激参与血管内皮细胞病理生理变化过程的各个环节,血管内皮细胞氧化应激损伤也是动脉粥样硬化病变的基础[1]。血管内皮中氧化应激损伤主要源于线粒体电子传递链、一氧化氮合酶、NADPH氧化酶等多种途径产生的ROS,而NADPH氧化酶是内皮细胞内ROS最主要的来源[2]。NADPH氧化酶作用的发挥有赖于其在胞浆中的亚基p47phox、p40phox、p67phox与胞膜上的亚基p22phox、Nox2/gp91phox结合并形成完整的有生物活性的NADPH氧化酶复合体。催化亚基Nox2/gp91phox和调节亚基p22phox在细胞膜上形成异二聚体(即黄素细胞色素b558),位于胞浆的亚基可对其进行调节[10-11]。我们前期研究已证实Nox4、p22phox和Nox2/gp91phox亚基参与高糖环境下HUVECs内NADPH氧化酶的活化[9]。本研究中我们再次证实了高糖通过促进NADPH氧化酶的活化上调血管内皮细胞内ROS的生成,与前期结果一致。
他汀类药物是目前临床上用来控制血脂水平的一线用药,是胆固醇生物合成过程中限速酶3-羟-3-甲基戊二酰辅酶A (3-hydroxy-3-methylglutaryl coenzyme A,HMG-CoA)还原酶抑制剂,能够降低总胆固醇和低密度脂蛋白并升高高密度脂蛋白。
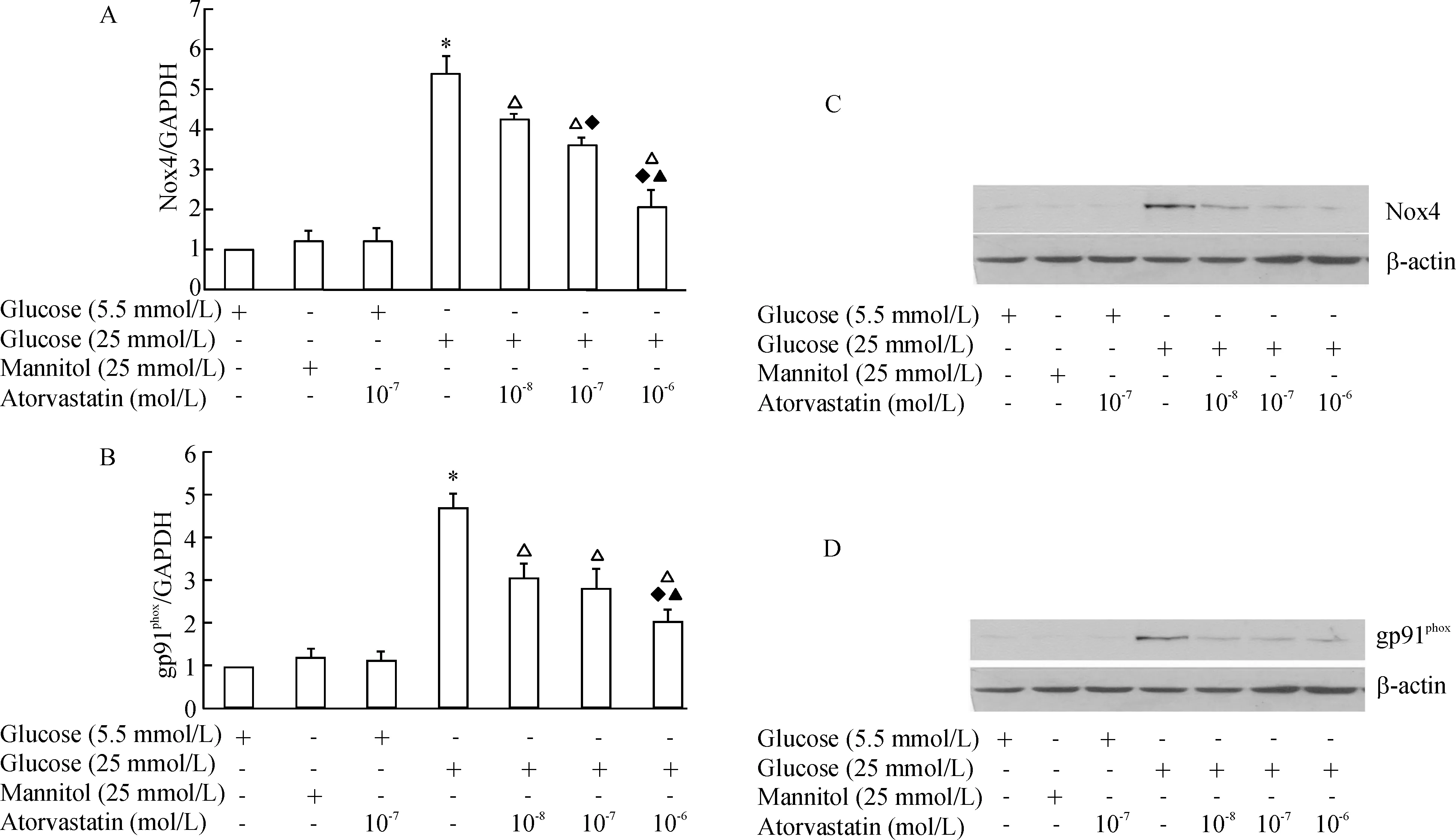

图4阿托伐他汀抑制高糖诱导下血管内皮细胞内NADPH氧化酶Nox4和Nox2/gp91phox亚基的表达
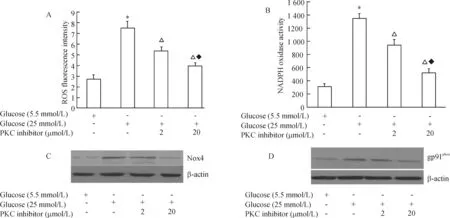

图5PKC抑制剂对高糖环境下细胞内ROS生成、NADPH氧化酶活性及NAPDH氧化酶Nox4和Nox2/gp91phox亚基表达的影响

图6阿托伐他汀抑制高糖诱导的PKC磷酸化
许多研究表明他汀具有“非降脂相关的心血管保护作用”,主要包括抗氧化应激作用、改善血管内皮功能、抗炎等作用[12-14],但其相关的分子机制依然值得探讨。本研究中,我们发现阿托伐他汀能显著下调高糖环境下Nox4和Nox2/gp91phox亚基的表达,且具有浓度依赖性,提示阿托伐他汀可对NADPH氧化酶的主要亚基进行转录或转录后的调控。阿托伐他汀对NADPH氧化酶亚基表达水平的调控效应可能是其在高糖环境下抑制NADPH氧化酶活性和下调ROS生成水平的重要机制之一。
PKC具有多种亚型,在静息状态下主要以无活性的状态存在于胞浆中,是细胞内信息传递中的重要分子。PKC受到外界刺激时通过上游信号分子的磷酸化作用使其构象改变而激活,是多条信号通路的交汇点。高浓度葡萄糖能促进血管内皮细胞内PKC的激活[2],而与之相伴的是细胞内DAG水平的上升,其机制可能与高血糖促进DAG从头合成,而激活DAG-PKC通路有关。本研究应用PKC抑制剂对HUVECs进行干预研究发现PKC参与了高浓度葡萄糖诱导的ROS的生成、NADPH氧化酶的活化以及Nox2/gp91phox和Nox4亚基的表达。因此,PKC活化是高糖环境下血管内皮细胞发生氧化应激反应的重要信号途径之一,有望成为糖尿病条件下血管内皮功能保护和动脉粥样硬化防治的重要靶点。本研究中,我们发现阿托伐他汀呈浓度依赖性地抑制高糖诱导的PKC的活化,提示对PKC的抑制作用是阿托伐他汀对抗高糖条件下血管内皮细胞氧化应激反应损伤的重要分子机制。
总之,本研究发现阿托伐他汀通过抑制高糖诱导PKC的活化实现其在高糖环境中抑制血管内皮细胞内Nox2/gp91phox和Nox4亚基的表达、抑制NADPH氧化酶活性及下调ROS生成,从而对抗高糖对血管内皮细胞产生的氧化应激损伤。
[1] Folli F, Corradi D, Fanti P, et al. The role of oxidative stress in the pathogenesis of type 2 diabetes mellitus micro-and macrovascular complications: avenues for a mechanistic-based therapeutic approach[J]. Curr Diabetes Rev, 2011,7(5):313-324.
[2] Gorlach A,Brandes RP, Nguyen K, et al. A gp91phoxcontaining NADPH oxidase selectively expressed in endothelial cells is a major source of oxygen radical generation in the arterial wall [J]. Circ Res,2000, 87(1):26-32.
[3] Inoguchi T, Sonta T, Tsubouchi H, et al. Protein kinase C-dependent increase in reactive oxygen species (ROS) production in vascular tissues of diabetes: role of vascular NAD(P)H oxidase[J]. Am Soc Nephrol,2003, 14 (8 Suppl 3):S227- S232.
[4] Hink U, Li H, Mollnau H, et al. Mechanisms underlying endothelial dysfunction in diabetes mellitus[J]. Circ Res,2001,88(2):E14-E22.
[5] Haendeler J, Hoffmann J, Zeiher AM, et al. Antioxidant effects of statins viaS-nitrosylation and activation of thioredoxin in endothelial cells: a novel vasculoprotective function of statins[J]. Circulation,2004,110(7): 856-861.
[6] Thomas SR,Witting PK,Drummond GR. Redox control of endothelial function and dysfunction:molecular mechanisms and therapeutic opportunities[J]. Antioxid Redox Signal,2008,10(10): 1713-1765.
[7] Jaffe EA, Nochman RL, Becker CG, et al. Culture of human endothelial cells from umbilical veins: identification by morphologic and immunologic criteria[J]. J Clin Invest,1973, 52(11): 2745-2758.
[8] Egashira K, Inoue S, Ni W, et al. Anti-monocyte chemoattractant protein-l gene therapy limits progression and destabilization of established athemslemsis in apolipoprotein E-knockout mice[J]. Circulation,2002,106(21): 2700-2706.
[9] Chai D, Wang B, Shen L, et al. RXR agonists inhibit high-glucose-induced oxidative stress by repressing PKC activity in human endothelial cells[J]. Free Radic Biol Med,2008,44(7):1334-1347.
[10]Hordijk PL. Regulation of NADPH oxidases: the role of Rac proteins[J]. Circ Res,2006,98(4): 453-462.
[11]Takeya R, Sumimoto H. Regulation of novel superoxide-producing NAD(P)H oxidases[J]. Antioxid Redox Signal,2006,8(9-10): 1523-1532.
[12]Takemoto M,Liao JK. Pleiotropic effects of 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors[J]. Arterioscler Thromb Vasc Biol,2001, 21(11): 1712-1719.
[13]Wagner AH, Kohler T, Ruckschloss U, et al. Improvement of nitric oxide-dependent vasodilation by HMG-CoA reductase inhibitors through attenuation of endothelial superoxide anion formation[J]. Arterioscler Thromb Vasc Biol,2000,20(1): 61-69.
[14]洪 华, 曾进胜, 王 莹,等.阿托伐他汀对大鼠缺血再灌注脑组织中NADPH氧化酶源性超氧阴离子的抑制作用[J]. 中国病理生理杂志,2008,24(7): 1345- 1350.
Atorvastatininhibitshighglucose-inducedoxidativestressbydepressingPKCactivityinhumanumbilicalveinendothelialcells
CHAI Da-jun, NING Ruo-bing, ZHU Jiang, XU Chang-sheng, XIE Hong, LIN Jin-xiu
(DepartmentofCardiology,theFirstAffiliatedHospitalofFujianMedicalUniversity,FujianHypertensionInstitute,Fuzhou350005,China.E-mail:caidajun@medmail.com.cn)
AIM: To explore the effect of atorvastatin on high glucose-induced oxidative stress and underlying mechanisms in human endothelial cells.METHODSHuman umbilical vein endothelial cells (HUVECs) were cultured in medium 199 containing normal concentration of glucose (5.5 mmol/L). For high glucose treatment, glucose solution was added to the final concentration of 25 mmol/L. Reactive oxygen species (ROS) were detected by flow cytometry and confocal microscopy. The activity of nicotinamide adenine dinucleotide phosphate (NADPH) oxidase was measured by lucigenin assay. Phosphorylated protein kinase C (PKC) and the expression levels of NADPH oxidase subunits Nox4 and Nox2/gp91phoxwere determined by quantitative real-time PCR and immunoblotting.RESULTSHigh glucose increased ROS production, NADPH oxidase activity and the expression of Nox4 and Nox2/gp91phoxsubunits. Treatment of endothelial cells with atorvastatin resulted in significant inhibition (in a concentration-dependent manner) of high glucose-induced ROS production, NADPH oxidase activation and the expression of Nox4 and Nox2/gp91phoxsubunits. PKC inhibitor showed a similar effect to that of atorvastatin on high glucose-induced oxidative stress. Furthermore, atorvastatin rapidly inhibited high glucose-induced activation of protein kinase C, an upstream activator of NADPH oxidase.CONCLUSIONPKC is involved in high glucose-induced oxidative stress in HUVECs. Atorvastatin inhibits high glucose-induced oxidative stress by depressing PKC activity in human endothelial cells.
High glucose; Oxidative stress; Statins; Protein kinase C
R543
A
10.3969/j.issn.1000-4718.2012.09.001
