直肠内应用吲哚美辛预防ERCP术后胰腺炎的Meta分析
2012-11-06孙江阳刘光磊袁玉峰刘志苏
孙江阳 刘光磊 袁玉峰 刘志苏
直肠内应用吲哚美辛预防ERCP术后胰腺炎的Meta分析
孙江阳 刘光磊 袁玉峰 刘志苏
内镜下逆行胰胆管造影术(ERCP)是胰胆管疾病重要的诊断和治疗方法,尤其是治疗性ERCP在胰胆管微创治疗中占有重要的地位。但行ERCP检查或治疗后会出现急性胰腺炎、出血及穿孔等并发症[1]。随着ERCP技术的改进,相关并发症有一定减少,但ERCP术后胰腺炎(post-ERCP pancreatitis, PEP)的发生率却无明显降低[2]。近年,国内外相关文献报道称非甾体类抗炎药(NASIDs)之一的吲哚美辛(indomethacin)在PEP的预防中有积极的作用[3-4],但亦有相反的结论[5]。为此,本研究对相关文献进行了荟萃分析,评价直肠内应用吲哚美辛预防PEP和高淀粉酶血症的有效性和安全性,以期为临床实践提供循证医学支持。
一、资料与方法
1.文献纳入及排除标准:同时满足以下条件的文献被纳入本研究:(1)分组设计上采用随机对照的原则(RCT);(2)试验组采用吲哚美辛干预,对照组采用无临床疗效的安慰剂;(3)ERCP术后开始出现腹痛、恶心、呕吐等症状并持续至少24 h,血清淀粉酶高于正常上限3倍以上(或有影像学支持)。包含以下情况的文献排除在外:(1)非随机对照临床试验(非RCT);(2)使用其他非甾体类抗炎药物。
2.疗效判定指标:主要指标为预防性使用吲哚美辛后患者的PEP和高淀粉酶血症的发生率、胰腺炎病情程度;次要指标为吲哚美辛相关并发症(或不良反应)。
3.检索策略及文献质量评价:电子检索PubMed、EBSCO、EMBASE、Springer、CSA、Cochrane图书馆及CNKI从建库至2012年6月的所有文献及纳入文献的参考文献。英文检索词:indomethacin,post-ERCP pancreatitis,randomized controlled trial;中文检索词:吲哚美辛,ERCP,胰腺炎。
采用Cochrane协作网推荐的关于RCT的质量评价标准(Cochrane Handbook for Systematic Reviews of Interventions 4.2.8)。评价条目包括:随机方法是否正确;是否隐蔽分组;是否实施盲法;是否报告失访和退出;基线是否可比。若所有评价标准均完全满足,则该研究存在偏倚的可能性最小,文献为A级;如果其中一条或多条质量评价标准仅为部分满足,则该研究存在相应偏倚的可能,为B级;如果其中任何一条或多条质量评价标准完全不满足,则该研究存在偏倚的可能性为高度,为C级。
由两位研究者独立进行文献质量评价并按设计好的表格提取资料,如遇分歧,通过讨论或依据另两位研究人员意见协商解决。
4.统计学处理:采用RevMan5.0分析软件对资料进行定量综合(Peto模型)。计数资料选取比值比(odds ratio,OR)及其95%CI,计量资料使用加权均数差(WMD)及其95%CI。合并分析前先进行异质性检验,如纳入研究各组资料无明显异质性(P>0.01,I2≤50%)则选择固定模型分析;异质性较大(P<0.01,I2>50%)则尽可能找出异质性来源并进行亚组分析和敏感性分析。如无法找出异质性来源则选择随机模型分析,并进行敏感性分析。若荟萃分析结果显示试验组与对照组的发病率具有统计学差异时(P<0.05),计算需治疗的患者数(number needed to treat,NNT),NNT=1/归因危险度(rate difference,RD)。发表偏倚的识别采用漏斗图分析、秩相关检验和线性回归法。若临床试验提供的数据不能进行荟萃分析时,则只对其进行描述性的定性分析。
二、结果
1.临床试验特征及文献质量评价:最初筛选出符合纳入标准的文献共8[3-10]篇,排除其中重复的1篇[6-7]及非直肠内用药的1篇[5],最终纳入6篇文献进行评价。文献发表时间2007年至2012年,其中国外文献3篇、国内文献3篇,纳入文献在年龄、性别、ERCP术前病史等方面基线一致。其中有2篇文献提及了具体随机的方法,有2个试验采用了双盲,2个试验对随机方案进行了充分的隐藏。3个试验采用了ITT分析。6个试验中,4个试验质量等级为B,2个为A。
2.术后PEP的发生率及给药时间对PEP的影响:6篇文献共报道1818例患者直肠内应用吲哚美辛预防ERCP术后胰腺炎和高淀粉酶血症的临床效果和安全性(表1)。
荟萃分析示各试验间异质性无统计学意义(P=0.90,I2=0%),故采用固定效应模型进行分析。结果显示,吲哚美辛干预组PEP的发生率为5.71%,对照组为12.33%(图1),两组差异有统计学意义[OR=0.45,95%CI(0.32,0.62),P<0.00001],其NNT=15。
由于各纳入试验用药时间不完全一致,故按照纳入文献的用药时间分为术前30 min、术前120 min以及术后30 min分别进行分析(图2)。术前30 min组和术后30 min组内各试验间无明显异质性差异(P=0.64,I2=0;P=0.61,I2=0),采用固定效应模型分析,结果表明两组差异具有统计学意义[OR=0.43,95%CI(0.24,0.77);OR=0.48,95%CI(0.31,0.73)]。而术前120 min组只有一篇文献,其结果中的试验组与对照组差异有统计学意义(P=0.03)。
3.术后高淀粉酶血症的发生率:有3篇文献报道了ERCP术后高淀粉酶血症的发生情况。荟萃分析示各试验间无明显异质性差异(P=0.17,I2=43%),故采用固定效应模型进行分析。结果表明吲哚美辛组术后高淀粉酶血症发生率为13.24%,对照组为23.93%(图3),两组差异具有统计学意义[OR=0.49,95%CI(0.33,0.73),P=0.0005]。

表1 纳入研究的文献结果

图1 6篇RCT文献结果合并后吲哚美辛组与安慰剂组的PEP发生率
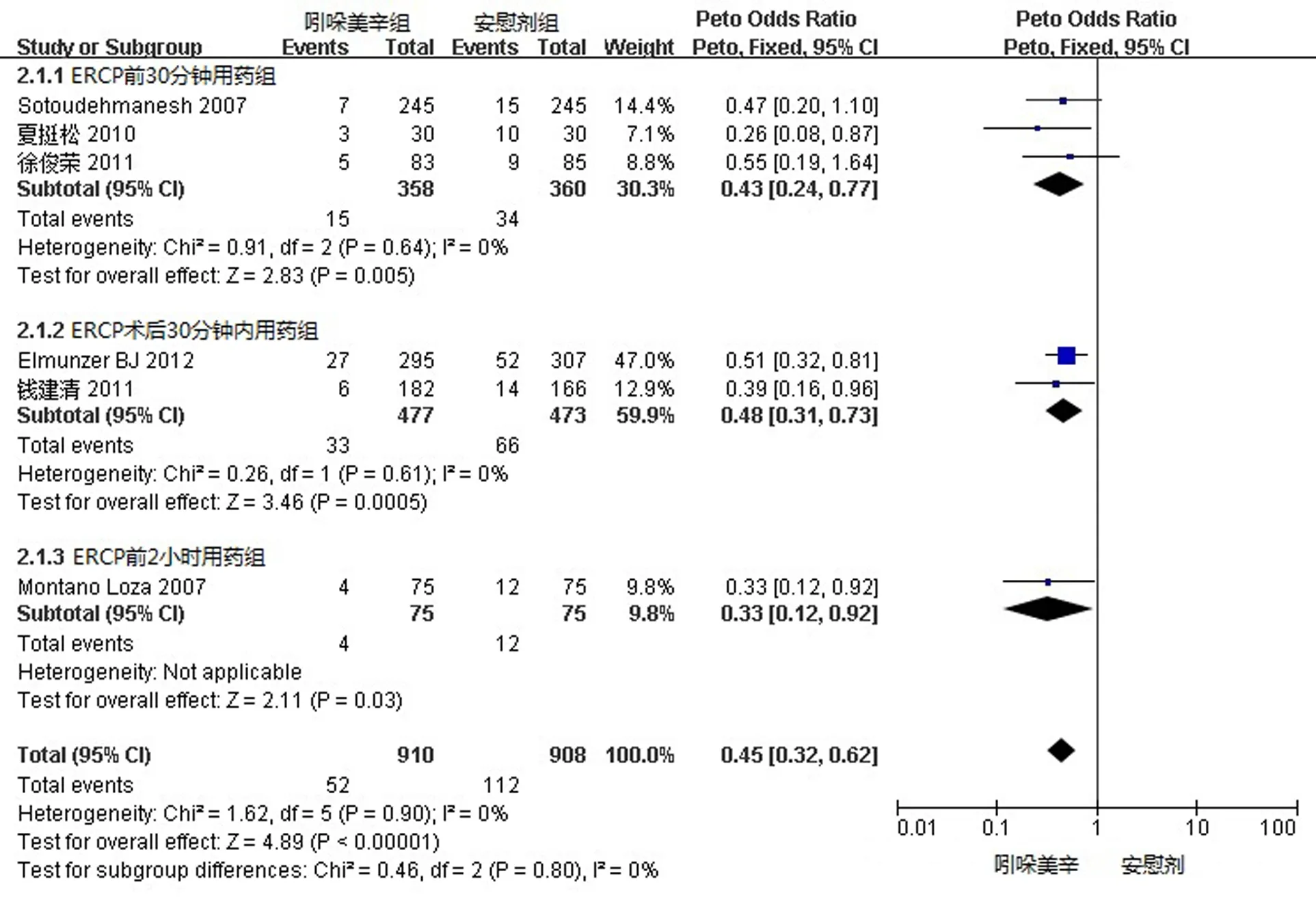
图2 不同用药时间的吲哚美辛组与安慰剂组PEP发生率

图3 3篇RCT文献结果合并后吲哚美辛组与安慰剂组ERCP术后高淀粉酶血症的发病率
4.重症PEP及病死率:仅2篇文献列出重症PEP的病例数,共7例,全试验组3例,对照组4例;所有文献中均无病死患者。因资料偏少,不宜进一步分析。
5.药物的不良反应:Elmunzer等试验虽然报道试验组有4例发生胃肠道出血,但并未确定是否由于应用吲哚美辛所致。另5篇均未报道与吲哚美辛直接相关的不良反应出现。但由于纳入的临床试验病例数量有限,一些试验排除了对NASIDs药物有过敏史的患者,且相关的胃肠道不良反应可能与PEP的症状重合等因素,应慎重对待该结果。
6.敏感性分析:比较固定效应模型和随机效应模型的荟萃分析结果显示随机效应模型估计出合并OR值为0.43,95%CI(0.31,0.61),与固定效应模型结果基本一致;剔除1篇文献样本量较少(30例/30例)后再行荟萃分析,合并的OR值为0.45,95%CI(0.32,0.65),和剔除前结果接近。
7.发表性偏倚分析:以6个试验预防PEP有效率的OR值为横坐标,以OR值的倒数为纵坐标绘制漏斗图,近似呈倒漏斗状(图4),Begg秩相关检验所得P=0.06,Egger线性回归法所得P=0.082,均提示无明显发表偏倚,表明本研究可忽视发表偏倚的影响。

图4 纳入文献的漏斗图分析
讨论ERCP属于有创性的检查和治疗方法, PEP是最为常见也最严重的并发症之一,其发病机制尚不完全清楚,且导致PEP的危险因素众多。Freeman等[11]曾报道,年轻、女性、Oddi括约肌功能障碍(SOD)、ERCP术后胰腺炎病史等因素与PEP发生密切相关,而胆管结石、血清胆红素、胰管活检等与之可能相关[12-13]。多年来,对各种药物预防PEP进行了研究,但总体效果并不理想[2-14]。目前最广泛应用的是抑制胰酶分泌的生长抑素及其类似物奥曲肽,对PEP都具有抗炎症介质及细胞保护作用[15-16],但对其预防PEP的效果还存在争议[2]。Andriulli等[17]的荟萃分析结果显示,生长抑素能有效预防PEP及高淀粉酶血症的发生,但短期用药是无效的,且此类药物常规预防性应用会增加患者的经济负担。1997年,Mäkelä等[18]首次报道NSAIDs能有效抑制重症胰腺炎患者血清的磷脂酶A2(PLA2)活性及中性粒细胞、内皮细胞的附着,抑制伴随中性粒细胞的一系列炎症级联反应。此后,部分学者开始探讨NSAIDs用于预防PEP的可行性。Elmunzer等[19]及Dai等[20]分别发表了关于应用NSAIDs预防PEP的荟萃分析,结果显示其用于预防PEP是值得临床推荐的,但他们并没有对具体的某一种药物疗效进行分析。本荟萃分析结果显示,直肠内应用吲哚美辛对预防PEP和ERCP术后高淀粉酶血症有较好效应,且未见明确报道与吲哚美辛相关的药物不良反应,提示用其预防PEP是比较安全的。
虽然本分析所搜集文献的发表性偏倚控制尚可,具有一定可信度,但也不排除有阴性结果未得以发表的可能性。此外,本次纳入试验的用药时间并不一致,且有4个试验未报告具体的随机方法和分配方案的隐蔽方式,1个试验所选对象全为胆管结石行ERCP+十二指肠乳头括约肌切开(EST)的患者,这些因素可能导致结果的选择性偏倚。由于缺乏高质量的RCT证据支持,其真实疗效和安全性还有待于设计更严格的多中心、大样本随机对照试验进一步证实。另有研究报道口服吲哚美辛致胰腺炎的报道[21-22],故其不良反应仍应受到同样重视。
[1] Zinsser E, Hoffmann A, Will U, et al. Success and complication rates of diagnostic and therapeutic endoscopic retrograde cholangiopancreatography-a prospective study. Z Gastroenterol, 1999,37:707-713.
[2] Arata S, Takada T, Hirata K, et al. Post-ERCP pancreatitis. J Hepatobiliary Pancreatic,2010,17:70-78.
[3] Sotoudehmanesh R, Khatibian M, Kolahdoozan S, et al. Indomethacin may reduce the incidence and severity of acute pancreatitis after ERCP. Am J Gastroenterol, 2007,102:978-983.
[4] 夏挺松, 刘鹏飞. 直肠非甾体类抗炎药对ERCP术后胰腺炎的预防作用.中华消化内镜杂志,2010,27: 301-302.
[5] Elmi F, Rossi F, Lim JK, et al. A prospective, multicenter, randomized, double blinded controlled study to determine whether a single dose of intraduodenal indomethacin can decrease the incidence and severity of post-ERCP pancreatitis. Gastrointestinal Endoscopy, 2010,71:AB232.
[8] 徐俊荣, 楚有良, 韩坤,等.吲哚美辛在预防ERCP术后胰腺炎中作用的研究.胃肠病学和肝病学杂志,2011,20: 858-860.
[9] 钱建清, 戴建军, 王卫军,等. 吲哚美辛对内镜下逆行性胰胆管造影术后胰腺炎的预防.中华胰腺病杂志, 2011, 11: 326-328.
[10] Elmunzer BJ, Scheiman JM, Lehman GA, et al. A randomized trial of rectal indomethacin to prevent post-ERCP pancreatitis. N Engl J Med, 2012,366:1414-1422.
[11] Freeman ML, Guda NM. Prevention of post-ERCP pancreatitis: a comprehensive review. Gastrointestinal endoscopy, 2004,59:845-864.
[12] Rodriguez Munoz S. Towards safer ERCP: selection, experience and prophylaxis. Rev Esp Enterm Dig,2004,96:155-162.
[13] Masci E, Toti G, Mariani A, et al. Complications of diagnostic and therapeutic ERCP: a prospective multicenter study. Am J Gastroenterol,2001,96:417-423.
[14] Testoni PA.Preventing post-ERCP pancreatitis: where are we? JOP, 2003,4:22-32.
[15] Rudin D, Kiss A, Wetz RV, et al. Somatostatin and gabexate for post-endoscopic retrograde cholangiopancreatography pancreatitis prevention: meta-analysis of randomized placebo-controlled trials. J Gastroenterol Hepatol, 2007,22:977-983.
[16] Bai Y, Gao J, Shi X, et al. Prophylactic corticosteroids do not prevent post-ERCP pancreatitis: a meta-analysis of randomized controlled trials. Pancreatology,2008,8:504-509.
[17] Andriulli A, Leandro G, Federici T, et al. Prophylactic administration of somatostatin or gabexate does not prevent pancreatitis after ERCP: an updated meta-analysis. Gastrointest Endosc,2007,65:624-632.
[18] Mäkelä A, Kuusi T, Schroder T. Inhibition of serum phospholipase-A2 in acute pancreatitis by pharmacological agents in vitro. Scand J Clin Lab Invest,1997,57:401-407.
[19] Elmunzer BJ, Waljee AK, Elta GH, et al. A meta-analysis of rectal NSAIDs in the prevention of post-ERCP pancreatitis. Gut, 2008,57:1262-1267.
[20] Dai HF, Wang XW, Zhao K. Role of nonsteroidal anti-inflammatory drugs in the prevention of post-ERCP pancreatitis: a meta-analysis. Hepatobiliary Pancrea Dis Int,2009,8:11-16.
[21] Memis D, Akalin E, Yücel T. Indomethacin-induced pancreatitis: a case report. JOP,2005,6:344-347.
[22] Mahjoub W, Jarboui S, Ben Moussa M, et al. Indomethacin-induced pancreatitis. A second case report. JOP, 2006,7:321-323.
10.3760/cma.j.issn.1674-1935.2012.06.011
中央高校基本科研业务费专项基金
430071 武汉,武汉大学中南医院普外科(孙江阳、袁玉峰、刘志苏),信息中心(刘光磊)
刘志苏,Emial:liuzhisu53@163.com
2012-06-28)
(本文编辑:屠振兴)
