炙升麻与几种升麻属植物抗氧化活性研究
2012-11-03艾德华J肯耐利
姜 北,张 杰,周 浓,艾德华J.肯耐利
(1.大理学院药学与化学学院,云南大理 671000;2.纽约市立大学莱曼学院生命科学系,美国纽约NY10468)
炙升麻与几种升麻属植物抗氧化活性研究
姜 北1,张 杰1,周 浓1,艾德华J.肯耐利2
(1.大理学院药学与化学学院,云南大理 671000;2.纽约市立大学莱曼学院生命科学系,美国纽约NY10468)
目的:了解常见升麻属植物抗氧化活性,探讨中药材升麻炮制过程中酚酸类成分与抗氧化活性的变化。方法:采用DPPH法与HPLC法对8种亚洲、北美洲升麻属植物共计26个样品进行抗氧化活性与酚酸类成分分析,以了解氧化活性与酚酸类成分之间的关系。结果:绝大部分样品IC50>150 μg·mL-1;炙升麻在炮制过程中酚酸类成分会发生变化,且工艺流程对结果影响很大,抗氧化活性也会受到进一步影响。结论:升麻属植物样品总体上抗氧化活性不高;中药材升麻植物来源具有多样性,不同的样品间在抗氧化活性方面存在较大差异;炙升麻在炮制过程中酚酸类成分会发生改变,从而导致其抗氧化活性与原植物相比发生较大变化,是否影响升麻的药性与药效值得进一步研究。
升麻属植物;炙升麻;抗氧化活性;DPPH;酚酸类成分
升麻(Actaea cimicifuga或Cimicifuga foetida)为毛茛科升麻属植物,为一常见市售中药;药用根茎,具有清热解毒、升举阳气、发表透疹的功效,主治风热头痛、齿痛、口疮、咽喉痛、子宫脱垂等症〔1〕。目前市面上销售的升麻药材主要有生升麻与炙升麻两种,炙升麻又可分为蜜制、酒制以及升麻炭等〔2〕。据中国药典,中药升麻可以来源于三种近缘植物:升麻(A.cimicifuga)、兴安升麻(A.dahurica)、大三叶升麻(A.heracleifolia)〔1〕。升麻属共有28种植物,主要分布在亚洲与北美洲〔3-4〕。除上述三种升麻属植物外,在中国较为常见的种类还有野升麻(单穗升麻,A.simplex)、小升麻(A.acerina)等;在北美洲分布有8个种,常见的有A.cordifolia;A.pachypoda;A. rubra;A.racemosa(总状升麻),其中总状升麻(也叫black cohosh)分布、使用最为广泛,研究报道很多,近年来已成为美国十大畅销植物药〔5〕。
升麻属植物主要含有三萜苷类、酚酸类等化学成分〔6〕,其中部分植物酚酸类成分含量高达3%左右〔7〕,因此,酚酸类化合物是该属植物的重要活性成分〔8〕。由于酚酸类成分多具有良好的抗氧化作用〔9-10〕,因此,本研究采用DPPH法,对8种常见的升麻属植物以及中药材炙升麻的抗氧化活性、主要酚酸类成分含量等进行了研究,以了解该属植物抗氧化活性基本情况以及炮制过程对于酚酸类化合物与抗氧化活性的影响,为合理利用升麻属植物提供科学依据。
1 仪器与材料
1.1 化学试剂 标准品:咖啡酸(caffeic acid,1)与阿魏酸(ferulic acid,2)(Sigma Chemical Co.,St. Louis,USA);蜂斗菜酸(fukinolic acid,3,纯度95.90%)与升麻酸A(cimicifugic acidA,4,纯度96.95%)由black cohosh分离得到〔7〕。甲醇(天津市化学试剂三厂,批号050412),95%乙醇(天津市风船试剂科技有限公司,批号080114),1,1-二苯基-2-三硝基苯肼(DPPH,Aldrich Chem Co,USA),甲酸(上海市三浦化工有限公司),乙腈(HPLC专用,Fisher Scientific,USA),二甲亚砜(DMSO,金山化工沪Q/ HG22-589-97),蜂蜜(云南省云龙县云蜂蜂业,生产日期2007/12)。
1.2 实验仪器 连续波长酶标仪(BIO-TEX,PowerwaveXS),高效液相色谱仪(Agilent 1100)附带G1315A/B DAD检测器,远红外循环式烘箱(SWY-3),电子天平(Mettler Toledo AL204),隔水式恒温培养箱,微量加样器(Eppendorf Research)。
1.3 植物样品 升麻(A.cimicifuga)(SHM-1、SHM-2)分别由云南大理苍山东、西坡采集得到,由大理学院药学院马晓匡教授鉴定,样品SHM-1r系SHM-1的须根部分;升麻样品SHM-3~5由大理市三家中药店购得;样品A.simplex(SIM-1)、A.mairei(MAI-1)采自云南昆明地区,为人工种植品种;A. cordifolia(COR-1)、A.pachypoda(PYD-1)、A.rubra(RUB-1)、A.arizonica(ARI-1)、A.racemosa(RAC-1)分别采自美国纽约地区及西部地区,由纽约植物园Timothy J.Motley博士鉴定;商品炙升麻样品(ZSHM-1~9)由大理市多家中药店购得,制作方法不明;样品(SHM-2-Z1~3)为自制炙升麻。
2 实验方法
2.1 炙升麻样品的制备 取升麻(SHM-2)切片50 g置入蒸发皿中翻炒至样品外部呈焦黑色,内部黄褐色,无烟后取出得炙升麻样品SHM-2-Z1;炙升麻样品SHM-2-Z2由生升麻SHM-2(50 g)加蜂蜜(12.5 g)文火翻炒至不沾手后制得;样品SHM-2-Z3则由生升麻SHM-2(50 g)加蜂蜜(12.5 g)于100℃下恒温烘烤至干而成。
2.2 样品提取 分别称取样品10 g,粉碎后用100 mL 80%甲醇室温下浸取,共4次,每次时间为24 h;合并提取液,在45℃下浓缩至干,称重,计算提取率。
2.3 DPPH实验 精确称量样品提取物10 mg左右,溶解在2 mL DMSO中,之后用DMSO按1∶3、1∶1、1∶1、1∶1的比例稀释。以DMSO、维生素C分别作为对照,在96孔板上用50 μL供试品与150 μL DPPH(400 mmol μL-1)液混合,放入37℃的恒温培养箱中30 min,之后用酶标仪于515 nm处测定OD值;数据按以下公式处理得到抑制率(%In),最后计算出供试品的IC50数值(C空白的吸收值,S净吸收值):

2.4 HPLC分析 样品8~10 mg用2 mL 70%甲醇超声溶解,0.45 μm滤膜过滤。ALTEX Ultrasphere-ODS(4.6×250 mm,5 μm)分析柱,乙腈(A)/5%甲酸水溶液(B)为洗脱剂,洗脱条件为0~15 min将A由5%增至15%,保持5 min后在20~50 min由15%增至50%,50~55 min增至100%;流速1.0 mL/min,柱温30℃,进样量10 μL,检测波长为320 nm。该分析方法的稳定性与可靠性等已在我们以前的研究中予以报道〔11〕。
3 实验结果
3.1 样品的抗氧化活性 各样品抗氧化活性实验结果见表1。根据DPPH试验评判原则,当样品的IC50>150 μg·mL-1时抗氧化活性微弱,当样品的IC50>200 μg·mL-1时则无抗氧化活性,因此,本研究中绝大部分供试样品无显著抗氧化活性,仅有第20、24号样品具有较好的抗氧化活性;而第2、11、19、23号样品有一定的抗氧化活性。
3.2 高效液相色谱分析 实验中选择了部分炙升麻样品进行了HPLC分析,结果见表2。自制炙升麻样品的HPLC分析结果如图1所示。根据紫外谱图特征(图2),样品中所含酚性成分类型可以分成两类:酚酸类衍生物(化合物1~4)与色原酮类化合物(化合物a与b)。由于许多酚酸类衍生物为升麻属植物特有,因此,实验中我们选择了4个此类成分作定量研究(表2),其余样品的酚酸类成分含量状况在我们之前进行的研究中已有报道〔7,12〕。
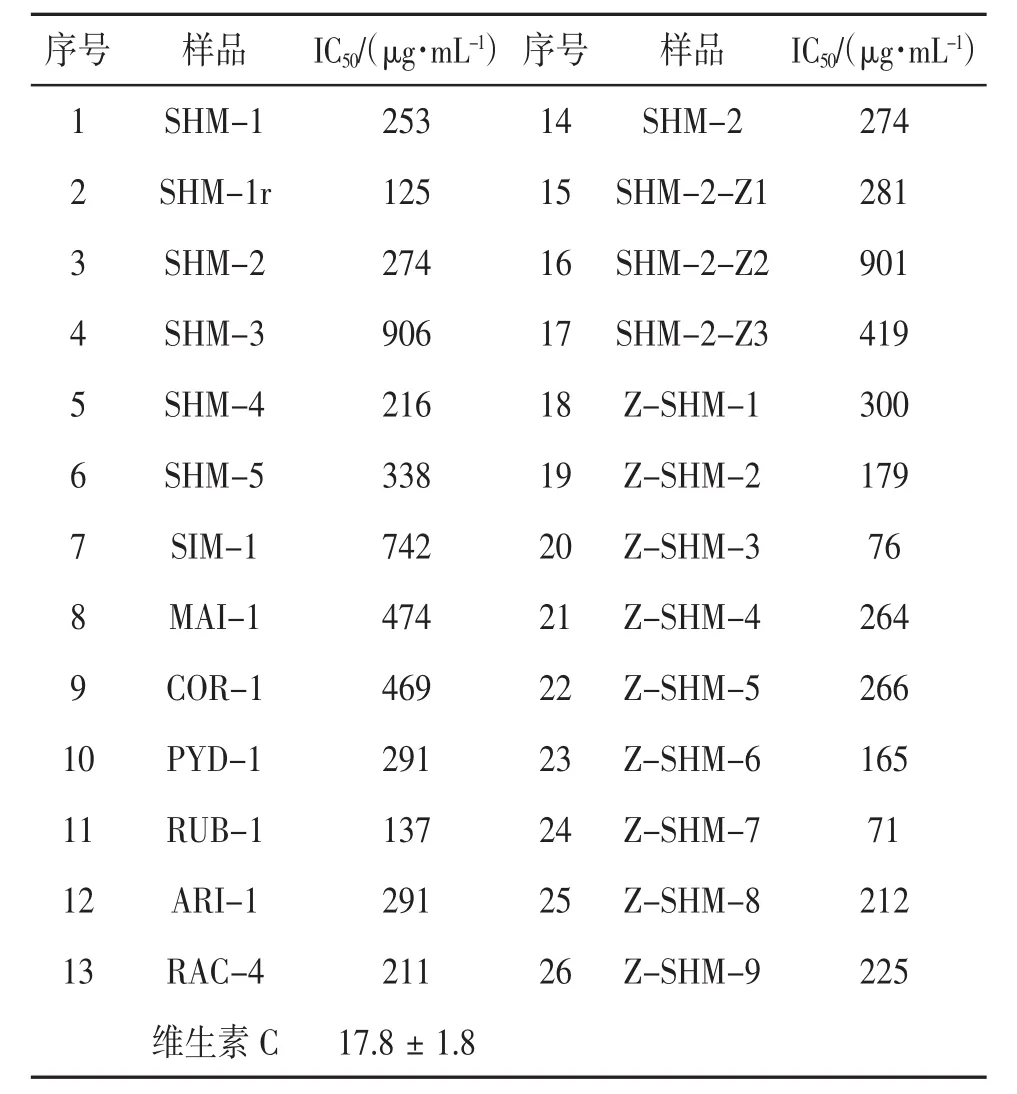
表1 样品抗氧化活性实验结果
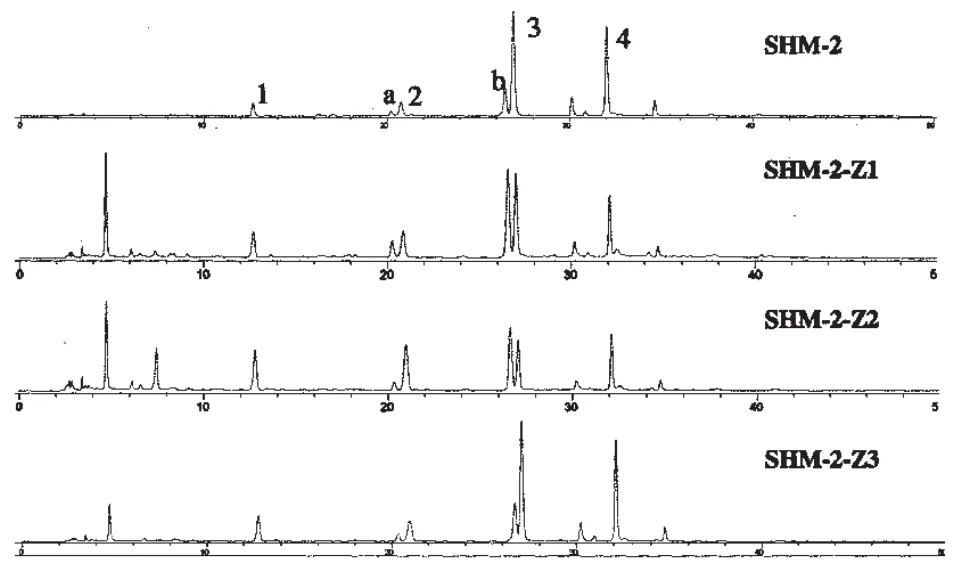
图1 生升麻(SHM-2)与炙升麻(SHM-2-Z1~3)HPLC谱图(320 nm)
从图1可知,生升麻(SHM-2)经高温加工处理成炙升麻(SHM-2-Z1与SHM-2-Z2)后,其成分有较大改变,化合物3与4有明显分解,同时在4~10 min处有新成分出现,说明温度对升麻属植物酚酸类成分有较大影响。与此同时,炙升麻(SHM-2-Z3)与生升麻(SHM-2)相比酚酸类成分构成相似,显示较低温度下(100℃)加工样品时其酚酸类成分可基本保持稳定,表2中的有关数据可进一步证实这一论点。
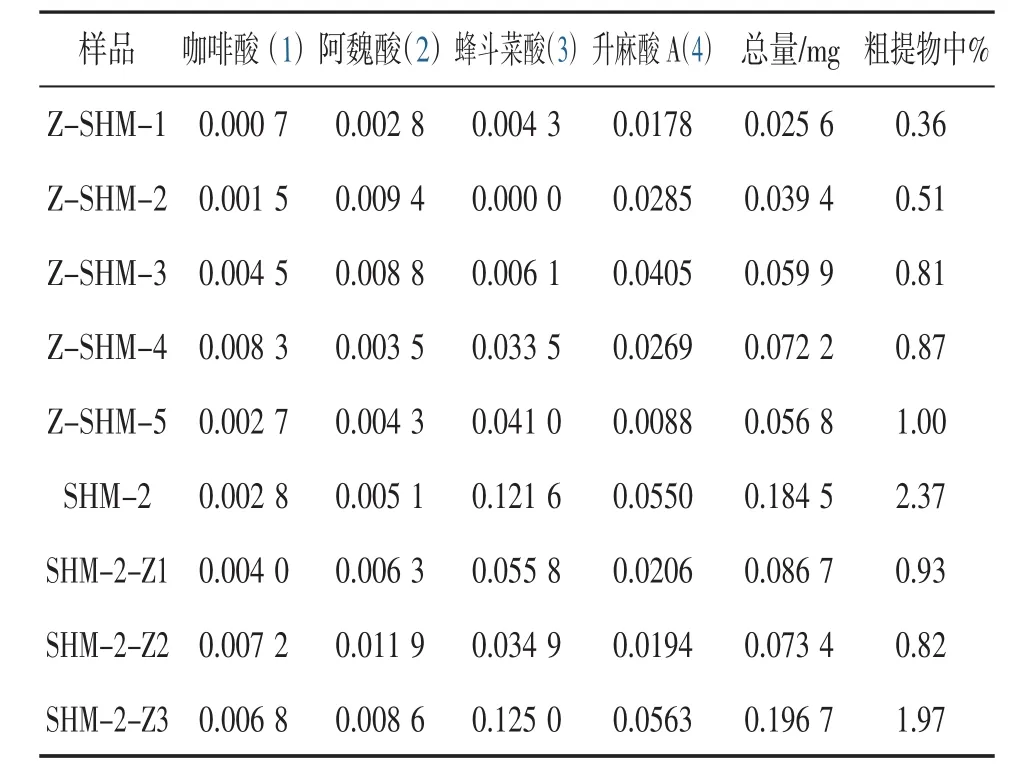
表2 部分样品主要酚酸类成分含量
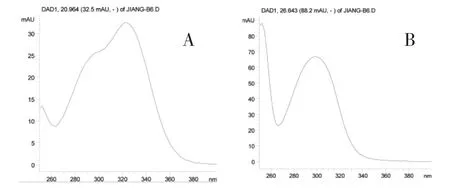
图2 酚酸类衍生物(A)与色原酮(B)的紫外谱图
4 讨论
升麻属植物均含有酚酸类成分,但提取物抗氧化活性总体偏弱,仅有升麻样品SHM-1r与美洲升麻属植物Actaea rubra(RUB-1)显示出一定程度的抗氧化活性(见表1),后者与已发表的研究结果基本吻合〔7〕。究其原因,除植物种类差异是重要原因外,还应与根茎提取物中多糖类等非抗氧化成分比例较高有关。例如,同样的植物样品其根茎提取物(SHM-1)基本上无抗氧化活性(IC50=253 μg·mL-1),但根(即根茎周围的须根)提取物(SHM-1r)却显示出一定的抗氧化活性(IC50=125 μg·mL-1),而后者的提取率较前者低很多。
另外,多数样品的抗氧化活性不高,还可能与样品加工、储存不当造成部分酚酸性成分被破坏有关。研究表明,升麻属植物的主要酚酸性成分抗氧化活性很强,但不稳定〔11〕。因此,在植物样品加工、干燥、储存过程中均可能导致其分解破坏而使抗氧化活性下降。潘瑞乐等人也曾对升麻炮制前后有效成分进行了研究比较,升麻切制和蜜制以后,阿魏酸和异阿魏酸含量均有所增高,且蜜制片比切片含量增加更多。并认为升麻酚酸类化合物多以酸酯的形式存在,可能在炮制过程中,其酸酯类成分水解生成有机酸和醇类,使阿魏酸和异阿魏酸含量增加〔13〕。我们的研究结果充分证实了这一结论,因为加热、尤其是有水分存在的条件下蜂斗菜酸(3)、升麻酸A(4)与升麻酸B等成分很容易分解,产生咖啡酸(1)、阿魏酸(2)、异阿魏酸及其它一些成分〔11〕。
炙升麻样品抗氧化活性普遍较生升麻为好,其中有四个还显示出较强的抗氧化活性,这也许与添加成分有关。在模拟炙升麻的过程中我们发现,传统工艺在升麻炒制、蜜制时很难严格控制炮制温度。由于温度对于升麻植物中酚酸性成分的稳定性影响很大,因此,炙升麻的产品质量难以严格控制。当我们将升麻炮制程序改为一定温度、时间下烘制时,产品在化学成分方面基本保持了原植物特性,但是否符合传统中医、中药用药理论与规范,尚有待进一步研究。由提取率来看,生升麻SHM-2的提取率为15.1%,而三个炙升麻样品SHM-2-Z1~3的提取率分别为15.4、24.5、27.1%,显然蜜炙升麻提取物中含有较多的外加成分,同时,100℃恒温下烘制的蜜炙升麻比炒制的蜜炙升麻温度要低一些,从而使酚酸性成分破坏较少。但由于添加成分含量高,造成了近乎一倍的稀释效应,因而抗氧化活性受到较大影响。
HPLC分析结果显示市场上销售中药材升麻,不论是生升麻还是炙升麻,其酚酸性化学成分差异都很大,确切原因尚无法推知。可能的因素包括产地与收获季节不同、植物品种差异、加工工艺不同等诸多因素,因此,在实际应用过程中需密切注意由此可能导致的药材品性方面存在的差异。
〔1〕国家药典委员会.中华人民共和国药典〔S〕.一部.北京:化学工业出版社,2005:50.
〔2〕国家中医药管理局《中华本草》编委会.中华本草:下卷〔M〕.上海:上海科学技术出版社,1999:175.
〔3〕Compton JA,Culham A,Jury SL.Reclassification of Actaea to include Cimicifuga and Souliea(Ranunculaceae):phylogeny inferred from morphology,nrDNA,ITS,and cpDNA trnL-F sequence variation〔J〕.Taxon,1998,47: 593.
〔4〕中国科学院中国植物志编辑委员会.中国植物志:27卷〔M〕.北京:科学出版社,1979:94.
〔5〕Cavaliere C,Rea P,Lynch ME,et al.Herbal supplement sales experience slight increase in 2008〔J〕.HerbalGram,2009,82:58.
〔6〕林玉萍,秋明华,李忠荣,等.升麻属植物的化学成分与生物活性研究〔J〕.天然产物研究与开发,2002,6(14):58.
〔7〕Nuntanakorn P,Jiang B,Yang H,et al.Analysis of polyphenolic compounds and radical scavenging activity of four American Actaea species〔J〕.Phytochem Anal,2007,18:219.
〔8〕Burdette JE,Chen SN,Lu ZZ,et al.Black cohosh(Cimicifuga racemosa L.)protects against menadioneinduced DNA damage through scavenging of reactive oxygen species:bioassay-directed isolation and characterization of active principles〔J〕.J Agric Food Chem,2002,50:7022.
〔9〕刘荣华,陈兰英,朱根华,等.单子山楂叶中多元酚类成分及其抗氧化活性研究〔J〕.中草药,2007,38(10):1541.
〔10〕綦菁华,王有年,于同泉,等.不同品种桃的酚类活性成分及其抗氧化功能研究〔J〕.食品与发酵工业,2006,(1):37.
〔11〕Jiang B,Lyles JT,Reynertson KA,et al.Stability evaluation of selected polyphenols and triterpene glycosides in black cohosh〔J〕.J Agric Food Chem,2008,56:9510.
〔12〕Jiang B,Ma CH,Motley T,et al.Phytochemical fingerprinting to thwart black cohosh adulteration:a 15 actaea species analysis〔J〕.Phytochem Anal,2011,22:339-351.
〔13〕潘瑞乐,陈迪华,斯建勇,等.升麻炮制前后有效成分的比较研究〔J〕.中成药,2007,29(9):1335-1337.
Antioxidative Activities of Actaea Plants and Processed Shengma
JIANG Bei1,ZHANG Jie1,ZHOU Nong1,KENNELLY Edward J.2
(1.College of Pharmacy and Chemistry,Dali University,Dali,Yunnan 671000,China; 2.Department of Biological Science,Lehman College,City University of New York,NY 10468,USA)
Objective:To better understand the antioxidative activities of the processed Shengma (Zhi Shengma)as well as the common Actaea plants.Methods:Studies on 26 samples of eight Actaea species from both Asia and North America were performed by using DPPH assay and HPLC analysis.Results:Most of the Actaea samples showed weak/no antioxidative activity with IC50>150 μg·mL-1.Conclusion:The raw extracts of the roots and rhizomes of the Actaea plants only possessed low antioxidative activities. Actaea species is rich in polyphenols and the latter often show certain antioxidative activities.However,since the chemical profiles for polyphenols of Actaea samples are determined by many factors like plant sources,degree of drying,the way to prepare the processed Shengma,the quality and antioxidative activity of both Shengma and processed Shengma are often unstable.Great care should be taken when Shengma or processed Shengma are subjected for bioactive evaluations.
Actaea(Cimicifuga)plants;processed Shengma;antioxidation;DPPH;polyphenols
R285.61[文献标志码]A[文章编号]1672-2345(2012)03-0001-04
云南省中青年学术技术带头人后备人才基金资助项目(2008PY005);教育部留学回国人员科研启动基金资助项目[2009]1001
2012-01-19
姜北,博士,教授,主要从事药用植物与药物资源研究.
(责任编辑 毛本勇)
