食源性致病细菌检测技术研究进展
2012-11-02侯进慧樊继强
侯进慧,蔡 侃,樊继强
(徐州工程学院食品(生物)工程学院,江苏徐州221008)
食源性致病细菌检测技术研究进展
侯进慧,蔡 侃,樊继强
(徐州工程学院食品(生物)工程学院,江苏徐州221008)
对几种常见的食源性致病细菌检测技术进行了综述,对以聚合酶链式反应(PCR)方法为基础的检测技术进行了分析,将PCR检测食源性致病菌所需要用到的靶基因及其引物等进行了归纳,并对食源性致病菌检测技术的发展提出了建议。
食源性致病菌,检测技术,聚合酶链式反应
1 食源性致病菌检测技术
1.1 基因探针检测法
基因探针(gene probe)技术又称核酸分子杂交技术(molecular hybridization),该技术于1968年由华盛顿卡内基学院的Britten等发明。其基本原理是利用DNA双链碱基互补,使带有特定标记的DNA片段即基因探针通过退火与受检样品中的待检DNA片段结合,再通过检测基因探针上的标记物来达到检测样品中有无待测成分的目的。近几年,基因探针技术在食品安全检测领域应用十分广泛,可灵敏、快速、直接、稳定地检测出致病微生物,并且不受非致病微生物的影响。陈彬、黄晓蓉等[2]运用基因探针法检测食品中的金黄色葡萄球菌,检出限为107cfu/mL,检测所用时间为30min。但该技术目前仍有其局限性,比如基因探针的标记物若为放射性基团则可能对人体造成危害,其后续处理也相对比较困难等。因此,完善非放射性标记探针,扩增及放大靶序列和探针的信号,发展简单的杂交方式使探针检测方法更快速、简单、低廉,是下一步发展的方向。
1.2 生物传感器技术
生物传感器(biosensor),是指对生物物质敏感并能将其浓度转换为电信号进行检测的仪器。1967年S.J.乌普迪克等制出第一个生物传感器——葡萄糖传感器标志着生物传感器检测技术的诞生。近年来新兴的表面等离子体共振技术(Surface Plasmon Resonance,SPR)因其快速、灵敏、低成本等优点,已成为食品质量快速检测研究的热点。其利用表面等离子体共振原理对样品浓度进行检测。电磁波沿着金属表面传播即会在金属表面产生表面等离子体,当平行于表面的偏振光以表面等离子体共振角入射在界面上时即被耦合入表面等离子体内,反射光显著减弱,这种变化即可被传感器捕获。不同电介质其表面等离子体共振角不同,而同种电介质附在金属表面的量不同SPR的响应强度也不同,因此将样品固定于金属膜表面就可以快速,准确地测出样品的成分及浓度。运用SPR检测样品,检测时间只需要10min左右;检出限可达到μg/mL;一个生物芯片可反复使用超过1000次[3],物美价廉。
1.3 生物发光检测法
生物发光检测法(Biolumienescence),又称ATP生物发光技术。利用生物细胞破碎后会释放出ATP分子,而ATP分子可在荧光虫素和荧光虫素酶的共同作用下释放高能磷酸键能量,从而产生荧光的原理,通过检测荧光的强度得出ATP的含量,从而推测出样品中所含微生物细胞的浓度。ATP生物发光检测法作为一种快速检测技术,具有简便、灵敏、便于携带、方便现场操作等优点,广泛应用于各类微生物的快速检测。实验证明,运用ATP生物发光法与传统平皿检测法检测的结果具有高度的相关性。其检出限为103cfu/mL,检测时间只需15~20min[4-5]。但ATP发光法只能检测出食品中所含微生物的总数,并不能特异性检测一种目标微生物。
1.4 酶联免疫法
1971年瑞典学者Engvail和Perlmann,荷兰学者Van Weerman和Schuurs分别报道将免疫技术发展为检测体液中微量物质的固相免疫测定方法,即酶联免疫吸附测定法(Enzyme-Linked Immuno Sorbent Assay,ELISA)。其基本原理是使抗原或抗体与某种酶连接成酶标抗原或抗体,这种酶标抗原或抗体既保留其免疫活性,又保留酶的活性。在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应。再用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后加入与酶反应的底物后,底物被酶催化变为有色产物,就可根据颜色反应的深浅进行定性或定量分析。ELISA目前应用十分广泛,具有快速、灵敏、特异、简单、稳定及易于自动化操作等特点,检测范围一般在ng至pg水平。葛萃萃、钟青萍[6]构建ELISA法检测志贺氏菌,检出限为105~106cfu/mL。但ELISA仍有其局限性,比如出现假阳性几率较高、检测影响因素较多,对同种病原菌的检测灵敏度较低等问题。
1.5 聚合酶链式反应技术(PCR)
聚合酶链式反应(polymerase chain reaction,PCR)是由美国加州大学与Cetus公司于1985年联合创建的一项用于短时间内复制克隆DNA片段的技术。其根据DNA在高温下变性,在低温下复性的原理,利用DNA聚合酶、dNTPs、Mg2+、上下游引物等构建反应体系,在几小时内百万倍扩增目标DNA片段。近年来,PCR技术更是得到了进一步的完善。各类新型PCR技术,如免疫-PCR技术、巢式PCR技术、多重PCR技术、PCR-GeneScan技术、实时荧光定量PCR技术、热启动PCR技术及反转录PCR技术等相继问世。此类技术的出现,为快速、准确检测极微量食源性致病菌带来了曙光。常玉华[7]运用PCR法检测酸土环脂芽孢杆菌,检出限为5×103cfu/mL。
2 几种常见食源性致病细菌的PCR检测方法
PCR反应用于扩增目标DNA片段,反应条件、反应体系及引物的选择至关重要。本文归纳了一些常见食源性致病菌及其常规PCR检测所用到的基因、引物和反应条件(表1)。
2.1 沙门氏菌
沙门氏菌属肠杆菌科,为革兰氏阴性菌,需氧或兼性厌氧,周身有鞭毛,一般无荚膜。温、冷血动物的肠道菌,易污染肉、蛋、乳等产品。沙门菌可致多种感染,轻者为自愈性胃肠炎,重可引起致死性伤寒。沙门菌有较强的内毒素,临床上能引起发热,白细胞改变,中毒性休克,并能激活补体系统。
沙门氏菌组氨酸转运操纵子基因(hut)、invA、phoP基因可作为PCR反应检测基因。
2.1.1 invA基因 invA基因为编码沙门氏菌侵袭蛋白的一组基因中最为重要的一种,其编码的蛋白属于沙门氏菌主要毒力因子,只在致病性沙门氏菌中存在,并具有一定的保守性[8]。
2.1.2 phoP基因 phoP是沙门菌的一种重要的调节因子,和位于膜上的PhoQ蛋白构成双组分调节系统,参与许多基因的表达调节,涉及细菌的毒性和对环境应激的耐受能力,且phoP还有不依赖于PhoQ的调节作用,对于phoP基因的研究已引起人们的注意。
2.2 副溶血性弧菌
副溶血弧菌系弧菌科弧菌属,革兰染色阴性,兼性厌氧菌,为多形态杆菌或稍弯曲弧菌。在固体培养基上菌落常隆起,圆形,表面光滑,湿润。本菌嗜盐畏酸,pH=6以下即不能生长,在普通食醋中1~3min即死亡。主要存在于海产品,如墨鱼、海鱼、海虾、海蟹、海蜇,以及含盐分较高的腌制食品,如咸菜、腌肉中。临床上以急性起病、腹痛、呕吐、腹泻及水样便为主要症状。副溶血弧菌16S~32S rDNA高度保守区的一段基因片段和编码不耐热性溶血毒素的tlh基因可用来进行PCR检测。
tlh基因编码的不耐热性溶血毒素是目前研究认为的副溶血弧菌的主要致病因子。Hatsumi等于1985年发现无论是临床分离株,还是环境分离株都含有tlh基因,且tlh基因具有种属特异性。用来检测副溶血弧菌具有快速、灵敏性及特异性好等特点。
2.3 金黄色葡萄球菌
金黄色葡萄球菌隶属于葡萄球菌属,为革兰氏阳性菌,菌体呈球形,无芽孢,无荚膜,耐盐性强。该菌广泛存在于自然界中,可引起化脓性炎症和食物中毒,其致病力强弱主要取决于其产生的毒素-肠毒素(SE)、内毒素--中毒休克综合症毒素(TssT1)、脱皮毒素(ETA、ETB)和侵袭性酶,是食品安全检测常规检测项目之一。
金黄色葡萄球菌耐热核酸酶基因(nuc)、纤维蛋白原结合蛋白基因(clfA)及肠毒素A基因(SEA)可用来进行PCR检测样品中是否含有金黄色葡萄球菌。2.3.1 耐热核酸酶基因(nuc) 是编码金黄色葡萄球菌耐热核酸酶合成的基因。该基因中存在保守区域,因此可用来进行PCR反应检测样品中是否含有金黄色葡萄球菌。
2.3.2 纤维素蛋白原结合蛋白基因(clfA) 研究显示ClfA基因在纤维蛋白原的结合位点是纤维蛋白原重链的C-末端。实验室研究也已证实ClfA基因存在于所有金葡菌的染色体中[9-10],可以特异地检出金葡菌。
2.3.3 肠毒素A基因(SEA) SEA、SEB、SEC、SED、SEE几种基因是金黄色葡萄球菌编码肠毒素的基因,具有相对保守性,可用来检测食品中所含的金黄色葡萄球菌[11]。
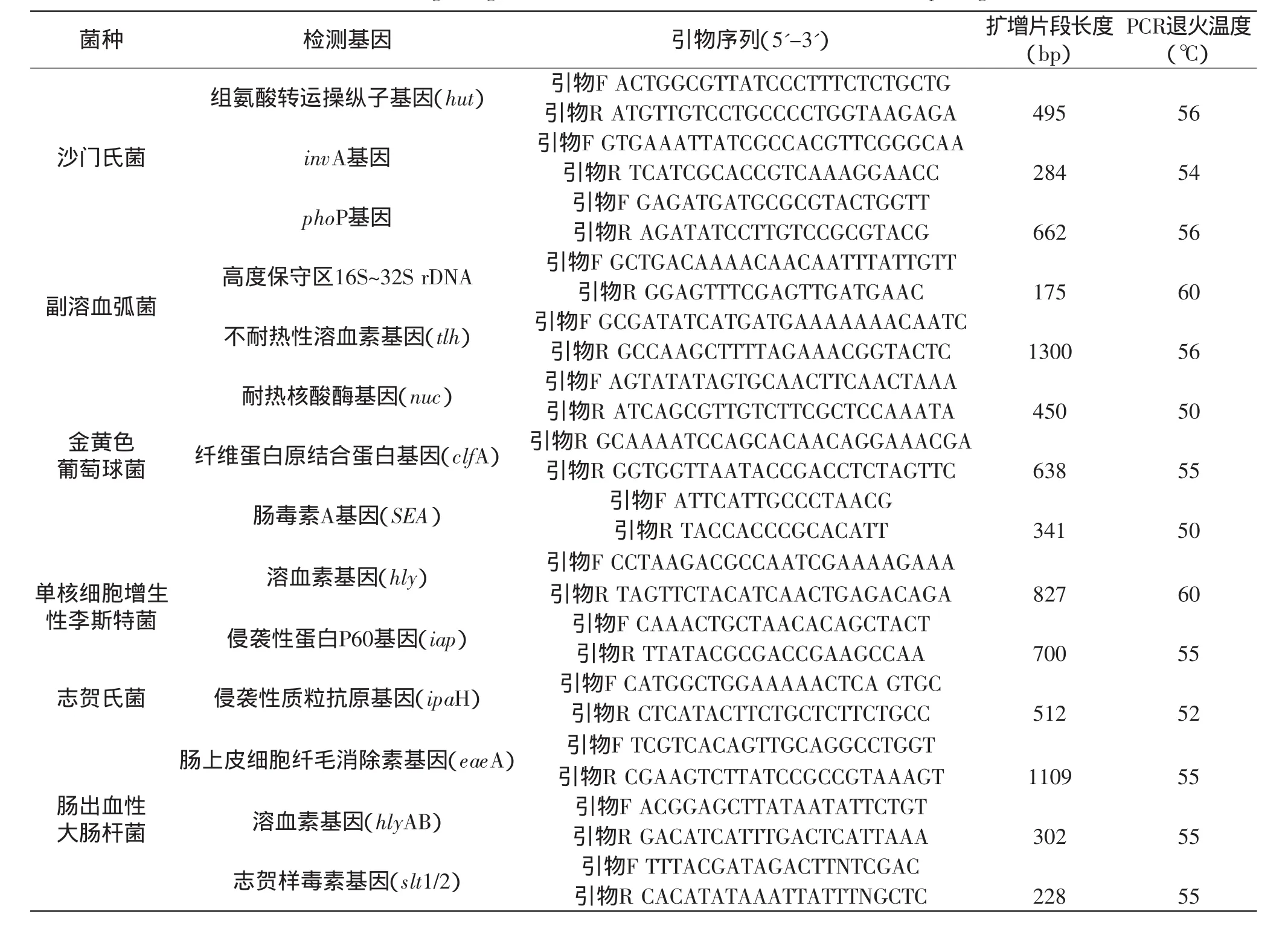
表1 几种食源性致病菌PCR检测目的基因及反应条件Table 1 PCR targeted gene and reaction condition of several foodborne pathogens
2.4 单核细胞增生性李斯特菌
单核细胞增生性李斯特菌系李斯特菌属下一种短小的革兰氏阳性无芽孢杆菌,陈旧培养物有时变为阴性,在含血清的葡萄糖蛋白胨水中能形成多糖荚膜。能在普通冰箱冷藏室生长,是一种典型的耐冷性细菌,同时还具有耐盐性。单核细胞增生性李斯特菌是李斯特菌属中致病力最强的细菌,其能产生溶血素O、磷脂酰肌醇-特异性磷脂酶C等致病物质,是一种人畜共患菌,可引起食物中毒,病死率高达30%~70%。该菌在自然界广泛存在,人们食用的肉、奶、蛋、水产品和蔬菜均可能被其污染。单核细胞增生性李斯特菌的溶血素基因(hlyA)和侵袭性蛋白P60基因(iap)可用来进行PCR检测样品中是否含有该菌。2.4.1 溶血素基因(hlyA) 是编码单核细胞增生性李斯特菌溶血素O的基因,是李斯特菌主要毒力基因,且在该菌中保守。
2.4.2 侵袭性蛋白P60基因(iap) 编码一种60KD的侵袭性蛋白P60的基因,具有李斯特种属特异性,相对保守高度特异。
2.5 志贺氏菌
志贺氏菌属是一类革兰氏阴性杆菌,是人类细菌性痢疾最为常见的病原菌,俗称痢疾杆菌。各型痢疾杆菌都具有强烈的内毒素。本菌可引起发热,神志障碍,甚至中毒性休克等症状。内毒素能破坏粘膜,形成炎症、溃汤,出现典型的脓血粘液便,还可作用于肠壁神经系统,至肠功能紊乱、肠蠕动失调和氢挛,尤其直肠括约肌痉挛最为明显,导致出现腹痛、里急后重(频繁便意)等症状。在食物和引用水的卫生检验时,常以是否含有志贺氏菌为指标。其中,常用志贺氏菌的侵袭性质粒抗原基因(ipaH)来进行PCR检测,确定样品中是否含有志贺氏菌。侵袭性质粒抗原基因(ipaH)由Buysse等于1989年发现,是编码侵袭性质粒抗原H(invasive plasmid antigen H)的基因。多拷贝存在于染色体和侵袭性大质粒上,且不随传代而丢失[12]。
2.6 致病大肠杆菌
大肠杆菌又称肠埃希式杆菌,隶属于埃希式菌属。多数大肠杆菌是人体肠道的正常菌群,但也有少部分会对人体造成损害。肠毒素性大肠杆菌(ETEC)、致病性大肠杆菌(EPEC)、出血性大肠杆菌(EHEC)、侵袭性大肠杆菌(EIEC)和粘附性大肠杆菌(EAEC)为五类最常见的致病大肠杆菌。其中肠出血性大肠杆菌(EHEC)的一种血清型O157∶H7的感染剂量极低,毒性较强且目前还没有特效疫苗。EHEC能产生一种细胞毒素,在肠道能使肠粘膜细胞坏死,引起组织病变。肠出血性大肠埃希菌感染可引起轻度腹泻、出血性结肠炎(HC)、溶血性尿毒综合征(HUS),血栓性血小板减少性紫癜(TTP)等,因此其预防检测工作不可忽视。肠出血性大肠杆菌的肠上皮细胞纤毛消除素基因(eseA)、溶血素基因(hlyAB)、志贺样毒素基因(slt1/2)可用来进行PCR检测样品中是否含有EHEC。2.6.1 肠上皮细胞纤毛消除素基因(eseA) 编码紧密粘附素,此粘附素是一种外膜蛋白,介导菌与细胞的紧密结合。
2.6.2 溶血素基因(hlyAB) 是EHEC的溶血素基因。该溶血素的基因位于一个60MD的大质粒上,而几乎所有的O157∶H7菌株都有一个这样的质粒。利用hly基因可检出产生或不产生志贺样毒素的EHEC菌株。2.6.3 志贺样毒素基因(slt1/2) 是EHEC的志贺样毒素基因,临床分离的绝大多数大肠埃希菌O157∶H7菌株都具有志贺样毒素基因。
3 几种常见食源性致病菌的多重PCR检测方法
普通PCR技术检测样品中食源性致病菌虽然拥有检测速度快、敏感性高、特异性强、使用方便等优点。但缺点也显而易见,一次PCR只能扩增一种DNA片段,当有多种样品需要检测时工作量便会加大。多重PCR技术的诞生很好的解决了这个问题。多重PCR技术是指同时运用多对引物扩增多条DNA片段的办法。因其兼具普通PCR检测方法的优势又解决了普通PCR一次只能扩增一种DNA片段的缺点,目前在一些食源性致病菌检测上运用十分广泛,R-FWang,W-WCao等建立了一种多重PCR方法,能同时检测样品中的13种目标微生物[13]。但由于该方法同时使用多对引物,增加了引物与目标基因片段之间的错配几率,使检测发生假阳性污染的概率增高。如何降低多重PCR方法假阳性的产生是该技术有待解决的问题。本文总结了一些常见食源性致病菌运用多重PCR技术检测所涉及到的目标基因和所需的反应条件(见表2)。从表2可以看出,食源性致病菌的检测要注重选择特异性强的基因做检测对象,比如一些菌株亚型的特有毒力因子。
4 讨论
聚合酶链式反应(PCR)检测技术,因其具有检测速度快、效率高、使用方便等多种优点,可以为常规标准检验方法的最终鉴定提供进一步的佐证,但是目前的方法对于PCR平台的利用不够深入,在检测中还存在着不少问题,主要有:检测致病微生物的种类较少,很多是对于常见致病菌分析到属的水平;分析的序列种类较少,分辨率低,对于菌种或亚型等下级分类阶元的分辨率就更低,而具体到菌种甚至亚型的分类则需要对更加特异性的序列进行分析;检测结果存在一定的假阳性和假阴性现象;没有形成一套系统、准确的基于PCR的食源性致病微生物检测方法。在这种情况下,国内外许多科学工作者对传统PCR技术进行不断的改进创新,试图通过各种手段解决上述问题。其中如何将多种检测方法有机整合是近年来食品安全检测行业所热衷探讨的一个问题[14-16]。
将多种检测方法融合旨在利用优势互补解决各种检测方法的局限。将几种PCR技术联合使用的研究报告近几年不断出现。多重荧光实时PCR检测技术目前在国际微生物检测领域方兴未艾,它不仅具有多重PCR节省检测成本和时间的特点,还兼具荧光实时PCR技术实时定量检测监控PCR产物的优点,是目前国际上研究的热点技术。研究者运用多重实时荧光PCR检测牡蛎和墨西哥湾水体中的副溶血弧菌取得了较为理想的效果,在5h的样品菌体孵化后,检出限达10cfu/mL[17]。在样品中所含病毒的检测方面,将多种PCR联合使用也颇有成效,张杰[18]等将多重PCR与反转录PCR结合,建立了检测禽流感病毒与新城鸡瘟病毒的检测方法,取得了与普通反转录PCR方法一样的分辨率。
PCR检测技术要想取得较为准确的检测结果,克服分辨率不高的缺点,同时避免假阳性、假阴性污染的发生,样品的前处理和引物的设计非常的关键。目前常用的样品前处理方法是对样品进行孵化处理来达到富集靶细菌的目的,但需要耗费大量的时间。而如果将免疫学方法与PCR检测方法联合使用则可解决这一问题。Notzon[19]等将PCR技术与免疫磁珠技术相结合,利用免疫磁珠技术先对样品中病原菌进行分离,再利用PCR技术进行检测,在12~13h内快速检出了肉类食品中的沙门菌,检测准确率为80%。国外也有将ELISA与PCR技术有机结合建立病原菌检测方法的报道,对于提高病原菌检测的检出率取得了较为令人满意的结果[20]。当然另一些关于PCR检测技术的问题目前仍待解决。PCR检测技术下一步的研究方向是努力丰富各种病原微生物的可用来进行PCR检测的特异性序列,甚至建立一个专门为PCR检测提供服务的PCR靶基因序列库。对于PCR检测病原菌的各个检测环节也应给出相应的规范化标准,使PCR检测技术成为一种标准化检测方法。

表2 几种常见食源性致病菌多重PCR检测目的基因及反应条件Table 2 Multiplex PCR targeted gene and reaction condition of several foodborne pathogens
[1]Diane G Newell,Marion Koopmans,Linda Verhoef,et al. Food-borne diseases:The challenges of 20 years ago still persist while new ones continue to emerge[J].International Journal of Food Microbiology,2010,139:S3-S15.
[2]陈彬,黄晓蓉,汤敏英,等.基因探针法快速检测食品中金黄色葡萄球菌的研究[J].现代预防医学,2007,34(6):1017-1021.
[3]陈继冰.生物传感器在食品安全检测中的应用与研究进展[J].食品研究与开发,2009,30(1):180-183.
[4]马妮,赵虹,张旭,等.ATP发光技术快速检测食品中菌落总数[J].中国卫生工程学,2008,7(5):296-297.
[5]连英姿,董雪,李勇,等.ATP生物发光技术快速检测水中细菌的研究[J].中国卫生检验杂志,2007,17(10):1859-1860.
[6]葛萃萃,钟青萍.抗志贺氏菌IgY的提纯及建立间接ELISA检测志贺氏菌[J].中国食品学报,2006,6(1):11-14.
[7]常玉华.苹果浓缩汁中耐热菌的PCR方法快速检测研究[D].西安:陕西师范大学,2003.
[8]Cocolin L,M Manzano,C Cantoni,et al.Use of polymerase chain reaction and rest riction enzyme analysis to directly detect and identify Salmonella typhimurium in food[J].Appl Microbiol,1998,85:673-677.
[9]Mcdevitt D,Nanavaty T,Housepompeo K,et al.Characterization of the interaction between the Staphylococcus aureus clumping factor(ClfA)and fibrinogen[J].Eur J Biochem,1997,247(1):416-424.
[10]Smeltzer M S,Gillaspy A F,Pratt F L,et al.Prevalence and chromosomal map location of staphylococcus aureus adhesion genes[J].Gene,1997,196:249-259.
[11]Gigaud O.Staphylococcal enterotoxin genes of classical and new types detected by PCR in France[J].Food Microbiol,2002,77(1-2):61-70.
[12]Venkatesan M M,Buysse J M,kopecko D Y.Use of shigella flexneryipaC and ipaH gene sequence for the general identification of shigella spp.and enterioinvasive E.coli.[J].J Clin Microbiol,1989,27:2671-2691.
[13]R-FWang,W-WCao,CECerniglia.A universal protocol for PCR detection of 13 species of foodborne pathogens in foods[J]. Journal of Applied Microbiology,1997,83:727-736.
[14]Dave Boxrud.Advances in subtyping methods of foodborne disease pathogens[J].Current Opinion in Biotechnology,2010,21:137-141.
[15]Vijayalakshmi Velusamy,Khalil Arshak,Olga Korostynska,et al.An overview of foodborne pathogen detection:In the perspective of biosensors[J].Biotechnology Advances,2010,28:232-254.
[16]Mcmeekin TA,Hill C,Wagner M,et al.Ecophysiology of food-borne pathogens:Essential knowledge to improve food safety [J].International Journal of Food Microbiology,2010,139:S64-S78.
[17]Amy V Rizvi,Asim K Bej.Multiplexed real-time PCR amplification of tlh,tdh and trh genes in Vibrio parahaemolyticus and its rapid detection in shellfish and Gulf of Mexico water[J]. Antonie van Leeuwenhoek,2010,98:279-290.
[18]Hao-tai Chen,Jie Zhang,et al.Rapid discrimination of H5 and H9 subtypes of avian influenza viruses and Newcastle disease virus by multiplex RT-PCR[J].Vet Res Commun,2008,32:491-498.
[19]Notzon A,Helmuth R,Bauer J.Evaluation of an immunomagnetic separation real time PCR assay for the rapid detection of Salmonella in meat[J].J Food Prot,2006,69(12):2896-2901.
[20]Perelle S,Dilasser F,Malorny B,et al.Comparison of PCRELISA and light cycler realtime PCR assays for detecting Salmonella spp.in milk and meat samples[J].Mol Cell Probes,2004,18(6):409-420.
Research progress in detection techniques for foodborne pathogen
HOU Jin-hui,CAI Kan,FAN Ji-qiang
(Food Engineering(Bioengineering)Department,Xuzhou Institute of Technology,Xuzhou 221008,China)
Several kinds of detection techniques for common foodborne pathegens were reviewed.Detection methods based on PCR were analyzed especially,and target genes and their primers of some foodborne pathogens involved in PCR detection were summarized.Furthermore,some suggestions were given to the development of detection techniques for foodborne pathegens.
foodborne pathogen;detection technique;PCR
TS207.4
A
1002-0306(2012)07-0387-06
“民以食为天”,人类自古就对食品安全十分重视。而食品中各种病原微生物往往是导致食品安全问题的罪魁祸首。在这种情况下,各种食源性病原微生物检测技术应运而生。传统的食源性致病微生物检测技术存在方法步骤多、检测过程长、检测灵敏度低等问题。开发食源性致病微生物快速、高效、准确的检测方法,是满足不断提高的社会对食品安全要求的需要,是满足不同领域的检测或研究的需要,也是满足现代化检测技术革新的需要。从2003年、2008年和2010年食品安全国家标准的三次修改中可以看出社会对快速检测技术的需求。相对于2003年的食品安全国家标准(GB/T 4789.30-2003),2008年的国家标准(GB/T 4789.30-2008)单核细胞增生李斯特氏菌检验方法中增加了快速检测方法二和三,而这两种检测方法在2010年食品安全国家标准(GB 4789.30-2010)中被删除掉了。食品安全国家标准的变化是对新的检测技术的有益尝试。对于食品安全国家标准的修改,并不是说要完全摒弃快速检测方法,而恰恰说明了快速简便的检测技术需要不断完善,这方面的研究要大力开展。随着生物科技的发展,酶联免疫吸附、荧光检测技术、聚合酶链式反应(PCR)等技术因其检测速度快、准确度高、成本低等优点逐渐受到食品检测行业的重视,是发展潜力较大的食品检测技术。其中,PCR技术因其检测速度快、准确度高等特点,受到食品检测研究者的关注,是食品检测的有力工具[1]。本文对几种食源性致病菌检测技术进行了归纳,并对基于PCR技术的常见食源性致病菌检测方法进行了分析总结。
2011-04-14
侯进慧(1980-),男,讲师,博士,研究方向:应用微生物学与生物工程。
徐州市科技计划项目(XZZD0924);徐州工程学院校级科研课题(2011110);徐州工程学院2011年度大学生创新创业基金项目。
