不同成熟期“北春”越橘花色苷含量及抗氧化研究
2012-11-02吕春茂孟宪军李颖畅
吕春茂,杨 宏,孟宪军,李颖畅,包 静
(1.沈阳农业大学食品学院,辽宁沈阳110866;2.渤海大学生物与食品科学学院,辽宁锦州121000)
不同成熟期“北春”越橘花色苷含量及抗氧化研究
吕春茂1,杨 宏1,孟宪军1,李颖畅2,包 静1
(1.沈阳农业大学食品学院,辽宁沈阳110866;2.渤海大学生物与食品科学学院,辽宁锦州121000)
为充分开发利用越橘属植物资源,确定适宜采收期,分别采收绿白期、粉熟期、亮蓝期、后熟期的越橘栽培品种“北春”,对四个不同成熟期的果实进行花色苷含量及体外抗氧化活性研究,并对越橘果实中糖酸含量与花色苷含量进行了相关性分析。结果表明,随着果实的成熟,花色苷含量逐渐增加,且在亮蓝期达到最高150.54mg/100g;果实的花色苷含量与糖酸比呈正相关;4个不同成熟期的“北春”果实花色苷均有良好的抗氧化活性,且花色苷的抗氧化活性与其含量呈正相关,亮蓝期“北春”越橘的还原能力、抗脂质过氧化能力、清除羟自由基能力、清除超氧阴离子自由基能力和清除DPPH自由基能力均最高,且其抗脂质过氧化能力、清除羟自由基的能力均高于抗坏血酸。
越橘,成熟期,花色苷,抗氧化性
越橘(Bilberry),又称蓝浆果、蓝莓果,属于杜鹃花科(Ericaceae)越橘属(Vaccinium.SPP)植物[1],多年生落叶常绿灌木浆果类果树。根据目前进行的研究,从营养、药用和经济价值等方面综合评价,越橘被联合国粮农组织列为人类五大健康食品之一,是一种具有较高经济价值和广阔开发前景的新兴果树树种[2]。越橘果实中的花色苷是品质优良的天然色素,其含量是目前所有已测水果与蔬菜之中含量最高的[3]。花色苷是一种天然的抗氧化剂,具有抗氧化、清除自由基等多种保健和营养功能,且对人体无任何毒副作用,对它的开发应用受到越来越多的关注。正是由于它具备的这些功效,使得近年来越橘的消费市场逐年扩大,被称为继苹果和柑桔之后的“世界第三代水果”[4]。有研究表明果实花色苷含量及抗氧化活性与其成熟期有关[5],但其并未具体阐述,本研究以越橘栽培品种“北春”为材料,研究果实绿白期、粉熟期、亮蓝期、后熟期[6](亮蓝期后10d)的越橘果实花色苷的含量及其抗氧化活性的变化,并就越橘果实中糖酸对花色苷含量的影响进行了相关性分析,确立越橘果实的最佳采收期,为越橘果实的综合利用与开发提供理论依据。
1 材料与方法
1.1 材料与仪器
北春(Northcountry,半高丛越橘品种群) 果实球形,被白色果粉,呈蓝色,果实于2010年7月采自沈阳农业科技开发院,分绿白期、粉熟期、亮蓝期、后熟期四次采摘,4℃预冷4h,-20℃冷冻储藏,隔天测定各指标,实验分别于不同采收时期重复4次,结果为4次的平均值;没食子酸标准品、氢氧化钠 天津科密欧化学试剂有限公司;无水乙醇 天津市百世化工有限公司;钨酸钠、钼酸钠、磷酸、硫酸锂、NaH2PO4· 2H2O、Na2HPO4·12H2O、蛋黄卵磷脂、抗坏血酸、三氯乙酸、硫代巴比妥酸、硫酸亚铁、冰乙酸、三氯化铁、六氰合铁酸钾、邻苯三酚、Tris(三羟甲基氨基甲烷)、水杨酸、30%过氧化氢 国药集团化学试剂有限公司;无水碳酸钠、盐酸 天津东华试剂厂;DPPH(1,1-二苯基-2-三硝基苯肼) Sigma公司;所有试剂均为分析纯。
JY92-Ⅱ超声波细胞破碎机 宁波新芝生物科技股份有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;TU-1810紫外可见分光光度计 北京普析通用仪器有限公司;TDL-40B台式离心机 上海安亭科学仪器厂;SHZ-Ⅲ循环水式真空抽滤装置 上海华琦科学仪器有限公司。
1.2 实验方法
1.2.1 越橘花色苷的制备
1.2.1.1 原料处理 将越橘冻果取出,打浆,称取越橘果实2g左右,用研钵研磨压榨,在恒温25℃条件下,用60mL体积分数为1%的盐酸化乙醇溶液超声提取,提取条件为温度51℃,超声功率500W,提取时间7.06min,乙醇浓度55%,离心、抽滤,定容到25mL容量瓶。另外准确称取抗坏血酸(VC)0.1000g,用60%的乙醇溶液溶解定容至100mL,制成越橘花色苷抗氧化性比较的对照液。
1.2.1.2 工艺流程 越橘果实→解冻→研磨→超声波辅助盐酸乙醇溶剂提取→真空抽滤→滤液浓缩→定容→比色
1.2.2 提取物的评价方法 本文采用pH示差法[7]测定提取液中色素含量,排除其他非色素物质的干扰。
越橘果实中花色苷含量计算公式如下:

式中:X-越橘果实花色苷含量,mg/g;△T(A)-吸光度值;V-稀释体积,L;F-稀释倍数;M-矢车菊色素-3-葡萄糖苷的相对分子质量,449.2;ε-矢车菊色素-3-葡萄糖苷的摩尔消光系数,26900;m-样品质量,g。
1.2.3 总酚酸含量的测定 酚酸含量的测定采用Folin-Ciocalteus法[8],用没食子酸作标准物,以参照品溶液的吸光度值和参照品的浓度进行线性回归,求得回归方程,由回归方程得到待测物多酚含量。总酚测定标准曲线见图1。
加入不同成熟期的越橘花色苷提取液1mL,再分别加入Folin酚试剂2.5mL,7.5%Na2CO3溶液2mL,然后用蒸馏水定容到10mL,混合均匀,在45℃水浴中反应15min,取出样品混合10s后,4000×g离心20min,于765nm波长下测定吸光度,待测液中酚酸含量表示每毫升待测液相当于没食子酸的毫克数[9]。
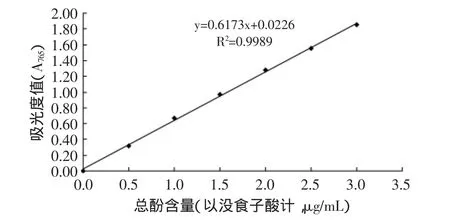
图1 总酚测定标准曲线Fig.1 Standard curve for determination of total polyphenols
1.2.4 越橘中可溶性糖及有机酸含量的测定 可溶性糖含量采用蒽酮比色法进行测定,标准曲线见图2;有机酸含量采用碱滴定法进行测定,结果以柠檬酸百分数表示。

图2 可溶性糖标准曲线Fig.2 Standard curve of soluble sugar
1.2.5 还原能力的测定 采用普鲁士蓝法[10]。在25mL具塞试管中加入不同成熟期的越橘花色苷提取液1mL和1mL VC溶液,0.6mL磷酸盐缓冲液(0.2mol/L,pH=6.6)和1.5mL 1%K3[Fe(CN)6],置于50℃恒温水浴中反应20min,流水冷却至室温,加入3mL 10%冰乙酸,放置10min,取反应液3mL,加入5mL蒸馏水和0.2mL 1%FeCl3溶液,混合均匀,5min后于波长为517nm分光光度计下测定其吸光度,吸光值越大表示还原力越强。同时以1.5mL蒸馏水代替1.5mL K3[Fe(CN)6]溶液做本底。
1.2.6 抗脂质过氧化能力的测定 抗脂质过氧化能力的测定参照樊金玲[11]的方法。准确移取不同成熟期的越橘花色苷提取液1mL和VC溶液1mL,依次加入1mL卵磷脂溶液、1mL 0.4mol/L硫酸亚铁,混合均匀。避光于37℃水浴中60min,加入2mL TCA-TBA-HCl混合液,90~100℃水浴15min,迅速冷却,3000r/min转速离心10min,取上清液在535nm测定吸光度As。空白管以1mL重蒸水代替样品,操作方法同样品管,可测得空白管的吸光度Ac。
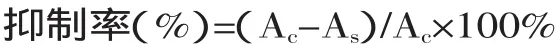
1.2.7 清除羟自由基(·OH)的测定 参照Smirnoff的方法并略加改动[12]。反应体系中含1mL 8.8mmol/L H2O2,1mL 10mmol/L FeSO4,1mL 10mmol/L水杨酸-乙醇。分别准确移取不同成熟期的越橘花色苷提取液1mL和1mL VC溶液,加H2O2启动反应,37℃反应0.5h,以蒸馏水作参比,在510nm下测定各浓度的吸光度。清除率计算公式为:

其中:A0为对照液的吸光度,A1为加入花色苷溶液后的吸光度,A2为不加显色剂H2O2花色苷溶液的吸光度,抗坏血酸作阳性对照。
1.2.8 清除超氧阴离子自由基(O2-·)的测定 采用邻苯三酚自氧法测定[13]。取4.5mL pH8.2的50mmol/L Tris-HCl缓冲液和4.2mL蒸馏水,混匀后在25℃恒温水浴中保温20min。取出,立即加入在25℃预热过的3mmol/L邻苯三酚溶液0.3mL,迅速摇匀后倒入比色杯,每隔0.5min在320nm处测定溶液的吸光度,计算线性范围内每分钟吸光度的增加(△A0)。
取4.5mL pH8.2的50mmol/L Tris-HCl缓冲液和3.3mL蒸馏水,混匀后在25℃恒温水浴中保温20min,准确移取各待测液1mL,加入在25℃预热过的3mmol/L邻苯三酚溶液0.3mL,迅速摇匀后倒入比色杯,每隔0.5min在320nm处测定溶液的吸光度,计算线性范围内每分钟吸光度的增加(△A),计算清除率。
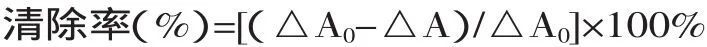
其中:△A0为邻苯三酚自氧化速率;△A为加入越橘花色苷后邻苯三酚的自氧化速率,单位均为吸光度每分钟的增值。
1.2.9 清除DPPH自由基的测定 参考Yamaguchi[14]的方法并进行改进。称取0.1984g DPPH用无水乙醇溶解,定容至50mL,作为储备液。吸取2mL DPPH储备液,用无水乙醇定容至100mL,待测。利用紫外-可见分光光度计法测定加抗氧化提取液后在波长517nm处吸收值的下降,表示其对有机自由基的消除能力,按表1加反应液,用力摇匀,将Ai所表示的样品在常温下避光反应30min后,加入比色皿中进行吸光度的测定,测出A0、A1、A2的吸光度值。

表1 DPPH实验加样表Table 1 Test sample table with DPPH
按下列公式进行清除率的计算:

式中:A0为未加提取液的DPPH溶液的吸光度,以70%乙醇作空白;A1为加入提取液后DPPH溶液的吸光度,以70%乙醇作空白;A2为提取液与提取剂混合后的吸光度,以70%乙醇作空白。
2 结果与讨论
2.1 越橘果实花色苷含量
花色苷是越橘果实中最主要的生物活性物质,对兔眼越橘、南高丛、北高丛、矮丛越橘和野生越橘在内的26个品种分析发现[15],越橘果实中,总花色苷含量与抗氧化能力的相关系数达0.77以上。因此,常用越橘果实中花色苷含量的多少作为区别其营养价值、寻找筛选高花色苷含量的基因型材料,作为杂交材料、培育高花色苷含量的优良品种。

图3 越橘果实花色苷含量的比较Fig.3 Anthocyanins levels of different maturity of Northcountrybilberry fruits
如图3,在果实成熟初期即绿白期,果实的花色苷含量较低,仅为29.74mg/100g;随着果实的成熟,花色苷量逐渐增加,呈上升趋势,并在亮蓝期达到最高150.54mg/100g;到了成熟末期,果实的花色苷含量略有下降的趋势,但幅度不大。果实成熟以后,花色苷合成速率趋缓,但总体呈上升趋势,且不同成熟期的越橘果实花色苷的含量差异显著(P<0.05)。
2.2 越橘果实糖酸含量对花色苷的影响
越橘果实中,花色素与糖苷相结合形成花色苷,稳定存在于细胞液胞中,即红色合成需要糖源,因此越橘果实中花色苷含量与果实的糖酸含量有密切关系。糖是花色苷合成的一种原料,糖类对花色苷合成的诱导很早就有报告,但并不单纯地通过糖酵解途径,更多的是通过信号机制促进花色苷合成[5],由于花色苷具有离子化的特点,所以有机酸含量变化改变pH,花色苷的结构和颜色都随着pH的变化而变化。

图4 不同成熟期越橘果实可溶性糖及有机酸含量的变化Fig.4 The change of soluble sugar and organic acids content of different maturity of bilberry fruits
2.2.1 可溶性糖和有机酸含量的变化 如图4,果实成熟以后,糖积累速率趋缓。在果实成熟初期,果实的含糖量较低为6.60%;而后,随着果实的成熟,含糖量逐渐增加,亮蓝期达到最高,含糖量为11.67%;到了成熟末期,果实的含糖量略有下降的趋势,但幅度不大。
与含糖量相反,果实成熟以后,有机酸变化的趋势缓慢,但总体呈下降的趋势。在绿白期果实的有机酸含量较高为1.13%;随着果实的成熟,有机酸的含量开始下降,亮蓝期时为0.93%;成熟末期有机酸含量又略有很小的上升,可能是因腐烂发酵产酸所致。
2.2.2 越橘果实糖酸比与花色苷含量的相关性分析 如图5,在果实成熟初期,糖酸比较低,为5.20;随着果实的成熟,糖酸比开始升高,在亮蓝期达到高峰,为13.57,成熟末期又略有下降。总体看来,果实的糖酸比呈上升的趋势,成熟末期稍有下降。“北春”果实花色苷含量的变化趋势与果实糖酸比在总体上一致,可见,随着果实糖酸比的增加,花色苷含量也随之增加,呈正相关。说明糖酸比的增加促进花色苷的形成。

图5 越橘果实糖酸比与花色苷含量的相关性分析Fig.5 The correlation between the content of anthocyanine and the ratio of sugar to acid
2.3 总酚含量
酚类化合物是广泛存在于水果、蔬菜和谷类食物中的植物次生代谢产物,有多种生物活性,尤其在预防心脑血管、癌症以及衰老方面发挥着十分重要的作用[9]。不同成熟期“北春”越橘果实的总酚含量变化见图6。

图6 总酚含量Fig.6 The total phenolics content
从图6可以看出,随着果实的成熟,总酚含量逐渐增加,并在亮蓝期达到最大,约为0.0719μg/mL;到了成熟末期,总酚含量略有降低,但仍高于前两个采收期。除粉熟期和成熟末期外,各成熟期的越橘花色苷提取液的总酚含量差异显著(P<0.05)。
2.4 还原能力
多酚类化合物抗氧化作用的一个重要机理是抗氧化剂能给出电子和质子氢,从而起到清除自由基的作用,抗氧化剂能够在一定的条件下将Fe3+还原为Fe2+,根据Fe3+还原为Fe2+的多少可以间接评价各种提取物的抗氧化能力,一般而言,还原力越强,抗氧化性越强,还原力大小以A700nm表示,A700nm越大,还原力越强[16]。

图7 不同成熟期越橘果实花色苷的还原能力Fig.7 Reducing ability of different maturity of bilberry anthocyanins
从图7可以看出,还原力从小到大依次为绿白期、粉熟期、成熟末期、亮蓝期,在亮蓝期还原力达到了最大(0.698),但均低于抗坏血酸的还原能力(0.912)。花色苷的还原力小于抗坏血酸,可能是花色苷结构中的-OH数量少于抗坏血酸,因此还原力小于抗坏血酸。
2.5 抗脂质过氧化、清除羟基自由基、超氧阴离子自由基及DPPH自由基能力
由于脂质过氧化在自由基生物学、流行病学上的重要意义,已经建立了很多评价抗氧化剂抗脂质体过氧化的体外实验体系,本文选择了常用的由Fe2+引发的卵磷脂PBS分散系,通过检测卵磷脂的氧化产物-过氧化物经分解产生的二级产物丙二醛(MDA)在酸性条件下与硫代巴比妥酸(TBA)缩合成的红色物质TBARS在532nm的特征吸收值,来衡量脂质体的氧化程度[17]。
·OH是目前所知活性氧中对生物体毒性最强、危害最大的一种自由基,它可以通过电子转移、加成以及脱氢等方式与生物体内的多种分子作用,造成糖类、氨基酸、蛋白质、核酸和脂类等物质的氧化性损伤,使细胞坏死或突变。利用Fenton反应产生·OH,水杨酸法检测羟基及物质清除·OH的能力,在此法中,·OH进攻水杨酸分子的苯环,产生能用分光光度法测量的羟基化合物2,3-二羟基苯甲酸,故可用该产物生成的多少来描述羟基的量及待测物质清除·OH的能力[16]。
DPPH(二苯代苦味酰自由基)分析法被广泛用于清除自由基物质性质的研究,DPPH·在有机溶剂中是一种稳定的自由基,其孤对电子在517nm附近有强吸收(显深紫色),当有机清除剂存在时,孤对电子被配对,吸收消失或减弱,通过测定吸收减弱的程度,可评价自由基清除剂的活性,其能力用抑制率来表示,抑制率越大,抗氧化能力越强,DPPH法是用以评价天然抗氧化剂活性的一种快速(反应时间仅需20min)、简便、灵敏可行的方法[17]。
由图8可以看出,抗脂质过氧化能力绿白期最弱,亮蓝期最强为27.94%,后熟期次之,且这两个采收期果实花色苷的抗脂质过氧化能力明显高于抗坏血酸(17.89%),由于花色苷类结构中大分子间的共扼效应,螯合铁离子的能力高于抗坏血酸,表现出抗脂质过氧化能力高于抗坏血酸。亮蓝期与其它差异显著(P<0.05)。绿白期、粉熟期抗脂质过氧化能力与抗坏血酸相当。

图8 不同成熟期越橘花色苷的抗脂质过氧化、羟基自由基、超氧阴离子自由基及DPPH自由基清除能力Fig.8 The scavenging power assay on lipid peroxidation,·OH,·and DPPH free radical of different maturity of bilberry anthocyanins
抗坏血酸对DPPH自由基有很强的抑制作用,抑制率已经在90%以上,各个成熟期越橘果实花色苷均具有良好的清除DPPH自由基的能力,亮蓝期最强达到74.34%,但与抗坏血酸差异显著(P<0.05)。
亮蓝期果实花色苷的羟基自由基清除率最高为45.92%,成熟末期清除率下降且略低于粉熟期,推测是由于粉熟期和成熟末期越橘果实花色苷组分及其含量不同所导致,越橘果实花色苷的组分及其清除羟自由基的功效还有待于进一步研究。与抗坏血酸相比较,粉熟期、亮蓝期两个采收期花色苷粗品溶液对羟自由基的清除率均高于抗坏血酸,且亮蓝期与抗坏血酸差异显著(P<0.05)。
超氧阴离子自由基是第一个生成的氧自由基,又是所有氧自由基的前身,可以转化为其它氧自由基。因此,清除超氧阴离子自由基对有效地减少其它氧自由基的生成具有非常重要的意义。从图8可以看出,各个成熟期越橘果实花色苷溶液对超氧阴离子自由基都有一定的清除作用,绿白期时较低为13.69%,亮蓝期时达到最高39.42%,后熟期略有下降。抗坏血酸对超氧阴离子自由基有很强的清除作用,清除率已经达到88.91%,与越橘花色苷差异显著(P<0.05)。
3 结论
越橘果实中含有丰富的花色苷,栽培品种花色苷含量可达0.07~0.15g/100g鲜重[18]。本研究中,不同成熟期半高丛越橘栽培品种“北春”花色苷含量亦不相同,且亮蓝期果实的花色苷含量明显高于其他3个成熟期,达到150.54mg/100g鲜重。总体看来,随着果实的成熟,可溶性糖含量呈上升的趋势,有机酸含量呈下降的趋势,果实的糖酸比呈上升的趋势,成熟末期稍有下降。花色苷含量的变化趋势与果实糖酸比呈正相关。
体外抗氧化活性研究结果表明4个成熟期越橘果实的花色苷溶液均有抗氧化活性,花色苷溶液的抗氧化活性与花色苷含量呈正相关,果实中所含的花色苷含量不同导致其抗氧化活性也不同,亮蓝期的花色苷含量及抗氧化性均最高,且其抗脂质过氧化能力、清除羟自由基的能力均高于抗坏血酸。因此确定越橘栽培品种“北春”最适宜采收期为亮蓝期。
[1]徐璐,郑建仙.欧洲越桔花色苷的研究概况[J].中国食品添加剂,2005(4):43-64.
[2]李亚东.越橘栽培与加工利用[M].吉林:科学技术出版社,2004:101-102.
[3]朱智明.野生笃斯越橘的营养和经济价值评论[J].生物杂志,1990,20(5):18-22.
[4]吕春茂,王新现,董文轩,等.越橘花色苷特征及其制备技术研究进展[J].食品工业科技,2011,32(5):428-431.
[5]佟琳琳.越橘果实花色苷的动态分析和提取工艺研究[D].吉林:吉林农业大学,2006.
[6]张豫超,谢鸣,陈俊伟,等.不同采收期草莓果实抗氧化物质含量和抗氧化活性的变化[J].浙江农业学报,2009,21(3):250-254.
[7]陈伟,孟宪军,王立男.玫瑰花红色素提取工艺研究[J].食品研究与开发,2006,27(3):50-52.
[8]王二雷,林松毅,刘静波,等.笃斯越桔中花青素含量分析[J].食品科学,2007,28(10):460-463.
[9]孙波,Bekhit Aed,王坤波.不同品种蓝莓提取物抗氧化作用的研究[J].食品科学,2007,28(10):61-63.
[10]莫开菊,柳圣,程超.生姜黄酮的抗氧化活性研究[J].食品科学,2006,27(9):110-115.
[11]樊金玲,丁霄霖.沙棘籽提取物抗氧化活性与酚类组成的研究[J].天然产物研究与开发,2006,18(4):529-534,554.
[12]Smironff N,Cumbes QJ.Hyroxyl radical scavenging activity of compatible solutes[J].Phytochemisty,1989,28(4):1051-1560.
[13]Dun P D,Yen G C.Antixidant activities of three herbal water extracts[J].Food Chem,1997,60:639-645.
[14]Yamaguchi T,Takamura H,Matoba T,et al.HPLC method for evaluation of the free radical-scavenging activity of foods by using1,1-diphe-nyl-2-picrylhydrazyl[J].Bioscience Biotechnology Biochemistry,1998,62:1201-1204.
[15]Ronald L,Prior,Guohua Cao,et al.Antioxidant capacity as influenced by total phenolic and anthocyanin content,maturity and variety of vaccinium species[J].Agric Food Chem,1998,46:2686-2693.
[16]郭松年,刘兴华.石榴汁花色苷稳定性、抗氧化性及其组分鉴定[D].西安:西北农林科技大学,2008.
[17]吕峰.紫萝卜花色苷的提取、结构、稳定性和抗氧化性研究[D].南昌:南昌大学,2007.
[18]胡雅馨,李京.蓝莓果实中主要营养及花青素成分的研究[J].食品科学,2006,27(10):600-603.
Study on content and antioxidant activity of anthocyanins from different maturity of Northcountry bilberry fruits
LV Chun-mao1,YANG Hong1,MENG Xian-jun1,LI Ying-chang2,BAO Jing1
(1.Shenyang Agricultural University,Shenyang 110866,China;2.College of Biology and Food Science,Bohai University,Jinzhou 121000,China)
To take full advantage of the bilberry resources and determine appropriate harvest time,four different maturity stage:green white period,powder ripe period,bright blue period,and mature late period of cultivated variety Northcountry bilberry were harvested respectively.Then the content and antioxidant activity of anthocyanins were studied and found that the ratio of sugar to acid could affect the content of anthocyanins. The results showed that the correlation between the content of anthocyanine and the ratio of sugar to acid were always positive,and the increase of sugar-acid ratio also promoted the formation of anthocyanins;with the maturity of the fruits,anthocyanins content increased gradually,and in bright blue period reached the highest 150.54mg in 100g fruit.The anthocyanin of all those four harvest times of Northcountry fruits had excellent antioxidant activities,and the anthocyanins content was positively correlated with the antioxidant activity.In Northcountry bilberry bright blue period,the antioxidant activity such as DPPH free radical-scavenging power assay,reducing power assay and their scavenging power assay on lipid peroxidation,·OH and O2-·were highest.The scavenging power assay on lipid peroxidation and·OH of cultivated bilberry variety Northcountry fruits was higher than VC.
bilberry;maturity stage;anthocyanins;antioxidant activity
TS201.2
A
1002-0306(2012)07-0130-05
2011-06-10
吕春茂(1970-),男,副教授,研究方向:食品生物技术。
沈阳市青年人才基金计划项目(1081240-1-02);沈阳农业大学博士后科研基金。
