蒲公英糖蛋白的分离纯化及结构分析
2012-11-02杜晓旭段玉峰邹柯婷
杜晓旭,钟 洁,段玉峰,邹柯婷,杨 闻
(陕西师范大学食品工程与营养科学学院,陕西西安710062)
蒲公英糖蛋白的分离纯化及结构分析
杜晓旭,钟 洁,段玉峰*,邹柯婷,杨 闻
(陕西师范大学食品工程与营养科学学院,陕西西安710062)
通过DEAE-52纤维素柱层析和Sephadex G-100葡聚糖凝胶层析手段分离纯化,从蒲公英中分离纯化得到三种蒲公英糖蛋白(TMGP)-a、b、c,采用薄层层析法对其纯度进行鉴定,结果显示三种成分均为均一组分。经分析,蒲公英糖蛋白粗品TMGP和均一品TMGP-a、TMGP-b、TMGP-c中多糖的含量为79.12%、71.23%、70.25%、74.35%;蛋白质的含量为:13.35%、19.79%、20.78%、17.60%。β-消除反应说明三种蒲公英糖蛋白均一品都含有O-连接型糖蛋白。经红外光谱分析,TMGP-a糖蛋白可能含有少量硫酸基;TMGP-b糖链中可能是硫酸化多糖;TMGP-c含有吡喃糖β-糖苷键。
蒲公英,糖蛋白,分离,纯化,结构分析
蒲公英糖蛋白粗制品 实验室自制;DEAE-52纤维素、SephadexG-100 英国Whatman产品;葡萄糖、正丁醇、95%乙醇、无水乙醇、丙酮、氯仿、苯酚、乙醚、氢氧化钠、双氧水、硫酸等 均为国产分析纯。
DBS-100型电脑全自动部分收集器、DHL-A型电脑恒流泵 上海沪西分析仪器厂;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;800B型离心机上海安亭科学仪器厂;微量移液器 日本NICHIRYO公司;半微量凯氏定氮蒸馏装置 上海贝特仪电设备厂;T6型紫外可见分光光度计 北京普析通用仪器有限公司;EQUINX55型傅立叶变换红外光谱仪德国Brucher公司;层析柱(2.6cm×80cm和1.5cm× 50cm) 北京昌阳永川实验器材销售中心。
1.2 实验方法
1.2.1 蒲公英糖蛋白粗品纯化[5-6]取蒲公英糖蛋白粗品0.5g,用10mL蒸馏水完全溶解,上DEAE-52纤维素柱(2.6cm×80cm),洗脱速度为0.5mL/min,依次用0.1、0.2、0.3、0.5mol/L的NaCl溶液洗脱,用部分收集器收集,每管收集10mL。紫外可见分光光度计检测280nm处蛋白质吸收峰,同时各管用苯酚-硫酸法检测490nm处糖吸收峰,以洗脱管数为横坐标,吸光度值为纵坐标,做洗脱曲线,收集蛋白质和多糖重合的峰,收集液浓缩,透析、冷冻干燥。
取上述所得蒲公英糖蛋白5mg,用蒸馏水配成浓度为0.5mg/mL的样品溶液,上Sephadex G-100凝胶层析柱(1.5cm×50cm),用0.1mol/mL NaCl作为洗脱液,洗脱速度为0.5mL/min。每管收集10mL,紫外可见分光光度计检测280nm处蛋白质吸收峰,同时用苯酚-硫酸法检测490nm处糖吸收峰,收集蛋白和多糖重叠的峰,收集液浓缩,透析、冷冻干燥。
1.2.2 蒲公英糖蛋白的纯度鉴定[7]采用薄层层析法。
1.2.3 蒲公英糖蛋白的理化性质测定
1.2.3.1 蒲公英糖蛋白的蛋白含量和糖含量测定蛋白质含量测定用凯氏定氮法[8]。糖含量测定采用苯酚-硫酸法[9],以葡萄糖为标准糖。
1.2.3.2 蒲公英糖蛋白的定性实验[10]定性实验:颜色、状态、溶解性、菲林试剂反应、三氯化铁反应、碘-碘化钾反应、CTAB络合反应、双缩脲反应。
1.2.4 蒲公英糖蛋白的紫外光谱分析[11]取蒲公英糖蛋白均一品,用蒸馏水溶解,再分成两等份,其中一份加入1.5mL蒸馏水,另一份加入1.5mL 0.4mol/L NaOH溶液,测反应开始和结束时(2h)的紫外吸收光谱,并记录开始与结束时240nm处的吸光值。
1.2.5 蒲公英糖蛋白的红外光谱分析[12]将样品和KBr置于玛瑙研钵内,研细混合均匀,取少许放在模具中压片,于红外光谱仪测定样品在500~4000cm-1区间的透光率。
2 结果与分析
2.1 蒲公英糖蛋白的纯化
2.1.1 DEAE-52离子交换层析 蒲公英糖蛋白粗品经过DEAE-52离子交换柱分离,洗脱结果如图1~图4所示。
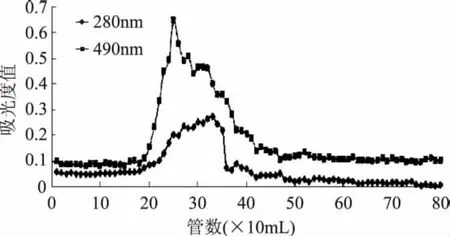
图1 DEAE-52柱层析0.1mol/L NaCl洗脱曲线Fig.1 Elution curve by 0.1mol/L NaCl on DEAE-52 column
由图1~图3可知,蒲公英糖蛋白粗品在DEAE-52柱上分别利用0.1、0.2、0.3mol/L NaCl溶液洗脱得到了有效地分离,有明显的多糖和蛋白重叠峰,收集多糖和蛋白重叠的高峰部分,浓缩、透析、冻干得蒲公英糖蛋白分别命名为TMGP-1、TMGP-2、TMGP-3。
由图4可以看出,没有较大的蛋白质和多糖的重叠吸收峰,本次实验没有收集,也没有做进一步的研究。
2.1.2 Sephadex G-100凝胶层析 将上述糖蛋白溶解后经Sephadex G-100凝胶层析柱进一步分离纯化,洗脱结果如下:经DEAE-52柱层析所分离纯化后的TMGP-1在Sephadex G-100柱层析过程中第5~15管出现了一个重叠、对称的吸收峰,收集多糖和糖蛋白重叠的主峰部位,得到蒲公英糖蛋白均一品命名为TMGP-a,经浓缩、透析、真空冷冻干燥后得到糖蛋白的质量为4.17mg,得率为83.4%;经DEAE-52柱层析所分离纯化后的TMGP-2在Sephadex G-100柱层析过程中第10~25管出现了一个重叠、较对称吸收峰,收集多糖和糖蛋白重叠的主峰部位,得到糖蛋白均一品命名为TMGP-b,经浓缩、透析、真空冷冻干燥后得到糖蛋白的质量为4.05mg,得率为81%;经DEAE-52柱层析所分离纯化后的 TMGP-3在Sephadex G-100柱层析过程中第10~20管呈现了单一对称吸收峰,说明TMGP-3经DEAE-52柱层析中得到了有效分离,收集主峰部位,经浓缩、透析、真空冷冻干燥得糖蛋白均一品命名为TMGP-c,质量为4.27mg,得率为85.4%。

图2 DEAE-52柱层析0.2mol/LNaCl洗脱曲线Fig.2 Elution curve by 0.2mol/L NaCl on DEAE-52 column

图3 DEAE-52柱层析0.3mol/L NaCl洗脱曲线Fig.3 Elution curve by 0.3mol/L NaCl on DEAE-52 column
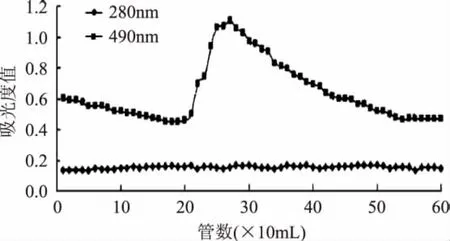
图4 DEAE-52柱层析0.5mol/LNaCl洗脱曲线Fig.4 Elution curve by 0.5mol/L NaCl on DEAE-52 column
2.2 蒲公英糖蛋白的纯度鉴定
蒲公英糖蛋白TMGP-a的薄层层析结果显示,以氨制硝酸银喷雾显色,有浅褐色斑点,因为多糖与氨制硝酸银可以发生银镜反应,可证明其中含有多糖;用水合茚三酮喷雾显色,有紫色斑点,证明其中含有蛋白质成分;用20%硫酸喷雾,有一褐色斑点,蒲公英糖蛋白被硫酸氧化。测得Rf值分别为0.49、0.46、0.45,因此证明该组分是一种糖蛋白均一品。蒲公英糖蛋白TMGP-b、TMGP-c薄层层析图也出现了与TMGP-a一样的现象,因此可以证明TMGP-b和TMGP-c两种组分也是糖蛋白均一品。
2.3 蒲公英糖蛋白的理化性质
蒲公英糖蛋白粗品和蒲公英糖蛋白均一品TGM-a、b、c的理化性质测定结果见表1。
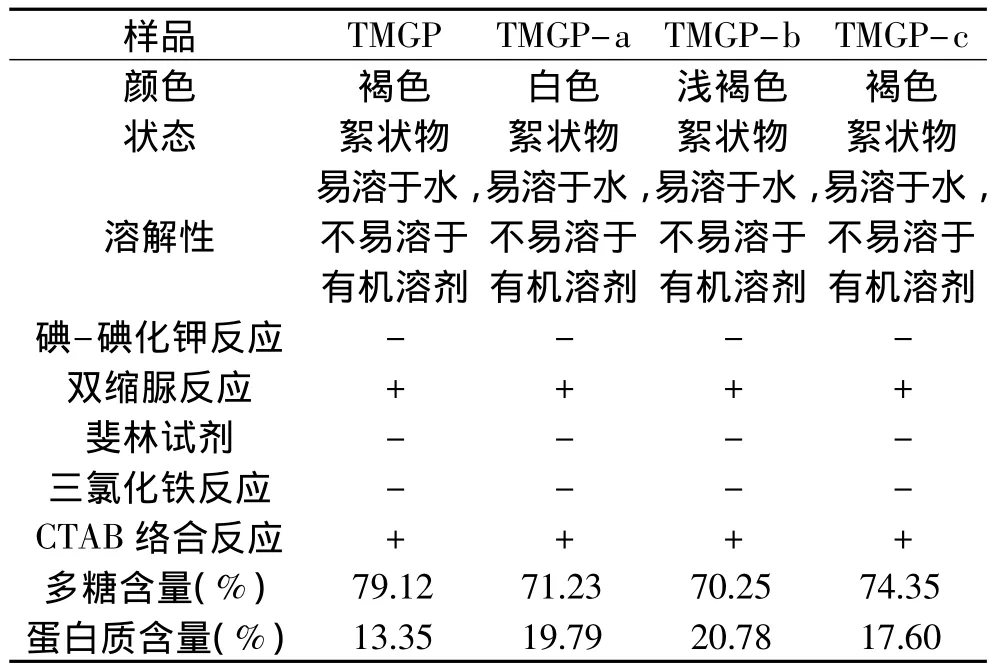
表1 TMGP的理化性质Table 1 Physicochemical characteristics of TMGP
由表1可知,蒲公英糖蛋白均易溶于水,不溶于有机溶剂。双缩脲反应和CTAB络合反应均为阳性,与碘-碘化钾反应、斐林试剂反应、三氯化铁反应都呈阴性,说明蒲公英糖蛋白是非淀粉类多糖,双缩脲反应呈阳性,说明含有蛋白质成分。
2.4 蒲公英糖蛋白红外光谱分析
TMGP-a的红外光谱图分别在 3410.18、2923.29、2856.67、1626.51、1353.42、1230.05、1023.24、611.68cm-1处有吸收峰;TMGP-b的红外光谱图分别在 3437.18、2922.69、2847.28、1629.57、1353.64、1273.45、1032.13cm-1处有吸收峰;TMGP-c的红外光谱图分别在3425.70、2922.75、2312.39、1627.06、1332. 66、1022.84、890.31、599.01cm-1处有吸收峰。
由蒲公英糖蛋白的红外图谱得知:蒲公英糖蛋白均一品 TMGP-a、b、c分别在3425、2922、1640、1352、1022cm-1附近都有吸收峰,这些区域的吸收峰都是多糖和蛋白分子的特征吸收峰。其中在3425cm-1左右吸收峰是羟基O-H的伸缩振动[13],由于分子内羟基间形成氢键而使吸收峰变宽;在2922cm-1左右较弱的吸收峰是糖的C-H伸缩振动所引起;在1640cm-1附近出现的吸收峰是C=0(羧基或酰胺羰基)伸缩振动和 N-H变角振动[14],在1400cm-1左右较弱的吸收峰是C-H变角振动吸收;在1000~1022cm-1处出现的吸收峰为C-O键吸收峰,表明三种糖蛋白分子都含有吡喃环[15]。TMGP-a在1230cm-1处的较弱吸收峰可能是S=O的伸缩振动吸收,表明该糖蛋白可能含有少量硫酸基;TMGP-b在1353、1273cm-1处的较弱吸收峰分别是磺酰基和硫酸基中S=O的伸缩振动吸收,说明糖链中可能是硫酸化多糖;TMGP-c在890cm-1处有特征吸收峰,表明其糖链是与β-糖苷键相连。
2.5 蒲公英糖蛋白紫外光谱分析
蒲公英糖蛋白的紫外图谱显示,TMGP-a、TMGP-b、TMGP-c三组分在280nm左右有一明显的尖形峰,此峰是糖蛋白最明显的特征吸收峰。三种组分的β-消除反应前后在240nm处的吸光度值发生变化,从而可以说明蒲公英糖蛋白 TMGP-a、TMGP-b、TMGP-c经过NaOH处理之后,在240nm处产生明显吸收,说明三种蒲公英糖蛋白均一品中都含有O-糖肽键,这是因为在稀氢氧化钠溶液作用下,O-型糖肽键可以发生β-消除反应,与糖链连接的丝氨酸转化成ɑ-氨基丙烯酸,而苏氨酸则可以转化成ɑ-氨基丁烯酸,所形成的不饱和氨基酸就会在240nm处有显著的吸收。
3 结论
本实验采用 DEAE-52纤维素柱层析和Sephadex G-100葡聚糖凝胶层析分离纯化手段,从蒲公英中纯化得到三种糖蛋白TMGP-a、b、c,采用凝胶柱层析和薄层层析法对其纯度进行鉴定,结果显示三种成分均为均一组分。通过各种理化性质的检验,证明蒲公英糖蛋白里不含有淀粉。蒲公英糖蛋白粗品TMGP和纯品TMGP-a、TMGP-b、TMGP-c当中多糖的含量为79.12%、71.23%、70.25%、74.35%;蛋白质的含量为13.35%、19.79%、20.78%、17.60%。通过红外光谱分析可知,蒲公英糖蛋白纯品TMGP-a、b、c分别在3425、2922、1640、1352、1022cm-1附近都有吸收峰,这些区域的吸收峰都是多糖和蛋白分子的特征吸收峰。TMGP-a在1230cm-1处的较弱吸收峰可能是S=O的伸缩振动吸收,表明该糖蛋白可能也含有少量硫酸基;TMGP-b在1353、1273cm-1处的较弱吸收峰分别是磺酰基和硫酸基S=O的伸缩振动吸收,说明可能是硫酸化多糖;TMGP-c在890cm-1处有特征吸收峰,表明其糖链是与β-糖苷键相连。
[1]肖玫,朱铭亮.蒲公英的营养价值及其开发利用[J].中国食物与营养,2005,26(4):47-48.
[2]许丹,候凤飞,吴立军.蒲公英的化学研究[J].中国中药杂志,2004,29(3):229-230.
[3]Cai Yizhong,Luo Qiong,et al.Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal Plants associated with anticancer[J].Life Science,2004,74:2157-2184.
[4]黄梅,王学军,杨凯.中药抗氧化成分及抗氧化活性的体外评价方法[J].重庆科技学院学报,2006,8(3):109-112.
[5]闰吉昌,崔春月,张奕,等.芦荟多糖的分离纯化及结构分析[J].高等学校化学学报,2003,24(7):1189-1192.
[6]李亚娜,赵谋明,彭志英.甘薯糖蛋白的分离、纯化及其降血脂功能[J].食品科学,2003,24(l):118-121.
[7]丁青芝,马海乐,骆琳,等.山药糖蛋白的分离纯化与鉴定[J].食品科学,2008,29(7):217-220.
[8]陈智慧,史梅,王秋香,等.用凯氏定氮法测定食品中的蛋白质含量[J].新疆畜牧业,2008,10(5):124-129.
[9]钟世红,卫莹芳,古锐,等.苯酚-硫酸比色法测定红毛五加皮多糖的含量[J].时珍国医国药,2010(2):266-267.
[10]Akihiro Nakamura,Hitoshi Furuta,Masayoshi Kato,et al. Effect of soybean soluble polysaccharides on the stability of milk protein under acidic conditions[J].Food Hydrocolloids,2003,17: 333-343.
[11]张龙翔.生化实验方法与技术[M].北京:高等教育出社,1997:138-140.
[12]李燕,吴然然,于佰华,等.红外光谱在中药定性定量分析中的应用[J].光谱学与光谱分析,2006(10):1846-1849.
[13]刘明杰,王钊,孙素琴.傅里叶变换红外光谱法在药学研究中应用的最新进展[J].药物分析杂志,2001(5):373-377.
[14]李宁.近红外傅立叶变换拉曼光谱定量分析应用基础的研究[D].北京:中国农业大学,2003.
[15]杨海雷.近红外光谱技术在中药质量分析中的若干应用研究[D].杭州:浙江大学,2005.
Isolation,purification and analysis of glycoprotein from Taraxacum mongolicum
DU Xiao-xu,ZHONG Jie,DUAN Yu-feng*,ZOU Ke-ting,YANG Wen
(College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi’an 710062,China)
Three fractions named respectively TMGP-a,TMGP-b,TMGP-c were isolated and purificated from Taraxacum mongolicum by using EDAE-52 cellulose and SephadexG-100 column chromatography.The purity was identified by thin layper chromatography(TLC),and the results showed that three components were all homogeneous.Taraxacum mongolicum glycoprotein crude TMGP and pure TMGP-a,TMGP-b,TMGP-c,which polysaccharide content of 79.12%,71.23%,70.25%,74.35%,protein content:13.35%,19.79%,20.78%,17.60%. β-elimination reaction indicated the linkagetype of three Taraxacummong Dlicum glycoprotein was o-glycoside linkage.The infrared spectrum analysis,TMGP-a glycoprotein might contain a small amount of sulfate,TMGP-b sugar chain might be sulfated polysaccharide sugar,TMGP-c was pyranose β-glycoside linkage.
Taraxacum mongolicum;glycoprotein;isolation;purification;structure analysis
TS201.2
A
1002-0306(2012)08-0198-04
蒲公英(Taraxacum mongolicum)别名蒲公草、黄花地丁、婆婆丁、黄花三七,属菊科多年生草本植物[1]。这种植物营养丰富,含有蛋白质、脂肪、碳水化合物、微量元素及维生素等[2];药用价值也高,具有抗肿瘤、降血压、免疫调节、抗菌、抗衰老等作用[3]。目前对蒲公英的研究仅限于蒲公英的总黄酮、酚酸类和绿原酸等活性物质[4]及蒲公英糖蛋白的提取工艺和抗氧化活性,国内外对于蒲公英糖蛋白的结构研究未见报道。本实验研究了蒲公英糖蛋白的纯化方法,对糖蛋白的结构进行了初步分析,以期为蒲公英的综合开发利用奠定理论基础。
1 材料与方法
1.1 材料与仪器
2011-07-27 *通讯联系人
杜晓旭(1988-),女,硕士,研究方向:天然活性产物。
陕西省自然科学基础研究计划项目(2006B18)。
