双层膜放大的电流型癌胚抗原免疫传感器的研究
2012-11-02王丽孙涛谭超
王丽,孙涛,谭超
(宜宾学院化学与化工学院,宜宾644007)
癌胚抗原(CEA)是分子量为150~300kD的可溶性糖蛋白,主要是由胎儿时期的内胚层衍出而来的胃肠道及肝胰合成,是国际公认的肿瘤标志物之一,目前被普遍应用于恶性肿瘤的辅助诊断、疗效评价和检测复发[1]。健康成人的血清CEA浓度在2.5ng/mL以下,如果血液中CEA浓度突然升高至此值以上,往往与肺癌、乳腺癌、卵巢癌、膀胱癌、肝硬化及肝炎等疾病有很大的关系[2]。因此,建立一种快速,准确的方法来检测血液中CEA的含量显得尤为重要。在众多的方法中,电流型免疫传感器由于它检测限低、操作简单和灵敏度高等优点而倍受人们的青睐[3]。
普鲁士蓝(prussian blue,PB),因其具有化学稳定性高、电化学可逆性好、成本低制备简单等特点而引起研究人员的高度重视,在电催化、生物传感器、电显色、二次电池[4-7]等方面应用广泛。此外,由于其对过氧化氢具有良好的催化还原作用,被称为“人造过氧化氢酶”[8]。然而,电子媒介体的渗漏是目前制约电流型传感器发展的一个主要问题。近年来,已有研究[9-11]通过交联,与其他材料复合等方法来克服这个缺点。
纳米颗粒由于具有比表面积大,吸附能力强,生物相容性好等优点,已被广泛用于吸附固定生物分子,基于纳米材料的固载基质制备传感器已成为传感器领域的研究热点。纳米铂,作为典型的金属纳米粒子,除了具有一般纳米颗粒所拥有的优点外,还具有独特的催化还原H2O2的性能。Zou Y等[12]利用纳米铂修饰的碳纳米管制备了葡萄糖生物传感器,该电极对H2O2呈现了高的电催化活性和稳定性,Chu X等[13]制备了基于纳米铂/纳米金和碳纳米管的电流型生物传感器。
本文以普鲁士蓝/纳米铂复合物膜作为固载基质,采用辣根过氧化物酶(HRP)代替常用的牛血清白蛋白(BSA)封闭非特异性吸附位点[14-15],研制高灵敏的电流型癌胚抗原免疫传感器。由于HRP和普鲁士蓝/纳米铂复合物膜对H2O2具有良好的电催化活性,因此它们放大了电流响应信号和提高了免疫电极的灵敏度。
1 实验部分
1.1 主要仪器和试剂
CHI 600B型电化学工作站(上海CHI公司);B204-S电子天平(瑞士 Metter Toledo公司),BRANSONIC200超声清洗仪(德国BRANSONIC ULTRASCHALL公司)。氯铂酸(美国Sigma公司);辣根过氧化物酶(HRP,上海丽珠东风生物技术公司);癌胚抗体(anti.CEA)、癌胚抗原(CEA)和甲胎蛋白抗原(AFP)(郑州博赛生物技术研究所),其他试剂均为分析纯,所用水均为二次水。
不同pH的磷酸缓冲溶液(PBS)用0.1mol/L KH2PO4和0.1mol/L Na2HPO4配制,支持电解质为0.1mol/L KCl。
1.2 免疫传感器的制备
将金电极(Ф=4mm)依次用0.3mm和0.05 mm的A12O3粉抛光使成镜面,然后依次用蒸馏水、无水乙醇和蒸馏水超声清洗。随后把电极置于0.5mol/L的硫酸溶液中在-0.4~1.5V 电位范围内进行循环伏安扫描至稳定。
将预处理的Au电极放入新配的2.5mmol K3Fe(CN)6+2.5mmol FeCl3+0.1mol/L KCl和0.1mol/L HCl中,在恒电位+0.4V下沉积80s,二次水冲洗,然后将其放入0.1mol/L HCl/0.1 mol/L KCl溶液中,在-50~350mV的电位范围内以扫速50mV/s进行循环伏安扫描50圈,室温晾干即得PB修饰电极(PB/Au)[16],再将修饰电极置于2.0mmol/L H2PtCl6中,以饱和甘汞电极为参比电极,铂丝为对电极于-0.2V下电沉积30s,取出,水洗,得纳米铂修饰电极(Pt/PB/Au)[17]。然后将纳米铂修饰电极(Pt/PB/Au)置于癌胚抗体中于4℃过夜。最后,将已制好的电极浸在HRP(2 mg/mL,pH6.0的PBS)中约2h,以封闭非特异性结合位点。
将制备的电极悬于缓冲液上方,在4℃下保存备用。
1.3 测定方法
本实验采用三电极体系:免疫电极为工作电极,铂丝电极作为对电极,饱和甘汞电极(SCE)作为参比电极。利用循环伏安法(CV)进行电极制备过程的表征。循环伏安法电位区间为-0.2~0.5V,扫速为50mV/s。
进行免疫测定时,将修饰有抗体的工作电极置于不同浓度的抗原溶液中孵育10min(25℃),测试底液为5mL 0.1mol/L(PBS pH=6.5)+ 2.8 mmol/L H2O2,以循环伏安法检测 CEA 的浓度。电位扫描速度为50mV/s,除特别说明,温度均控制为(25±0.5)℃。
2 结果与分析
2.1 电极在自组装过程中的电化学表征
本文采用循环伏安(CV)考察免疫电极在组装过程的电化学性质。
图1为不同修饰电极沉积普鲁士蓝后的CV图。

图1 不同修饰电极的循环伏安图Fig.1 Cyclic voltammograms of the electrodes at different stages
由图1可见:修饰电极在PBS pH=6.5缓冲溶液中呈现出一对可逆的氧化还原峰(图1a),这表明普鲁士蓝是一种良好的电子媒介体。当纳米铂粒子沉积到电极后,氧化还原峰电流值有所下降(图1b),原因可能是因为形成了一层纳米铂粒子层,它的存在增加了电极表面膜的厚度,阻碍了电子的传递。特别是当修饰电极依次吸附anti-CEA,辣根过氧化物酶(HRP)后,电流进一步降低(图1c),这是由于大分子抗体和辣根过氧化物酶是非导电性物质,阻碍了电子的传输。
图2是纳米铂/普鲁士蓝复合物修饰电极连续扫描20圈的循环伏安图。图2显示:氧化还原峰电流基本没有发生变化,表明纳米铂/普鲁士蓝复合物的形成一定程度上抑制了PB的泄漏。

图2 Pt/PB/Au电极连续扫描的循环伏安图Fig.2 Cyclic voltammograms of the Pt/PB/Au electrodes at continuous scan
为了解修饰电极的反应过程,实验考察了峰电流大小与扫描速率的关系,结果如图3所示。图3显示:扫速在30~400mv/s范围内,随着扫描速度的不断增加,峰电流值也逐渐增加,且氧化还原峰峰电流值与扫描速率的平方根成正比(v1/2),表明电极氧化还原反应是受扩散控制的过程。
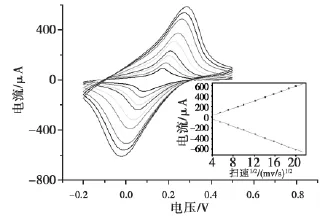
图3 免疫电极的扫速图Fig.3 Cyclic voltammograms of the modified electrodes at different Scan rates
2.2 免疫电极的催化特性
本实验利用CV技术考察了免疫电极的电化学催化特性。图4为修饰电极在pH 6.5磷酸缓冲溶液中对H2O2的电化学催化响应图。
由图4可知:在加入H2O2之前,CV图表现出一对较好的氧化还原峰(图4a);当加入2.8mmol/L H2O2后,氧化峰电流明显减小,还原峰电流显著增加(图4b),表明修饰电极对H2O2有良好的电催化还原性能,同时也说明该免疫传感器在底液中加入H2O2确实有效的放大了电流响应信号,增加了免疫电极的灵敏度。
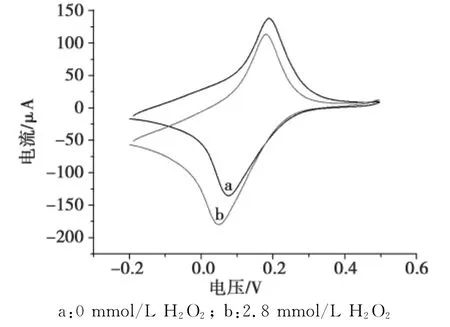
图4 免疫电极的循环伏安图Fig.4 Cyclic voltammograms of the immunosensor
2.3 实验条件的优化
考察H2O2含量对电极响应性能的影响,结果如图5所示。
图5显示:当 H2O2的浓度小于2.8mmol/L时,随着H2O2的浓度的增加,还原峰电流迅速增加,然后趋向于稳定,这表明H2O2的量在电极表面已经达到饱和。因此,在本实验中H2O2的量选择为2.8mmol/L。
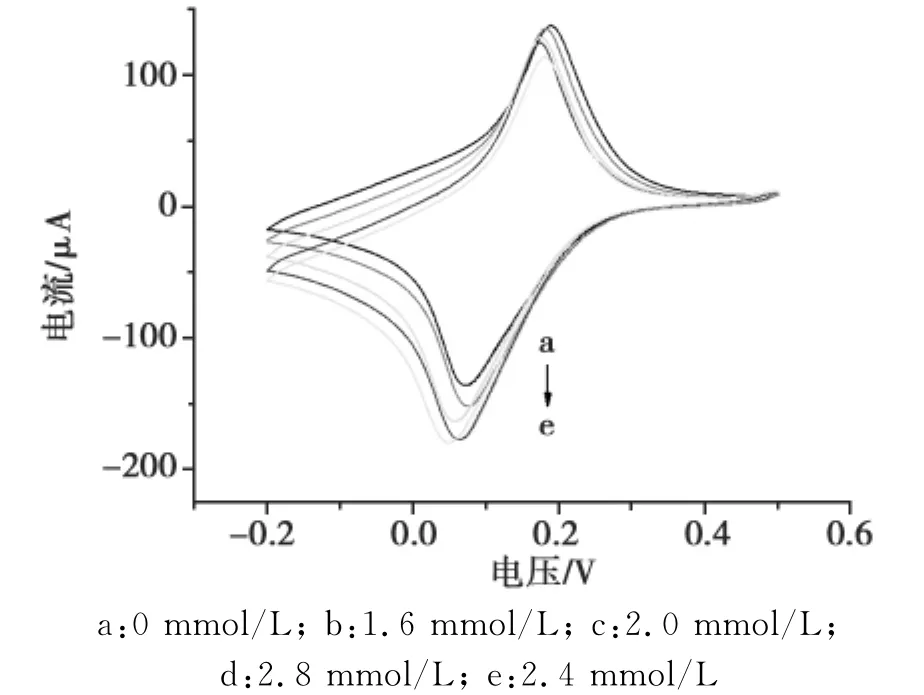
图5 H2O2含量对免疫电极的影响Fig.5 Influence of the amount of H2O2on the sensor response
由于PB的沉积时间对免疫传感器的性能与有直接的关系,因此本文采用CV法考察PB沉积不同的时间对免疫电极响应信号的影响,结果见图6。
从图6可以看出:随着PB沉积时间从20-80s,氧化还原峰的电流逐渐增加,80s时响应电流最大。继续增加PB沉积时间到100s,虽然氧化还原峰的电流增加,但是峰形和峰的可逆性变差。因此,80s是PB的最优沉积时间。

图6 普鲁士蓝的沉积时间对免疫电极的影响Fig.6 Effect of the depositional time of prussian blue on the response of the immunoelectrode
2.4 免疫传感器的响应特性
在最优的实验条件下,采用循环伏安法测定免疫电极对CEA的校正曲线,结果如图7所示。
从图7可以看出:CEA的浓度在1.0~80.0 ng/mL的范围内与单位面积峰电流呈良好的线性关系。其线性方程为y=0.2802x-128.06,相关系数为0.9951,检测线为0.4ng/mL。

图7 免疫电极的校正曲线Fig.7 Calibration curves for the immunoelectrode
该免疫传感器的测定原理是:(1)纳米铂、普鲁士蓝、HRP同时催化了H2O2的还原,显著放大了电流信号;(2)当抗原与抗体特异性结合后,其复合物形成的空间位阻影响了HRP的催化活性中心,同时也阻碍了普鲁士蓝的氧化还原反应,并且随着抗原浓度的增加氧化还原峰电流逐渐减小。
2.5 免疫传感器的选择性、重现性和稳定性
实验后将传感器于4℃下悬于pH 6.5磷酸缓冲液上方放置1d后,峰电流降低了3.5%,1个月后仅降低了4.9%。表明该免疫电极稳定性良好。
分别取不同批次制备的4支免疫传感器,对60 ng/mL的CEA标准溶液进行检测,其电流响应值的相对标准偏差小于7.5%。表明免疫传感器有良好的重现性。
将修饰好的电极分别置于含有60ng/mL CEA抗原的标准溶液和含有相同CEA浓度以及不同的干扰物质(HCG和AFP)溶液中孵育10min,分别记录响应电流值。结果显示,2次测量结果的偏差小于4.1%。这表明该免疫传感器具有良好的选择性。
3 结语
本文利用普鲁士蓝/纳米铂复合物膜为固载基底、癌胚抗体为模板免疫分子,成功构建了高灵敏的电流型癌胚抗原免疫传感器,与其他传统方法相比,该方法是有以下优势:
(1)纳米铂的引入不仅增加了抗体的固定量,而且它与普鲁士蓝均可直接催化还原H2O2,增强了电流响应信号提高了免疫传感器的灵敏度。
(2)与BSA相比,HRP的引入除了能封闭电极表面的活性位点外,还可以直接催化H2O2,进一步提高电极灵敏度。
(3)在优化的实验条件下,CEA的浓度在1.0~80.0ng/mL的范围内与单位面积峰电流呈良好的线性关系,相关系数为0.9951,检测线为0.4ng/mL。
(4)该传感器制备方法简单,成本低、灵敏度高、选择性好,有望用于临床样品分析。
[1]Chen Y w,Xiao H L,Tan C,et al.Clinical application and evaluation of carcinoembryonic antigen detection in serum by timed-resolved fluoroimmunoassay[J].The Practical Journal of Cancer,2002,17(2):116-118.
[2]肖华龙,黄飚,朱利国,等.CEA时间分辨荧光免疫分析[J].标记免疫分析与临床,2007,7(1):25-28.
[3]Jia J B,Wang B Q,Wu A,et al.A Method to Construct a Third-Generation Horseradish Peroxidase Biosensor:Self-Assembling Gold Nanoparticles to Three-Dimensional Sol-Gel Network[J].Anal.Chem,2002,74(9):2217-2223.
[4]Chiao F L,Chih Y H,Hwa C L,et al.A complementary electrochromic system based on a Prussian blue thin film and a heptyl viologen solution[J].Solar Energy Materials and Solar Cells,2011,11(95):3074-3080.
[5]Dai Y X ,Cai Y Y ,Zhao Y F,et al.Sensitive sandwich electrochemical immunosensor for on prussian blue modified hydroxyapatite[J].Biosens.Bioselectron,2011,28(1):112-116.
[6]Shi C G,Xu J J,Chen H Y.Prussian Blue/CdS Nanocomposite:Enhanced Electrochemiluminescence and Application in H2O2[J].Chinese Journal of inorganic chemistry,2011,27(10):2005-2012.
[7]Moscone D,Ottavi D,Compagnone D,et al.Construction and Analytical Characterization of Prussian Blue-Based Carbon Paste Electrodes andTheir Assembly as Oxidase Enzyme Sensors[J].Anal Chem,2001,73(11):2529-2535.
[8]Ricci F,Palleschi G.Sensor and biosensor preparation,optimisation and applications of Prussian Blue modified electrodes[J].Biosens.Bioelectron,2005,21(3):389-407.
[9]李丽花,徐琴,王海燕,等.普鲁士蓝-多壁碳纳米管复合材料修饰电极测定过氧化氢[J].分析化学,2007,35(6):6835-838.
[10]党艳艳,李春,张根林,等.层柱粘土载体的制备、表征及固定β-D-葡萄糖醛酸苷酶的研究[J].石河子大学学报:自然科学版,2010,28(3):357-359.
[11]姜海荣,宋丽军,肖建,等.超临界二氧化碳条件下LOX酶分子的特性及其构象影响[J].石河子大学学报:自然科学版,2010,28(2):215-220.
[12]Zou Y,Xiang C,Sun L,et al.Glucose biosensor based on electrodeposition of platinum nanoparticles onto carbon nanotubes and immobilizing enzyme with chitosan-SiO2 sol-gel[J].Biosens Bioelectron,2008,23:1010-1016.
[13]Chu X,Duan D,Shen G,et al.Amperometric glucose biosensor based on electrodeposition of platinum nanoparticles onto covalently immobilized carbon nanotube electrode[J].Talanta,2007,71:2040-2047.
[14]Li N,Yuan R,Cai Y Q,et al.New antibody immobilization strategy based on gold nanoparticles and Azure I/multi-walled carbon nanotube composite membranes for an amperometric enzyme immunosensor[J].Phys Chem C,2007,111(24):8443-8450.
[15]Zhuo Y,Yi W J,Lian W B,et al,Ultrasensitive electrochemical strategy for NT-proBNP detection with gold nanochains and horseradish peroxidase complex amplification[J].Biosens Bioelectron,2011,26(5):2188-2193.
[16]Mattos L,Gorton L,Lanrell T,et al.Development ofbieseusors based on hexacyanoferrates[J].Talanta,2000,52(5):7 91-799.
[17]Salih Z B,Handan G,Salih Y.Amperometric xanthine biosensors based on electrodeposition of platinum on polyvinylferrocenium coated Pt electrode[J].Journal of Molecular Catalysis B:Enzymatic,2011,72:282-288.
