一株低温产甲烷菌的筛选分离与系统发育分析研究
2012-11-02张硕叶尔买克鲁建江
张硕,叶尔买克,鲁建江
(1石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室,石河子832003;2阿拉山口出入境检验检疫局技术中心,阿拉山口833418)
产甲烷菌作为一类极端厌氧古菌,存在各类生境和极端环境中。最早研究起始于19世纪末,直到20世纪50年代Hungate厌氧技术[1]的出现,才使厌氧分离产甲烷菌得到发展,陆续分离出多种产甲烷菌。我国的研究起步较晚,20世纪90年代开始陆续分离出多株产甲烷菌。随着生物技术快速发展,那些能够耐极端环境生存的产甲烷菌越来越受到重视,冻土、苔原、湖底污泥、火山温泉等都曾有报道分离出各种嗜冷、嗜热,耐盐产甲烷古菌[2]。产甲烷菌作为自然界碳素循环中生物链的最后一环,只能利用低分子量的有机物,生成甲烷作为代谢的最终产物,温室气体排放到大气中[3]。沼气发酵产生的甲烷气,同时也是一种清洁能源,对于有机废水和固体垃圾处理的可再生利用具有重要意义。沼气发酵是一个极其复杂微生物代谢过程;影响沼气发酵最大因素是温度的波动和温度的过低。通常冬季气温下降,会导致沼气产量较低,限制了沼气工程的推广和发展。低温厌氧发酵与中温和高温厌氧发酵过程相比,在能量盈余方面具有相当大的优势[4]。然而,对于低温厌氧发酵微生物菌群耐冷的生物学机制和生理学研究较少[5]。本文立足低温厌氧发酵,从新疆越冬沼气池筛选分离获得一株产甲烷菌株SZ-3,兼性嗜冷,且低温和中温条件下都能够产气,对其进行了生物学特性研究和系统发育学分析,并确立了菌株的遗传学地位,这项工作为后续低温耐冷厌氧发酵机理和菌群互营共生关系研究奠定了基础,同时获得优良低温产甲烷菌菌种资源,对于解决冬季沼气池低温发酵具有理论指导意义。
1 材料与方法
1.1 材料
1.1.1样品来源
污泥样品采自新疆越冬沼气池,用灭菌后250 mL厌氧瓶取样,厌氧瓶中充满高纯氮气作为保护气。样品取回后放4℃冰箱密闭储存[6]。
1.1.2培养基和培养条件
产甲烷菌无机盐培养基(1000mL):K2HPO40.4g,KH2PO40.4g,NH4Cl 1.0g,MgCl20.1g,酵母浸粉1.0g,L-半胱氨酸0.5g,10mL微量元素溶液,10mL维生素溶液,0.1%刃天青2.0mL(固体培养基添加2%琼脂)。培养基加热煮沸除去氧气,121℃高压灭菌15min;灭菌后放入厌氧培养箱,分装至20mL厌氧管和100mL血清瓶中。
(1)微量元素溶液(1000mL):MgSO4·7H2O 3g;MnSO4·2H2O 0.5g;NaCl 1g;FeSO4·7H2O 0.1g;CoCl2·6H2O 0.1g;CaCl2·2H2O 0.1g;ZnSO4·7H2O 0.1g;CuSO40.01g;KAl(SO4)2·12H2O 0.01g;H3BO30.01g;Na2MoO4·2H2O 0.01g;NiCl2.6H2O 0.025g;NaSeO 3.6 H2O 0.0003g[7]。
(2)维生素溶液(1000mL):硫胺素(B1)5.0g,泛酸钙5.0g,核黄素(B2)5.0g,生物素2.0g,叶酸2.0g,B120.1g,烟酸5.0g,对氨基苯甲酸5.0g,硫辛酸5.0g。
(3)碳源物质及还原剂:1%硫化钠,5%碳酸氢钠,2.5mol/L乙酸钠,25%甲酸钠,50%甲醇,30%甲胺,30%二甲胺,30%三甲胺。
产甲烷菌完全培养基(100mL):80mL产甲烷菌无机盐灭菌培养基,1%硫化钠,5%碳酸氢钠,2.5 mol/L乙酸钠,25%甲酸钠,50%甲醇,30%甲胺,30%二甲胺,30%三甲胺各2mL,顶部充满 H2/CO2(80∶20)混合气。
产甲烷菌纯度鉴定培养基(100mL):牛肉膏0.4g、胰蛋白胨1g、酵母膏1g、葡萄糖0.1g、纤维二糖0.1g、麦芽糖0.1g、可溶性淀粉0.1g、NaCl 0.05g、半胱氨酸0.05g、0.1%刃天青0.2mL、琼脂2g。
1.2 方法
1.2.1产甲烷菌的富集培养及分离纯化
采集的污泥样品,加入到产甲烷菌完全培养基中(15℃低温培养箱培养10d),第一次富集接种量10%,取菌液第二次富集,接种量2%,再进行第三次富集,气相色谱(Shimadzu GC 2010)测定产甲烷量达到最大,进行滚管分离,挑取菌落继续接种进行液体扩大培养,再次滚管分离,直到镜检观察菌体细胞形态一致且荧光显微镜下观察到菌体荧光形态,最后得到纯产甲烷菌株。产甲烷菌只能利乙酸、甲醇等简单小分子合成甲烷。将纯化后菌株接种到产甲烷菌纯度鉴定培养基中,15℃低温厌氧培养10 d,观察菌株是否生长,生长则表明该菌株不是产甲烷菌或含有互营共生的杂菌,需再纯化。
1.2.2低温产甲烷菌株筛选
纯化培养得到的产甲烷菌,能否适应低温条件需要进行筛选;将产甲烷菌株接种到pH 7.0产甲烷完全液体培养基中,5℃、20℃、30℃恒温厌氧培养10d,气相色谱测定产气情况,选择能够5℃低温产气良好,20℃、30℃产气效果依旧良好的为目的菌株。
1.2.3菌体形态观察及生理生化实验
菌株的生长曲线测定:厌氧条件下每天抽气和抽取培养液,测定菌株在最适培养条件下甲烷气产量和菌体生长量(OD值),以甲烷气产量(Y1)、菌体生长量(Y2)的对数值和时间绘制生长曲线。菌体形态学观察:采用日本尼康80i紫外荧光倒置显微镜,尼康倒置相差显微镜观察。取对数生长期样品8000r/min离心5min,少量磷酸缓冲液(PBS)悬浮,滴片至4~6mm玻片,自然干燥,即可进行观察。
最适温度、pH、NaCl浓度生长实验:在完全液体培养基中接种2%的菌株,厌氧培养箱(英国DWS公司)中恒温培养10d,气相色谱测定甲烷气产量。
生长底物:乙酸钠,甲酸钠,甲醇,甲胺,二甲胺,三甲胺,H2/CO2(80∶20)为单一的碳源,加入到灭菌后的产甲烷菌无机盐培养基中,pH7、20℃培养8 d测定是否产生甲烷气,鉴定菌株能否利用这种碳源[8]。
抗生素实验:添加四环素、青霉素、氯霉素、卡那霉素、链霉素五种抗生素3200U/mL,20℃、10d观察产甲烷菌的耐受性。
1.2.4 16SrDNA PCR扩增
DNA参照《精编分子生物学指南》中细菌基因组制备方法,引物[9]由大连宝生物公司合成PRA46F (5-C/TTAAGCCATGCG/AAGT-3 ),PREA1100R (5-T/CGGGTCTCGCTCGTT G/ACC-3);反应条件:95 ℃预变性5min,30个循环(95℃变性30s,54℃退火30s,72℃延伸1min),最后72℃延伸10min。l%的琼脂糖凝胶电泳,纯化回收PCR产物,连接到pGM-T载体上,转化到TOP10感受态细胞中进行克隆,回收质粒酶切验证;将PCR产物及质粒送交北京鼎国进行测序。
1.2.5系统发育分析
目的菌株片段DNA序列经测序后,提交到NCBI的GeneBank数据库,进行BLAST序列比对,将与之同源性较高的16SrDNA序列进行ClustalX多重序列比对,使用MEGA 4.1软件进行bootstrap分析,重复1000次,p-distance核酸模型,构建系统发育树[10-11]。
2 结果分析
2.1 低温产甲烷菌富集纯化及筛选
厌氧富集,亨盖特滚管分离和反复挑取菌落纯化,相差显微镜和荧光显微镜下(产甲烷菌辅酶F420受激发后发出绿色荧光)观察菌体细胞形态一致;后经过纯化鉴定获得两株纯产甲烷菌菌株SZ-1、SZ-3。低温筛选实验结果:SZ-1菌株不能适应低温生长环境,5℃、15℃低温条件下几乎不产气,30℃产气活力良好;SZ-3菌株在5℃、15℃、20℃低温条件下产气效果良好,30℃中温条件下仍能维持良好产甲烷气效果;因此SZ-3菌株符合筛选要求。
2.2 菌株形态特征及生理生化特性
SZ-3菌株显微镜下观察为革兰氏染色阳性,不运动,20℃培养10d长出菌落,菌落呈黄色,圆形,边缘整齐,紫外荧光倒置显微镜下观察发绿色荧光(图1a),相差显微镜下观察(图1b)为不规则球状,菌体聚集形成假胞体,不规则裂殖。

图1 菌株SZ-3紫外荧光显微镜和相差显微镜成像Fig.1 SZ-3UV fluorescence(a)and phase-contrast(b)micrograph
SZ-3菌株在pH值4~8均能生长,生长最适pH值为7(图2)。SZ-3菌株在5~40℃均能生长,20℃条件下产气量最大,菌株生长良好(图2)。SZ-3菌株在0~0.6mol/L NaCl浓度能够生长,高于0.6mol/L时产气停止,NaCl浓度0~0.4mol/L时产气量最大,菌株生长良好(图2)。
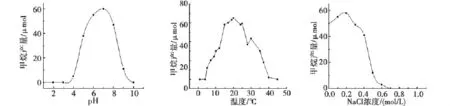
图2 不同pH﹑温度﹑NaCl浓度下的甲烷含量Fig.2 Methane production by strain SZ-3at different temperatures,pH values and NaCl concentrations
碳源底物实验结果表明,SZ-3菌株接种单一碳源的底物后,只能利用甲醇、H2/CO2(80∶20)混合气、甲胺、二甲胺、三甲胺,不能利用甲酸钠、乙酸钠等,且该菌株对5种抗生素均有耐受性。
SZ-3菌株生长曲线(图3)显示,第3天开始,产气量和活细胞数成对数级增长,第9天发酵液pH、底物浓度变化、产物积累抑制菌体生长,进入稳定期,第11天开始菌体开始大量死亡,进入衰亡期。

图3 SZ-3菌株的生长曲线Fig.3 Growth curve of strain SZ-3
2.3 菌株序列测定结果及系统发育分析
以SZ-3菌株的DNA为模板进行PCR扩增,琼脂糖凝胶电泳显示大约1000bp左右,与设计引物1050bp大小相符,无非特异性扩增出现;测序结果提交NCBI上进行BLAST比对,相似性最高的是Methanosarcina(产甲烷八叠球菌属)的菌株,以此为根据选择10株Methanosarcina属菌株,Mthanothermobacter wolfeii strain DSM 2970菌株作为外群种构建系统发育树。
菌株SZ-3与产甲烷八叠球菌属的4个菌株的16SrDNA基因序列相似性为99%,根据同源性构建的系统发育树(图4)可以看出,菌株SZ-3与(M.lacustris)湖沉积甲烷八叠球菌种菌株在同一个分支里,与Methanosarcina lacustris DQ058823的亲缘关系相近属于同一种属。
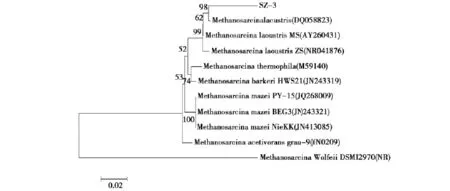
图4 基于16SrDNA序列同源性构建产甲烷八叠球菌属系统发育树Fig.4 Dendragram of Methanosarcina based on 16SrDNA sequence homology
SZ-3菌株生理生化特征比较(表1);SZ-3菌株生长最适温度、pH、NaCl浓度、可利用碳源底物等都和湖沉积甲烷八叠球菌相近;系统发育分析结果也表明SZ-3菌株与湖沉积甲烷八叠球菌亲缘关系较近。

表1 SZ-3菌株与其他产甲烷八叠球菌属菌株主要生理特征比较Tab.1 Comparison of strain SZ-3and other members of Methanosarcina
3 结论
使用厌氧分离技术从新疆低温沼气池中分离出两株产甲烷菌菌株SZ-1和SZ-3,其中SZ-3能够耐受低温且符合兼性嗜冷筛选要求。SZ-3菌株荧光相差显微镜下观察呈叠形球状,菌株最适生长温度20℃,生长最适pH值为7,最适NaCl浓度为0~0.4mol/L;该菌株革兰氏染色阳性,菌落呈黄色,菌株只能利用甲醇、H2/CO2(80∶20)混合气、甲胺、二甲胺,三甲胺做为碳源底物进行生长;菌株对于四环素、青霉素、氯霉素、卡那霉素、链霉素5种抗生素均具有耐受性。SZ-3菌株系统发育分析结果显示其与湖沉积甲烷八叠球菌亲缘关系较近;结合形态学、生理生化特征,最终确定菌株属于湖沉积甲烷八叠球菌种。
[1]P H Smith,R E Hungate.Isolation and characterization of methanobacterium ruminantiu mn.sp[J].Bacteriology,1958,75(6):713-718.
[2]Guishan Zhang,Na Jiang,Xiaoli Liu,et al.Methanogenesis from Methanol at Low Temperatures by a Novel Psychrophilic Methanogen,"Methanolobus psychrophilus sp".nov.,Prevalent in Zoige Wetland of the Tibetan Plateau[J].Applied and Environmental Microbiology,2008,74(19):6114-6120.
[3]Metje M,Frenzel P.Methanogenesis and methanogenic pathways in a peat from subarctic permafrost[J].Environment Microbiology,2007,9:954-964.
[4]Lettinga G,Rebac S,Zeeman G.Challenge of psychrophilic anaerobic wastewater treatment[J].Trends Biotechnol,2001,19:363-370.
[5]Nozhevnikova A N,simankova M V,Parshina S N,et al.Temperature characteristics of mcthanogenic archaea and acetogenic bacteria isolated from cold environments.Water Science and Technology[J].2001,44(8):41-48.
[6]Sun Z,Zhou Y G,Dong X Z.Characterization and phylo-genetics of a new species of genus methanobacterium[J].Acta Microbiologica Sinica,2001,41:265-269.
[7]钱泽澍,闵航.沼气发酵微生物学[M].杭州:浙江科学技术出版社,1986.
[8]Cuzin N,Ouattara A S,Labat M,et al.Methanobacterium congolense sp nov,from a methanogenic fermentation of cassava peel[J].Isem,2001,51(2):489-493.
[9]Suzuki M T,Rappe M S,Haimberger Z W,et al.Bacterial diversity among small-subunit rRNA gene clones and cellular isolates from the same seawater sample[J].Applied and Environmental Microbiology,1997,63(3):983-989.
[10]胡亚东,袁月祥,闫志英,等.一株生长pH较宽的产甲烷菌分离与系统发育分析[J].应用与环境生物学报,2009,15(4):554-558.
[11]Xia Ding,Huaiyang Zhou,Zhenmei Lu,et al.Isolation and characterization of a new strain of Methanothermobacter marburgensis DX01from hot springs in China[J].Anaerobe,2010,16:54-59.
[12]Kevin R,Sowers Stephen F,Baron,et al.Methanosarcina acetivorans sp.nov.,an acetotrophic methane-producing bacterium isolated from marine sediments[J].Applied and Environmental Microbiology,1984,47(5):971-978.
[13]Gloria M.Maestrojuan,David R.Boone.Characterization of methanosarcina barkeri MST and 227,methanosarcina mazei S-6T,and methanosarcina vacuolata Z-761T[J].Systematic and Evolutionary Microbiology,1991,41(2):267-274.
[14]Maria V,Simankova,Alla N Nozhevnikova.Methanosarcina lacustris sp.nov.,a new psychrotolerant methanogenic archaeon from Anoxic Lake sediments[J].Systematic and Applied Microbiology,2001,24(3):362-367.
[15]Maria V,Simankova Oleg R,Kotsyurbenko Michael W.Friedrich,et al.Isolation and characterization of new strains of methanogens from cold terrestrial Habitats[J].Systematic and Applied Microbiology,2003,26(2):312-318.
