乳品中β-内酰胺类抗生素快速检测试纸条研制
2012-11-02罗晓琴刘文芳崔彦虎余厚美
罗晓琴,刘 琳,刘文芳,崔彦虎,余厚美
(北京望尔生物技术有限公司,北京102206)
乳品中β-内酰胺类抗生素快速检测试纸条研制
罗晓琴,刘 琳,刘文芳,崔彦虎,余厚美
(北京望尔生物技术有限公司,北京102206)
通过β-内酰胺类抗生素-载体蛋白偶联物的合成,单克隆抗体的制备与纯化,胶体金标记物的制备,β-内酰胺类抗生素单克隆抗体-胶体金标记物的制备并冻干到微孔试剂,样品吸收垫和反应膜的制备等研究过程,研制出乳制品中β-内酰胺类抗生素的快速检测试纸条。检测限分别为:青霉素G 2μg/L、氨苄青霉素4μg/L、阿莫西林5μg/L、苯唑青霉素/邻青霉素/双青霉素均为6μg/L、头孢洛宁10μg/L、萘夫西林20μg/L、头孢喹肟20μg/L、头孢曲松25μg/L、头孢哌酮50μg/L、头孢噻呋90μg/L;本试纸条特异性好、假阳性率不高于3%、假阴性率为0,检测时间不超过15min,检测限量达到了我国和欧盟的要求,适用于乳品流通环节乳品中β-内酰胺类抗生素残留的检测。
β-内酰胺类抗生素,乳品,胶体金,试纸条
β-内酰胺类抗生素是指化学结构中含有β-内酰胺环的一类抗生素,主要包括青霉素类和头孢菌素类,其作用特点是能够抑制细菌黏肽转肽酶的活性,从而阻止细菌细胞壁的合成,呈现杀菌活性[1]。β-内酰胺类抗生素广泛用于控制奶牛的乳房炎,治疗动物尿道、胃肠道和呼吸道感染等。但由于其使用方法不当或不遵守休药期规定等原因,极易残留在使用组织中,造成严重危害:使人体产生耐药菌株,给使用抗生素治疗疾病带来不良影响;出现过敏反应;破坏人体内正常菌群的平衡状态,甚至造成“二重感染”[2]。目前,牛奶及生鲜奶中β-内酰胺类抗生素残留的检测方法依据不同的检测原理,大体可分为三大类:微生物受阻检测、理化检测法、免疫学分析法。微生物受阻检测方法主要有抑菌圈实验、浑浊度实验、变色型检测金标试剂盒方法,其检测成本价低,但是灵敏度低、耗时长、耐药菌的存在容易导致误检;理化检测方法有液相色谱法、色谱/质谱联用技术、气相色谱法等,该检测方法精确度高,但其存在检测成本高,检测设备复杂,对检测人员的要求较高,检测耗时长等缺点。免疫分析法由于具有快速、灵敏、特异等特点常用于检测β-内酰胺类抗生素,目前主要为酶联免疫检测法和放射免疫分析法[3]。我国原料乳中β-内酰胺类抗生素残留严重,对其开展监控检测是我国乳业发展中极为关注的问题,研制β-内酰胺类抗生素残留快速检测的方法势在必行,本研究采用胶体金免疫法开发了一种快速准确检测牛奶中β-内酰胺类抗生素的试纸条。我国235号文件规定的牛奶中β-内酰胺类抗生素药物限量要求如下:苯唑西林30μg/L、氯唑西林30μg/L、头孢噻呋100μg/L、头孢喹肟20μg/L、头孢氨苄100μg/L、氨苄西林10μg/L、阿莫西林10μg/L。欧盟对牛奶中β-内酰胺类抗生素药物限量要求如下:青霉素G 4μg/L、氨苄青霉素4μg/L、阿莫西林4μg/L、苯唑青霉素30μg/L、邻青霉素30μg/L、双青霉素30μg/L、萘夫西林30μg/L、头孢喹诺20μg/L、头孢乙腈125μg/L、头孢洛宁20μg/L、头孢唑林50μg/L、头孢哌酮50μg/L、先锋霉素Ⅷ60μg/L、头孢噻呋100μg/L[4]。
1 材料与方法
1.1 材料与仪器
1%氯金酸 sigma公司;柠檬酸三钠 广州化学试剂厂;磷酸盐缓冲液(简称PBS) 含酪蛋白、吐温-80的0.02mol/L、pH7.2的磷酸盐溶液,其中酪蛋白在复溶缓冲液中的终浓度为0.05%~0.1%(体积百分含量),吐温-80在复溶缓冲液中的终浓度为0.05%~ 0.15%(质量百分含量);双蒸水,1-乙基-(3-二甲基氨基丙基)碳二亚胺(简称EDC),N-羟基琥珀酰亚胺(简称NHS),卵清蛋白,牛血清白蛋白。
微量移液器 单道20~200μL和100~1000μL、多道50~300μL,美国Thermo;离心机TDL-408等 上海安亭。
1.2 头孢类药物-载体蛋白偶联物的合成与鉴定
头孢类药物是小分子物质,只有免疫反应性,没有免疫原性,不能诱发机体产生免疫应答,必须与大分子载体蛋白偶联后才具有免疫原性。
1.2.1 免疫原的制备-头孢类药物与卵清蛋白偶联物合成 取头孢匹林的钠盐40mg,用1.5mL双蒸水溶解,得到(Ⅰ)液;取1-乙基-(3-二甲基氨基丙基)碳二亚胺(简称EDC)40mg和N-羟基琥珀酰亚胺(简称NHS)60mg用0.5mL水溶解得到(Ⅱ)液;在搅拌状态下将(Ⅱ)加入(Ⅰ)中,反应1h,得到(Ⅲ)液;取卵清蛋白60mg用8mL水溶解,得到(Ⅳ)液;将(Ⅳ)加入(Ⅲ)中,室温搅拌反应24h分别得到免疫原,用0.02mol/LPBS缓冲液透析3d,分装、冻存。
1.2.2 包被原的制备-头孢类药物与牛血清白蛋白偶联物合成 取头孢匹林的钠盐40mg,用1.5mL双蒸水溶解,得到(Ⅰ)液;取EDC 40mg和NHS 60mg用0.5mL水溶解得到(Ⅱ)液;在搅拌状态下将(Ⅱ)加入(Ⅰ)中,反应1h,得到(Ⅲ)液;取牛血清白蛋白100mg用8mL水溶解,得到(Ⅳ)液;将(Ⅳ)加入(Ⅲ)中,室温搅拌反应24h分别得到包被原,用0.02mol/L PBS透析3d,分装、冻存。
1.2.3 头孢类药物-载体偶联物的鉴定 将载体蛋白、头孢类药物、头孢类药物-载体蛋白偶联物用pH7.4的PBS配成0.5mg/mL的溶液,以0.01mol/L pH7.4 PBS调零,用紫外分光光度计在波长200~800nm范围内扫描,得到载体蛋白、头孢类药物、头孢类药物-载体蛋白偶联物的吸收曲线。三者出现不同的吸收曲线,表明头孢类药物与载体蛋白偶联成功。
1.3 头孢类药物单克隆抗体的制备
头孢类药物单克隆抗体的制备主要包括动物免疫、细胞融合和克隆化、细胞冻存和复苏以及单克隆抗体的制备和纯化。
1.3.1 动物免疫 将1.2得到的免疫原注入到Balb/c小鼠体内,免疫剂量为150μg/只,使其产生抗血清。
1.3.2 细胞融合和克隆化 取免疫Balb/c小鼠脾细胞,按9∶1(数量配比)比例与SP2/0骨髓瘤细胞融合,筛选得到稳定分泌头孢类药物单克隆抗体的头孢类药物单克隆杂交瘤细胞株。
1.3.3 细胞冻存和复苏 将杂交瘤细胞用冻存液制成1×109个/mL的细胞悬液,在液氮中长期保存。复苏时取出冻存管,立即放入37℃水浴中速融,离心去除冻存液后,移入培养瓶内培养。
1.3.4 单克隆抗体的制备与纯化 增量培养法:将杂交瘤细胞置于细胞培养基中,在37℃条件下进行培养,用辛酸-饱和硫酸铵法将得到的培养液进行纯化,得到单克隆抗体,-20℃保存。所述细胞培养基为向RPMI-1640培养基中添加小牛血清和碳酸氢钠,使小牛血清在细胞培养基中的终浓度为20%(质量百分含量),使碳酸氢钠在细胞培养基中的终浓度为0.2%(质量百分含量);所述细胞培养基的pH为7.4。
1.4 羊抗鼠抗抗体的制备
以羊作为免疫动物,以鼠源抗体为免疫原对无病原体羊进行免疫,得到羊抗鼠抗抗体。
1.5 头孢类药物单克隆抗体-胶体金标记物的制备
先制备好胶体金标记物,再向胶体金标记物中加入1.3.4制备好的单克隆抗体,形成头孢类药物单克隆抗体-胶体金标记物。
1.5.1 胶体金的制备 用双蒸去离子水将1%氯金酸稀释成0.01%(质量百分含量),置磁力加热搅拌器上搅拌煮沸,每100mL 0.01%氯金酸加入2.5mL 1%柠檬酸三钠,继续搅拌加热反应至液体呈红色时停止加热,冷却至室温后补足失水。制备好的胶体金外观纯净、透亮、无沉淀和漂浮物。
1.5.2 头孢类药物单克隆抗体-胶体金标记物的制备 在磁力搅拌下,用0.2mol/L碳酸钾调节胶体金的pH至7.0,按50~100mg抗体/mL胶体金的标准向胶体金溶液中加入上述头孢类药物单克隆抗体,继续搅拌混匀30min,加入10%BSA至BSA在胶体金溶液中的终浓度为1%(体积百分含量),静置30min。12000r/min、4℃离心30min,弃上清液,沉淀用复溶缓冲液洗涤两次,用体积为初始胶体金体积1/20的复溶缓冲液将沉淀重悬,得到的头孢类药物单克隆抗体-胶体金标记物溶液的浓度为50μg单抗/mL溶液,置4℃备用。
1.6 头孢类药物单克隆抗体-胶体金标记物的冻干
向微孔试剂微孔板中加入100μL头孢类药物单克隆抗体-胶体金标记物,放入冷冻干燥机中,冷阱温度为-70℃条件下,预冻4h后,再冻干14h,即可取出,得到冻干有头孢类药物单克隆抗体-胶体金标记物的微孔试剂。
1.7 样品吸收垫的准备
将样品吸收垫置于含牛血清白蛋白(牛血清白蛋白在缓冲液中的终浓度为体积百分含量0.5%)、pH为7.2、0.1mol/L磷酸盐缓冲液浸泡2h,37℃烘2h备用。
1.8 反应膜的制备
包被过程:用磷酸缓冲液将头孢类药物-牛血清白蛋白偶联物稀释到10mg/mL,用Biodot点膜仪将其包被于硝酸纤维素膜上的检测区,包被量为1.0μg/cm2;用0.01mol/L、pH7.4 PBS缓冲液将羊抗鼠IgG抗体稀释到200μg/mL,用Biodot点膜仪将其包被于硝酸纤维素膜上的质控区,包被量为1.0μg/cm2。将包被好的反应膜置于37℃条件下干燥2h,备用。
1.9 试纸条检测方法
取所需数目的试纸条、微孔试剂、奶样(液体)以及相关其他试剂恢复至室温,吸取待检牛奶样品溶液,滴加200μL于微孔中,缓慢抽吸5次,充分与微孔中试剂混合,混合液颜色呈均匀粉红色,开始计时。室温下孵育5min,将标记好的试纸条插入微孔中(印有“max”线端朝下,使之充分浸入溶液中),微孔中的试剂与牛奶样品反应,再次室温孵育5min后,液体会沿着试纸条垂直向上依次通过试纸条的检测线和对照线,当样品中没有β-内酰胺类抗生素时,试纸条的检测线和对照线处出现红色条带;当样品中存在β-内酰胺类抗生素时,试纸条的检测线处不出现红色条带,仅对照线处出现红色条带,如图1所示。
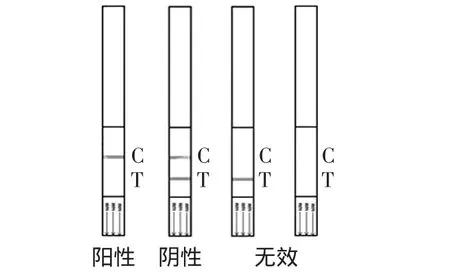
图1 检测结果示意图Fig.1 Sketch of detection results
1.10 牛奶中β-内酰胺类抗生素测定
实验测定β-内酰胺类抗生素试纸条灵敏度、特异性以及假阳性率和假阴性率。
1.1 0.1 试纸条检测限测定 在空白牛奶样品分别添加青霉素G标准品至终浓度分别为1、2、4μg/L;分别添加氨苄青霉素标准品至终浓度为2、4、8μg/L;分别添加阿莫西林标准品至终浓度为2.5、5、10μg/L;分别添加苯唑青霉素、邻青霉素、双青霉素标准品至终浓度为3、6、12μg/L;分别添加头孢洛宁标准品至终浓度为5、10、20μg/L;分别添加萘夫西林和头孢喹肟标准品至终浓度为10、20、40μg/L;分别添加头孢曲松标准品至终浓度为10、25、50μg/L;分别添加头孢哌酮标准品至终浓度为20、50、100μg/L;分别添加头孢噻呋标准品至终浓度为45、90、180μg/L,取试纸卡进行测试,每个浓度重复测定5次,以验证本试纸卡的检测限。所用的稀释液为pH7.2、0.2mol/L的磷酸盐缓冲液。
1.1 0.2 特异性实验 特异性常用交叉反应率表示,是指抗体与结构不同的抗原决定簇发生结合的能力。将牛奶中常检的其他药物(克仑特罗、莱克多巴胺、沙丁胺醇、三聚氰胺、群勃龙醋酸酯、磺胺类、氯霉素类、大环内酯类、氨基糖苷类、氟喹诺酮类、四环素类)用pH为7.2、0.2mol/L的磷酸盐缓冲液进行稀释,用试纸条进行检测。
1.1 0.3 试纸卡的假阳性率、假阴性率测定 取空白牛奶样品50份,计算出假阳性率。取添加青霉素G浓度为2μg/L的阳性牛奶样品50份,计算出假阴性率。
2 结果与分析
2.1 试纸卡检测限测定结果与分析
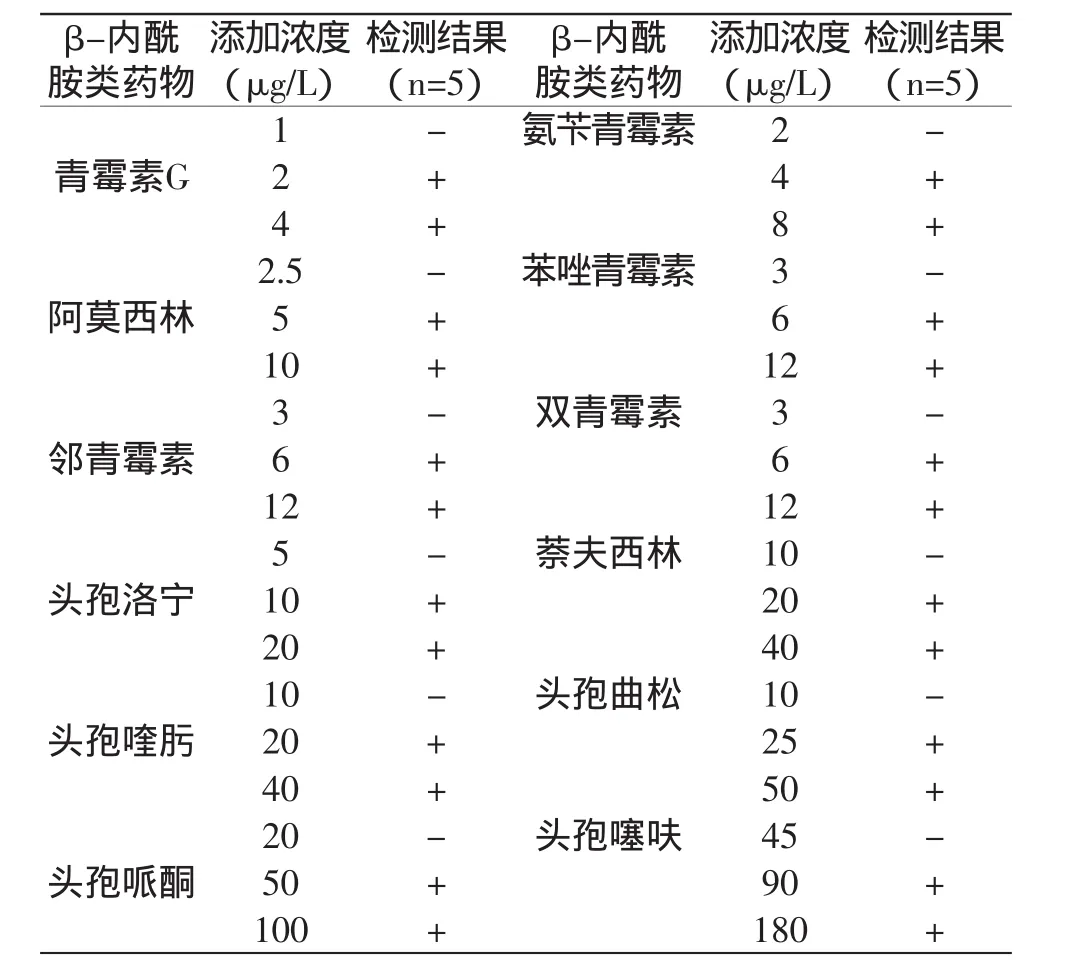
表1 试纸卡检测限测定结果Table 1 The detection limit of strips
由上述测定结果可知,本试纸条对以下药物的检测限分别为:青霉素G2μg/L、氨苄青霉素4μg/L、阿莫西林5μg/L、苯唑青霉素/邻青霉素/双青霉素均为6μg/L、头孢洛宁10μg/L、萘夫西林20μg/L、头孢喹肟20μg/L、头孢曲松25μg/L、头孢哌酮50μg/L、头孢噻呋90μg/L,都已达到了我国和欧盟规定的检测限量要求。
2.2 试纸卡特异性结果及分析
结果显示,克仑特罗、莱克多巴胺、沙丁胺醇、三聚氰胺、群勃龙醋酸酯、磺胺类药物、氯霉素类药物、大环内酯类、氨基糖苷类、氟喹诺酮类、四环素类药物在500μg/L浓度时,试纸条质控区和检测区均显色,由此可知本试纸条未对这些药物发生交叉反应。
2.3 试纸卡的假阳性率、假阴性率测定结果及分析

表2 试纸卡假阳性率、假阴性率测定结果Table 2 The false positive rate and false negative rate of strips
所检50份空白牛奶样品的检测结果1份阳性,其余均为阴性,试纸卡假阳性率不高于3%;青霉素G添加浓度为2μg/L的50份阳性样品的检测结果均为阳性,试纸卡假阴性率为0。
3 结论
通过实验和测定结果显示,本快速检测试纸条用于测定牛奶中β-内酰胺类抗生素残留可行,检测限分别为:青霉素G 2μg/L、氨苄青霉素4μg/L、阿莫西林5μg/L、苯唑青霉素、邻青霉素、双青霉素均为6μg/L、头孢洛宁10μg/L、萘夫西林20μg/L、头孢喹肟20μg/L、头孢曲松25μg/L、头孢哌酮50μg/L、头孢噻呋90μg/L,与牛奶中其他药物不发生交叉反应,假阳性和假阴性的可能性较小,检测时间短。可作为奶牛场、乳制品厂、政府监督部门、出入境检测以及大型食品流通领域等筛查乳制品中β-内酰胺类抗生素的首选产品,使牛奶中抗生素问题得到有效监控,符合最大残留限量标准。
[1]张继明.β-内酰胺类抗生素的药理研究进展[J].知识经济,2009(7):94.
[2]谢会玲,陈伟,彭池方,等.动物源性食品中β-内酰胺类抗生素多残留免疫分析方法研究进展[J].食品科学,2008,29(7):490-494.
[3]姜侃,陈宇鹏,金燕飞,等.应用酶联免疫法快速检测乳品中β-内酰胺类抗生素残留[J].中国乳品工业,2010,38(1):51-54.
[4]Janine Lamar,Michael Petz.Development of a receptor-based microplate assay for the detection of beta-lactam antibiotics in different food matrices[J].Analytica Chimica Acta,2007,586:296-303.
Development of the rapid detection strip for β-lactam antibiotics in dairy
LUO Xiao-qin,LIU Lin,LIU Wen-fang,CUI Yan-hu,YU Hou-mei
(Beijing Wanger Biotechnology Co.,Ltd.,Beijing 102206,China)
This study developed a strip which can detect β-lactam antibiotics in dairy products quickly,through producing class antibiotic rapid detection strip,through the synthesis of the conjugate of β-lactam antibiotics and carrier protein,preparation and purification of monoclonal antibody,preparation of colloidal gold markers,preparation of the conjugate of β-lactam antibiotics monoclonal antibody and colloidal gold markers,preparation of sample absorption mat and reaction film and any other process.The strip can detect for penicillin G 2μg/L,ampicillin 4μg/L,amoxicillin 5μg/L,oxacillin,cloxacillin,dicloxacillin 6μg/L,cefalonium 10μg/L,nafcillin,20μg/L,cefquinome 20μg/L,ceftriaxone 25μg/L,cefoperazone 50μg/L,ceftiofur 90μg/L,the detection sensitivity was respectively.The false positive rate was less than 3%,and the false negative rate was 0.The detection time was less than 15min.The reported results indicated that the developed assay had the potential to emerge into a screening assay for routine use.For this purpose current work was ongoing to include all beta-lactams for which MRLs were set,to extend the range of matrices and to perform a full validation according to the principles of EU decision. Key words:β-lactam antibiotics;dairy;colloidal gold;strips
TS252.7
A
1002-0306(2012)03-0309-04
2011-01-21
罗晓琴(1984-),女,本科,研究方向:食品安全与检测。
国家高技术研究发展计划(863计划)项目(2010AA10Z402)。
