离子液体[Bmim]Cl预处理对两种高结晶多糖酸水解的影响
2012-11-02王兆梅肖凯军
李 娜,王兆梅,肖凯军
(华南理工大学轻工与食品学院,广东广州510640)
离子液体[Bmim]Cl预处理对两种高结晶多糖酸水解的影响
李 娜,王兆梅*,肖凯军
(华南理工大学轻工与食品学院,广东广州510640)
以酵母β-葡聚糖和凝结多糖这两种高结晶多糖为研究对象,采用偏光显微镜、X射线衍射(XRD)和DNS法研究了离子液体[Bmim]Cl预处理对多糖结晶结构和酸水解效率的影响。XRD图谱分析发现,[Bmim]Cl预处理后酵母β-葡聚糖和凝结多糖的结晶度明显下降。离子液体[Bmim]Cl预处理酵母β-葡聚糖和凝结多糖显著提高其酸水解效率。在4mol/L TFA及100℃条件下,酵母β-葡聚糖(水解时间2h)和凝结多糖(水解时间3h)酸水解产物中还原糖的含量分别为84.36g/100g和96.07g/100g,明显高于未经离子液体处理的53.44g/100g和46.80g/100g。
酵母β-葡聚糖,凝结多糖,离子液体,酸水解
多糖不仅作为能量物质和结构物质,而且还具有多种生物活性:抗菌、抗病毒、抗肿瘤、抗辐射、抗衰老、抗疲劳、抗氧化、抗炎、免疫调节及降血脂抗血栓等[1-2]。因此,多糖的研究与开发已日益引人注目[3]。多糖结构分析有利于揭示多糖构效关系和开发新型功能多糖等。然而,鉴于多糖的复杂性,至今没有直接解析多糖结构的仪器手段,多数结构分析中需要将多糖降解为单糖来分析。酸水解是多糖中单糖分析的常用方法,但由于高结晶多糖分子排列紧密、高结晶度、不溶于水及大部分有机溶剂的特性,使其降解效率普遍较低且加工能耗大,成为制约多糖结构研究的关键因素。因此,破坏高结晶多糖的网状骨架,降低分子结晶度将是提高酸水解效率的有效途径[4]。通常酸水解采用盐酸、硫酸以及三氟乙酸[5],但都存在水解时间长、温度高、能耗大等一系列问题。离子液体是一种新型绿色溶剂,同时[Bmim]Cl离子液体中较高的Cl-浓度和阳离子活性可以有效破坏溶质中的氢键作用[6-8]。罗志刚等研究离子液体对淀粉颗粒性质的影响,发现在离子液中淀粉原有的结晶结构被破坏,有效改善了淀粉的溶解性能[9]。李秋瑾等研究分析,微晶纤维素经[Bmim]Cl预处理后氢键减弱,结晶度明显下降,由规整的平行排布转变为疏松有孔的无序形貌[10]。本研究以两种结晶多糖酵母β-葡聚糖和凝结多糖为研究对象,研究离子液对多糖结晶度和多糖酸水解效率的影响。
1 材料与方法
1.1 材料与仪器
酵母β-葡聚糖 上海杰康诺生物科技有限公司;凝结多糖 深圳同驰科技有限公司;1-丁基-3-甲基咪唑氯化物([Bmim]Cl) 中科院兰州化学物理研究所;3,5-二硝基水杨酸(DNS) 上海天齐生物科技有限公司;三氟乙酸 阿拉丁化学有限公司;葡萄糖 天津市大茂化学试剂厂;其他化学试剂 均为分析纯。
D8-ADVANCE型全自动X射线衍射仪 德国Bruker公司;UV-2102PC型紫外可见分光光度计 上海Unico公司;BX51型偏光显微镜 日本OLYMPUS;Vizared20型真空冷冻干燥机 美国VIRTIS公司;DF-101S集热式恒温磁力搅拌器 巩义市予华仪器有限责任公司。
1.2 实验方法
1.2.1 多糖的离子液预处理与再生 将酵母β-葡聚糖和凝结多糖放入真空干燥箱中,真空度0.1MPa,50℃干燥24h后备用。将干燥后的多糖200mg和离子液体[Bmim]Cl 4g放入圆底烧瓶中,置于磁力搅拌油浴锅中100℃充分混合,在隔绝水分状态下搅拌溶解2h。
将所得多糖溶液用5倍于其体积的无水乙醇反复冲洗,离心沉降,得到再生多糖。将再生多糖置于冷阱中-78℃常压预冻6h,转移至样品架,多糖温度25℃,冷阱温度-78℃,20Pa下冻干处理24h后备用。
1.2.2 多糖的酸水解 准确称取离子液体处理前后的酵母β-葡聚糖和凝结多糖各4mg,加入2mL 4mol/L TFA置于安培瓶中,并用酒精喷灯密封,放入油浴锅中100℃下分别水解0、0.5、1、2、3h,将水解液离心10min(7000r/min),取上清液,并稀释2倍。由于3,5-二硝基水杨酸在碱性溶液中被还原糖还原成氨基化合物,在沸水浴中显色时间5min,波长在550nm下有最大吸收峰,故用DNS法测其水解液的吸光度,从而得出还原糖含量。
1.2.2.1 还原糖标准曲线的制作 分别取浓度为0.1、0.2、0.3、0.4、0.5、0.6mg/mL的葡萄糖液和蒸馏水(作空白)各1mL,分别加入3mL的DNS试剂,沸水浴煮沸5min显色后用冷水冲洗冷却。然后用蒸馏水定容至25mL并摇匀,用分光光度计在550nm的波长下测定吸光度,以对照液调零[11]。以葡萄糖浓度为横坐标,吸光度为纵坐标,得出标准曲线y=0.7079x-0.0182,r2=0.9953,曲线的线性关系良好。
1.2.2.2 还原糖含量的计算 测出样品的吸光度,根据葡萄糖的标准曲线可计算出样品中还原糖的浓度,由以下公式计算出样品中还原糖含量:还原糖含量(g/100g)=还原糖浓度(g/mL)×样品定容体积(25mL)/样品质量(g)×100%
1.2.3 多糖的偏光显微结构分析[8]将两种多糖样品按一定比例加入水(1∶5,w/v),使之分散2min,取样滴于载玻片上,盖上盖玻片,放置在显微镜载物台上,放大500倍,在偏振光下观察酵母β-葡聚糖和凝结多糖的偏光变化情况。
1.2.4 多糖的结晶结构分析 采用X-射线衍射分析,通过连续扫描法,Cu Ka(λ=0.154nm)射线和LynxExe阵列探测器,扫描速度17.7s/步,扫描范围为5°~60°,步长为0.02,管压管流分别为40kV和30mA。
1.2.5 数据处理 实验数据采用Origin软件进行处理和作图。
2 结果与分析
2.1 离子液预处理前后多糖的偏光显微镜观察
图1和图2是离子液预处理前后酵母β-葡聚糖和凝结多糖的偏光显微图。由于酵母β-葡聚糖和凝结多糖具有高度的结晶结构,在偏光显微镜下可呈光亮的亮点,因此可通过偏光显微镜观察酵母β-葡聚糖和凝结多糖在离子液中的溶解过程。如图1A和图2A所示,未经离子液处理前可观察到酵母β-葡聚糖和凝结多糖有大量的偏光区域,离子液处理2h后,酵母β-葡聚糖和凝结多糖丝变细变短,逐渐至溶解。分析其原因,可能是由于离子液体中含有较强的氢键受体Cl-与多糖分子上的羟基形成氢键,而使多糖分子间或分子内的氢键作用减弱[12],原有的结晶结构遭到破坏,从而导致了多糖溶解,偏光减少。
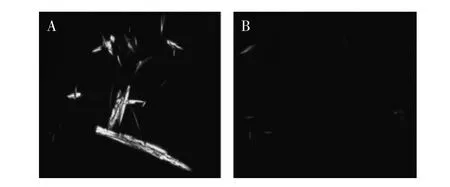
图1 酵母β-葡聚糖的偏光显微照片Fig.1 Polarized optical microscopy of brewer yeast-β-glucans
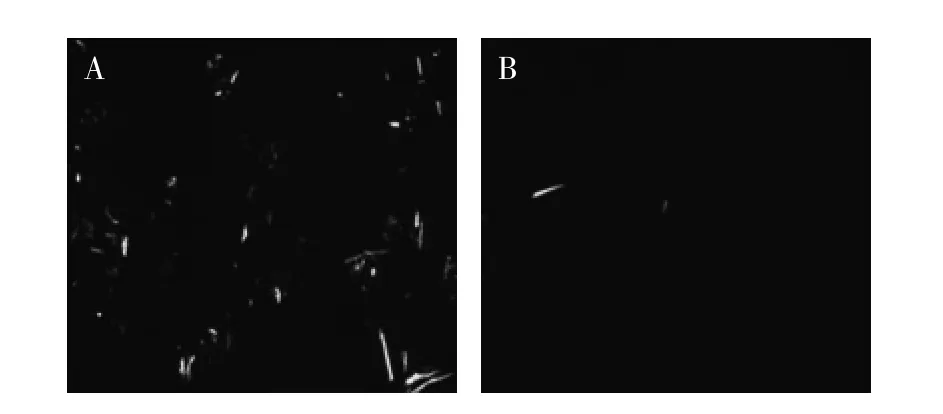
图2 凝结多糖的偏光显微照片Fig.2 Polarized optical microscopy of curdlan
2.2 离子液预处理对两种多糖结晶结构的影响
图3、图4分别为酵母β-葡聚糖及凝结多糖的原样及经离子液处理2h后多糖的X射线衍射图。
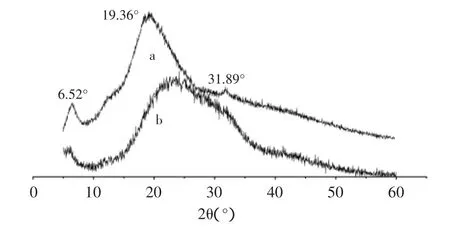
图3 离子液体[Bmin]Cl预处理前后酵母β-葡聚糖的XRD谱图Fig.3 XRD patterns of brewer yeast-β-glucans
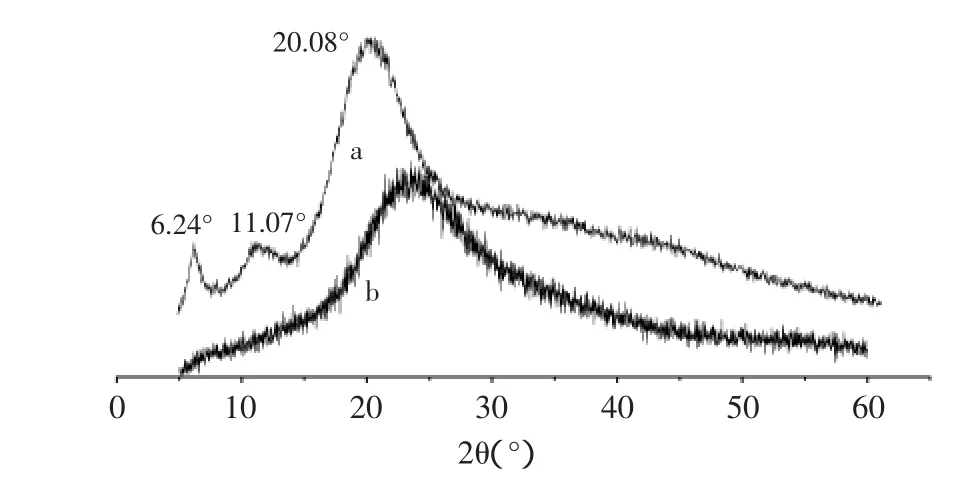
图4 离子液体[Bmin]Cl预处理前后凝结多糖的XRD谱图Fig.4 XRD patterns of curdlan
由图3可见:酵母β-葡聚糖在2θ=6.52°、19.36°、31.89°均有较强的衍射吸收峰,经离子液再生后,酵母β-葡聚糖的衍射特征峰发生了很大的变化,其衍射峰强度明显减弱,峰形变宽,都呈现弥散状态。X射线衍射谱图中,2θ=6.52°处衍射峰变小,2θ=31.89°的衍射峰消失,再生酵母β-葡聚糖结晶度大大降低。同时图4看出,凝结多糖在2θ=6.24°、11.07°、20.08°均有较强的衍射吸收峰,经离子液再生后,2θ=6.24°和2θ=11.07°处衍射峰均消失,同时2θ=20.08°处衍射峰的峰形变宽。原因为随时间的推移,离子液破坏多糖的结构程度加大,含Cl-的离子液可以通过与酵母β-葡聚糖和凝结多糖的分子形成氢键来破坏其结晶,分子间氢键作用力减小,于是其结晶度不断降低,所以2θ的衍射吸收峰变小[9]。同时,随着产物的结晶结构不断被破坏,分子呈松散状态,有利于TFA与再生酵母β-葡聚糖和凝结多糖的亲水基团·OH结合,共同使多糖分子间或分子内的氢键作用减弱,从而促进其水解,因此加快了酸水解速率,提高了还原糖含量。
2.3 离子液处理前后多糖的酸水解
离子液处理前后的酵母β-葡聚糖和凝结多糖的酸水解如图5、图6所示。
图5和图6分别是离子液处理前后酵母β-葡聚糖和凝结多糖酸水解过程中不同时间的还原糖含量。由图5可见,经离子液预处理后酵母β-葡聚糖酸水解速率在0~2h阶段快速大幅提升,2h时还原糖含量达到最大值为86.34g/100g,而在2~3h阶段还原糖含量下降,可能由于离子液破坏多糖的内部结构,导致一部分低聚糖产生,造成单糖损失。未经离子液预处理的酵母β-葡聚糖酸水解速率在0~0.5h阶段大幅提升,而在0.5~3h阶段仅有小幅提升,2h时还原糖含量仅为53.44g/100g,小于预处理后酵母β-葡聚糖酸水解反应的还原糖含量。
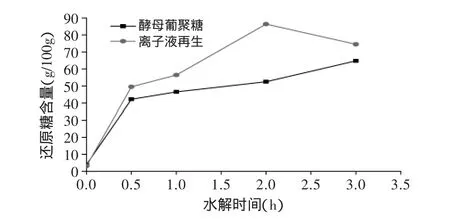
图5 离子液体预处理前后酵母β-葡聚糖酸水解液中还原糖含量Fig.5 The reducing sugar content of original and[Bmin]Cl treated brewer yeast-β-glucans during the acid hydrolysis
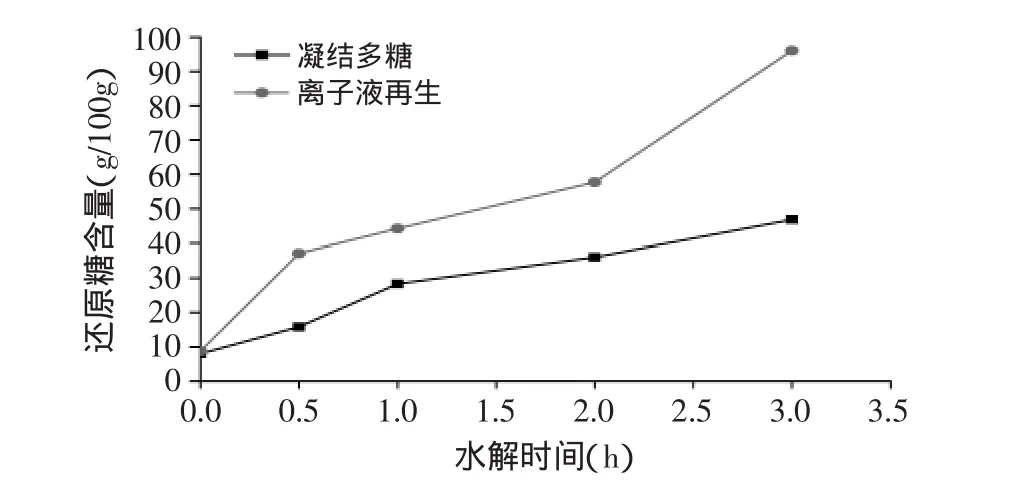
图6 离子液体预处理前后凝结多糖酸水解液中还原糖含量Fig.6 The reducing sugar content of original and[Bmin]Cl treated curdlan during the acid hydrolysis
由图6可见,经离子液预处理后凝结多糖酸水解速率在0~3h阶段快速大幅提升,3h时还原糖含量达到96.07g/100g;未经离子液处理的凝结多糖酸水解速率曲线与离子液预处理后凝结多糖酸水解速率曲线变化趋势一致,所不同的是未经离子液处理的凝结多糖酸水解速率提升幅度小,3h时还原糖含量仅为46.80g/100g,小于预处理后凝结多糖酸水解反应的还原糖含量。说明经离子液预处理后酵母β-葡聚糖和凝结多糖酸水解速率显著提高,同时还原糖含量增加。
3 结论
本文利用离子液体[Bmim]Cl对两种高结晶多糖进行了溶解预处理及再生。考察了预处理前后两种高结晶多糖酸水解过程中还原糖含量的变化,并对预处理前后酵母β-葡聚糖和凝结多糖进行了XRD表征,结果如下:
3.1 偏光显微照片显示:酵母β-葡聚糖和凝结多糖在离子液体中,偏光经离子液处理而逐渐减少。
3.2 XRD分析表明:[Bmim]Cl预处理使酵母β-葡聚糖和凝结多糖的结晶度大大降低。
3.3 DNS法分析结果可知:[Bmim]Cl预处理可使酵母β-葡聚糖和凝结多糖酸水解速率及所得还原糖含量均显著提高。
[1]阳佛送,李雪华.多糖结构研究的方法和进展[J].食品安全检测,2008(3):201-203.
[2]Persin Z,Stana-Kleinschek K,Foster T J,et al.Challenges and opportunities in polysaccharides research and technology:The EPNOE views for the next decade in the areas of materials,food and health care[J].Carbohydrate Polymers,2011,84(1):22-32.
[3]Stefan W,Andrey P.Carbohydrate analysis of plant materials with uronic acid-containing polysaccharides-A comparison between different hydrolysis and subsequent chromatographic analytical techniques[J].Industrial Crops and Products,2009:571-580.
[4]罗志刚.微波对高链玉米淀粉颗粒性质影响的研究[J].食品工业科技,2006,27(8):49-53.
[5]缪月秋,顾龚平,吴国荣.植物多糖水解及其产物的研究进展[J].中国野生植物资源,2005(4):6-7.
[6]毛多斌,王雪,韩亚伟.离子液体中米曲霉果糖基转移酶催化合成蔗果三糖的研究[J].食品工业科技,2010,31(2):300-303.
[7]Xie H B,Li S H,Zhang S B.Ionic liquid as novel solvents for the dissolution and blending of wool keratin fibers[J].Green Chem,2005(7):606-608.
[8]张玲.离子液体中魔芋多糖的溶解及其衍生物液晶行为的研究[D].武汉:武汉理工大学,2009.
[9]罗志刚,李富丽.2种离子液体对木薯淀粉颗粒性质的影响[J].食品与发酵工业,2010,36(11):44-47.
[10]李秋瑾,殷友利,苏荣欣,等.离子液体[Bmim]Cl预处理对微晶纤维素酶解的影响[J].化学学报,2009,67(1):88-92.
[11]赵海霞,袁丁,何毓敏.3-5-二硝基水杨酸比色法测定竹节参中多糖的含量[J].食品工业科技,2010,31(6):327-329.
[12]Swatloski R P,Spear S K,Holbrey J D,et al.Dissolution cellose with ionic liquids[J].Journal of the American Chemical Society,2002,124(18):4974-4975.
Effect of ionic liquid pretreatment step on acid hydrolysis of two high crystallization polysaccharide
LI Na,WANG Zhao-mei*,XIAO Kai-jun
(College of Light Industry and Food Science,South China University of Technology,Guangzhou 510640,China)
The effect of an ionic liquid 1-butyl-3-methylimidazoliumchloride([Bmim]Cl)pretreatment on the efficiency of the acid hydrolysis and crystallinity of brewer yeast-β-glucans and curdlan was investigated by using polarized optical microscope,X-ray diffraction(XRD)and 3,5-dinitrosalicylic acid(DNS)method.It was demonstrated from the XRD spectrometry that the crystallinity of brewer yeast-β-glucans and curdlan declined dramatically with ionic liquid pretreated.Brewer yeast-β-glucans and curdlan pretreated with[Bmim]Cl enhanced the efficiency and increased the reducing sugar content during the acid hydrolysis.The reducing sugar content of brewer yeast-β-glucans(acid hydrolysis for 2h)and curdlan(acid hydrolysis for 3h)with the ionic liquid pretreated were 84.36g/100g and 96.07g/100g respectively,much higher than that of the untreated samples which were 53.44g/100g and 46.80g/100g in 4mol/L TFA at 100℃.
brewer yeast-β-glucans;curdlan;ionic liquid;acid hydrolysis
TS201.1
B
1002-0306(2012)07-0302-04
2011-06-20 *通讯联系人
李娜(1986-),女,研究生,研究方向:天然多糖结构分析及应用。
国家自然科学基金资助项目(X2qsB5100800);华南理工大学中央高校基本科研业务费专项资金项目(2009ZM0187)。
