沙煲暗罗根乙醇提取物的抗氧化活性和抗菌活性研究
2012-11-01王吉鸿纪明慧舒火明宋小平肖梓迪
王吉鸿, 纪明慧, 舒火明,2*, 宋小平, 肖梓迪
(1.海南师范大学,省部共建-热带药用植物化学教育部重点实验室,海南 海口 571158;2.海南经贸职业技术学院,海南 海口 571127)
沙煲暗罗Polyalthia consanguinea是番荔枝科Annonaceae暗罗属植物[1],主要分布于东半球的热带及亚热带地区,我国主要分布于云南、广东、广西南部、海南及台湾。暗罗属植物在民间已作药用,具有行气止痛、行气散结的功效,在海南岛黎族地区治疗气滞腹痛、胃疼、痛经、梅核气等[2]。近几年来,化学和药学工作者对暗罗属植物进行了一系列的研究工作,发现从部分植物中得到的化合物具有一定的抗肿瘤[3],抗疟疾[4],抗肺结核[4],抗虫[5]等药理活性。但作为海南特有植物的沙煲暗罗,对其研究未见相关文献报道。本实验拟对沙煲暗罗根部的乙醇提取物进行抗氧化活性和抑菌活性研究,从而为沙煲暗罗的进一步开发和利用提供科学依据。
1 材料与方法
1.1 材料、试剂和仪器
1.1.1 植物材料 沙煲暗罗采自海南省昌江县霸王岭森林公园,经海南师范大学生命科学院钟琼蕊老师鉴定为番荔枝科暗罗属植物沙煲暗罗Polyalthia consanguinea,样本保存在海南省热带药用植物化学重点实验室。
1.1.2 供试菌种 枯草芽孢杆菌(Bacillus sutbtilis)、金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌 (Escherichia coli)、黑曲霉(Aspergillus nigar)由海南师范大学生命科学学院微生物教研室提供。
1.1.3 试剂 石油醚、三氯甲烷、乙酸乙酯、无水乙醇(均为分析纯,天津市化学试剂一厂);过氧化氢(分析纯,西陇化工股份有限公司);七水合硫酸亚铁(分析纯,广州化学试剂厂);抗坏血酸(Vc)(分析纯,广东汕头转宁化工厂);邻二氮菲(分析纯,天津市化学试剂一厂);二甲基亚砜(分析纯,天津市化学试剂一厂);三羟甲基氨基甲烷(分析纯,上海山浦化工有限公司);1,1-二苯基-2三硝基苯肼(DPPH)(美国Sigma-Aldrich公司生产);琼脂、营养肉汤、改良马丁购于广东湛江市林达化玻仪器有限公司。
1.1.4 仪器 超声波清洗器(KQ2200型,昆山市超声仪器有限公司);pH计(pHS-3C型,上海康仪仪器有限公司);电子天平(BS124S型,赛多利斯科学仪器有有限公司);紫外可见分光光度计(UV2600,北京普析通用仪器责任有限公司);手轮式自动型不锈钢立式压力蒸汽灭菌器(LDZX-30KBS,上海申安医疗器械厂)、智能生化培养箱(SPX-250,宁波海曙赛福实验仪器厂)。
1.2 实验方法
1.2.1 乙醇粗提物和不同极性萃取物的制备 将沙煲暗罗根风干,粉碎称质量1 kg,用75%乙醇加热回流3次,每次2 h,合并提取液减压浓缩得到乙醇浸膏;将浸膏悬浊于水中再依次用石油醚(60~90℃)、三氯甲烷、乙酸乙酯萃取;减压浓缩分别得石油醚萃取物、三氯甲烷萃取物、乙酸乙酯萃取物,各浸膏冷冻干燥。
1.2.2 清除羟基自由基(OH·)能力 按参考文献[6]方法进行实验。准确称取不同部位的样品溶液10 mg,用二甲基亚砜溶解,分别配制成75、100、125、175、230 μg/mL 的溶液备用。在 10 mL 棕色量瓶中依次加入0.4 mL邻二氮菲 (5 mmol/L)、1 mL醋酸缓冲溶液 (50 mmol/L pH6.0)、0.4 mL FeSO4(7.5 mmol/L)溶液、0.4 mL H2O2(1%)和不同体积的样品溶液,用二甲基亚砜定容至10 mL,然后于37℃恒温水浴反应60 min。在536 nm处测量吸光值A,平行3次。按下公式计算清除率:

(1)式中:A0为不加双氧水,而加入样品时的吸光度;A1为加入双氧水,而不加入样品时的吸光度;A2为加入双氧水和样品时的吸光度。
1.2.3 清除DPPH自由基能力 按参考文献[7-10]方法进行实验。准确称取不同部位的样品液10 mg,用二甲基亚砜溶解,分别配制成 75,100,125,175,230 μg/mL的溶液备用。取不同体积样品溶液于10 mL棕色量瓶中,加入1 mL DPPH溶液,用二甲基亚砜定容至10 mL,室温避光下反应30 min。其中1 mL DPPH和9 mL二甲基亚砜A1,VmL样品,1 mL DPPH和(9-V)mL二甲基亚砜为A2。在517 nm处测定其吸光值A,平行三次。
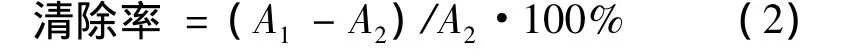
(2)式中:A1为空白吸收值(t=0 min);A2为反应30 min后的吸光度值
1.2.4 常规扩散法测定抑菌效果 配制不同质量浓度的石油醚、三氯甲烷、乙酸乙酯萃取物,分别考察其对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、黑曲霉的抑制作用,采用常规扩散法[11]即用配好的不同质量浓度梯度的待测溶液浸透滤纸片(滤纸片直径d=12.56 mm);待其自然晾干后放入接有菌种的培养皿中。利用其扩散作用,使滤纸片上的药品溶入培养基中。菌种在经过24 h或48 h培养后(细菌培养24 h、真菌培养48 h),观察培养皿中有无抑菌圈,每个质量浓度三个水平(n=3),采用十字交叉法测量其直径,然后取平均值,测量其抑菌圈大小,由抑菌圈的有无来证明其是否有抑菌作用,并由抑菌圈大小的比较说明抑菌作用的强弱。并用固体平板培养基稀释法[13]测定最小抑菌质量浓度MIC。
2 结果与讨论
2.1 沙煲暗罗根乙醇提取物的抗氧化活性结果
2.1.1 清除羟基自由基能力 由图1和表1得出,四个部位对羟基自由基都有一定的清除能力,样品质量浓度增大,清除羟基自由基能力增强。从IC50值可以看出,乙酸乙酯萃取物的清除能力最强,水相最弱,且乙酸乙酯、三氯甲烷和石油醚萃取物的清除能力强于Vc,水相部位较Vc弱。

图1 清除羟基自由基的能力Fig.1 Hydroxyl radical scavenging activity

表1 清除羟基自由基(OH·)的IC50值Tab.1 IC50values for scavenging hydroxyl radical
2.1.2 清除DPPH自由基能力 由图2和表2得出,4个部位对DPPH都有一定的清除能力,样品质量浓度增大,样品清除DPPH的能力增强。从IC50值可以看出,乙酸乙酯萃取物的清除能力最强,水相最弱,且4种萃取物的清除能力强于Vc。
综上所述,4个部位都有一定的抗氧化活性,与Vc相比,乙酸乙酯萃取物IC50最小,三氯甲烷萃取物次之,再次是石油醚萃取物,水相最大。

图2 清除DPPH的能力Fig.2 The activity of scavenging DPPH free radical

表2 清除DPPH的IC50值Tab.2 IC50values for scavenging DPPH free radical
2.2 沙煲暗罗根乙醇提取物抑菌实验 不同质量浓度的沙煲暗罗根乙醇提取物的石油醚萃取物、三氯甲烷萃取物和乙酸乙酯萃取物和水相部位对枯草杆菌、大肠杆菌、金黄色葡萄球菌、黑曲霉的抑制作用,结果见表3。可以看出,三氯甲烷萃取物对枯草杆菌、大肠杆菌、金黄色葡萄球菌有一定的抑制作用,而对黑曲霉没有抑制作用,石油醚萃取物、三氯甲烷萃取物和乙酸乙酯萃取物和水相部位对以上4种菌种的没有抑制作用。三氯甲烷萃取物的最小抑菌浓度见表4。

表3 沙煲暗罗根乙醇提取物的抑菌效果Tab.3 The antimicrobial effect of extracts from the root of Polyalthia consanguinea
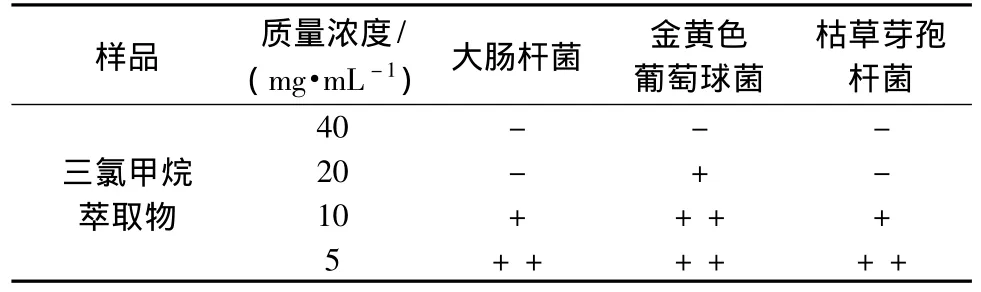
表4 三氯甲烷萃取物的最小抑菌质量浓度Tab.4 The MIC values of the chloroform extract
结果可知,沙煲暗罗根乙醇提取物石油醚、乙酸乙酯萃取物和水相部位对枯草杆菌、大肠杆菌、金黄色葡萄球菌和黑曲霉无明显抑制作用,三氯甲烷萃取物对枯草杆菌、大肠杆菌、金黄色葡萄球菌有一定的抑制作用,对黑曲霉无抑制作用。从表4看出,三氯甲烷萃取物质量浓度为20 mg/mL时,大肠杆菌和枯草芽孢杆菌不生长,其MIC为20 mg/mL,同时,对金黄色葡萄球菌的最小抑菌质量浓度为40 mg/mL。
3 讨论
沙煲暗罗根乙醇提取物不同极性萃取物都有一定的抗氧化活性,其中乙酸乙酯萃取物对羟基自由基和DPPH活性最好,其IC50值分别为110.8、156.5 μg/mL,三氯甲烷萃取物次之,再次是石油醚萃取物,水相活性最后;同时,三氯甲烷萃取物有明显的抑菌效果,对大肠杆菌和枯草芽孢杆菌最小抑菌质量浓度均为20 mg/mL,对金黄色葡萄球菌的最小抑菌质量浓度为40 mg/mL。这表明通过萃取可以有效富积沙煲暗罗根抗氧化和抗菌成分,并且并非单一成分。这一结果为之后对其有效成分的分离鉴定提供了导向,同时为沙煲暗罗根中的天然抗氧化和抑菌物质及以其为原料的药品、食品的开发和研究提供了依据。本实验填补了沙煲暗罗抗氧化和抑菌研究的空白,为进一步研究该植物提供了基础和理论依据。
[1]中国科学院华南植物研究所.海南植物志:第1卷[M].北京:科学出版社,1964:247.
[2]张 园,王 菁,刘冰晶,等.海南四种暗罗属植物挥发油对三种癌细胞的体外增殖抑制作用[J].山东医药,2011,51(15):62-64.
[3]Ma X,Lee I S,Chai H B,et al.Cytotoxic clerodane diterpenes from Polyalthia barnesii[J].Phytochemistry,1994,37(6):1659-1662
[4]Kanokmedhakul S,Kanokmedhakul K,Lekphrom R.Bioactive constituents of the roots of Polyalthia cerasoides[J].J Nat Product,2007,70(9):1536-1538.
[5]Ngantchou I,Nyasse B,Denier C,et al.Antitrypanosomal alkaloids from Polyalthia suaveolens(Annonaceae):Their effects on three selected glycolytic enzymes of Trypanosoma brucei[J].Bioorg Med Chem Lett,2010,20(12):3495-3498.
[6]刘慧燕,赵谋明.江蓠低分子多糖的提取以及抗氧化的研究[J].食品工业科技,2005,26(3):67-69.
[7]黄美娥,卓儒洞,唐 莉.紫花地丁乙醇提取物的抗氧化性研究[J].食品科技,2007(2):152-154.
[8]孟 洁,杭 瑚.虎杖提取物的抗氧化活性及稳定性研究[J].化学世界,2000(8):418-421.
[9]王 琪,田迪英,杨荣华.果蔬抗氧化活性测定方法的比较[J].食品与发酵工业,2008,34(5):166-168.
[10]丰永红,于淑娟,李国基,等.DPPH法测甘蔗提取物抗氧化活性研究[J].甘蔗糖业,2003(1):31-35.
[11]方美珠,晁群芳,兰 雁,等.新疆一枝蒿提取物抑菌作用的研究[J].食品科技,2011,36(1):160-162,166
[12]刘 平,段玉峰,肖 红,等.崖柏乙醇提取物抑菌作用的初步研究[J].中南林业科技大学报,2011,31(4):66-69.
