鼻咽癌组织中肿瘤干细胞的鉴别及其临床意义研究△
2012-11-01彭建华张悦陈建福张虎祥
彭建华 张悦 陈建福 张虎祥
鼻咽癌(nasopharyngeal carcinoma,NPC)是头颈部常见的恶性肿瘤之一,其发病率在中国的南部沿海地区较高。由于其位置深且对放射治疗(简称放疗)敏感,因此放疗是NPC首选的治疗措施。尽管目前放疗技术及设备不断进步,鼻咽癌患者的5年生存率仍然较低[1]。近年来,研究者在人类的多种恶性肿瘤内包括乳腺[2]、脑[3]、前列腺[4]、卵巢[5]以及胰腺[6]等均发现有一小群细胞,这些细胞具有一系列类似于胚胎干细胞的独特性质如多能分化、增殖、影响细胞周期、血管形成以及自我更新等,因此称为肿瘤干细胞(cancer stem cells,CSCs)。有研究表明,这些肿瘤干细胞在恶性肿瘤的发生、发展及治疗抵抗方面均具有重要意义。但在鼻咽癌组织中是否也存在此类肿瘤干细胞,则报道较少。本研究通过对一组鼻咽癌患者组织内肿瘤干细胞进行鉴定,以明确肿瘤干细胞在鼻咽癌组织中的存在,并探讨肿瘤干细胞在鼻咽癌的发生、发展中的作用机制。
1 材料与方法
1.1 材料 本研究所需的材料取自2001年6月~2008年6月于本科门诊就诊并经病理学确诊的32例鼻咽癌患者。患者年龄18~62岁,平均46.6岁。其中5例为高分化鳞癌、18例为中分化角化型鳞癌、9例为未分化型。5例正常人的鼻咽部黏膜作为正常对照。所有的鼻咽部黏膜标本均经病理证实。每位患者在取标本前均签署知情同意书。
1.2 方法
1.2.1 免疫组织化学 全部标本均经10%甲醛固定,常规脱水,石腊包埋切片,切片层厚6 μm。切片抗原修复后,过氧化氢处理,磷酸盐缓冲液(phosphate buffer solution,PBS)室温下冲洗数次,一抗4℃孵育过夜,二抗37℃孵育30 min,二氨基联苯胺 (diaminobenzidine tetrahydrochloride,DAB)染色,苏木精复染,树胶封片。以PBS代替一抗作为阴性对照。切片做好后,以Nikon显微镜及Magnifire彩色数码相机获取图像。细胞染成棕色且无背景着色者为免疫组织化学阳性。每张切片在400倍光学显微镜下随机观察10个视野,每个视野计数100个肿瘤细胞,阳性细胞数占全部肿瘤细胞数百分比(阳性表达率)≥25%为阳性表达,<25%为阴性表达。
实验所用的一抗 Ki-67、MCM2、SOX1、PCNA、CD133、nestin、OCT4、SOX2、Notch1、NICD、Jagged1、Hes1以及C-Kit等均由美国BUCK老年病研究所的金坤林教授惠赠。
1.2.2 双标免疫组织化学 双标免疫组织化学的实验步骤与上相同,在上述实验一抗添加后,加入鼠单克隆抗体 Ki-67抗原,二抗为 Alexa Fluor 488-,594-,或647-IgG。通过Axiovert 200倒置显微镜观察图像,并采用LSM 510 NLO共聚焦成像系统进行图像采集,三维图像合成采用Imars软件进行。待测细胞呈现出特异性荧光染色者为阳性表达。
1.2.3 细胞计数 增殖指数被定义为 Ki-67或者PCNA阳性细胞数目占视野内总细胞数目的百分比。所有的细胞计数均在400倍的光镜下进行。血细胞不列入计数范围。
1.3 统计学处理 数据输入SPSS for Windows软件内进行χ2检验,当P<0.05时,认为差异有统计学意义。
2 结果
胚胎干细胞的表面标记物SOX2以及OCT4选择性地在鼻咽癌组织中高表达,其阳性率分别为65.6%(21/32)以及 71.9%(23/32),而在正常鼻咽组织中则无表达。同时,这些细胞的表面还表达有其他干细胞标记蛋白,如SOX1、nestin以及CD133等(图1)。
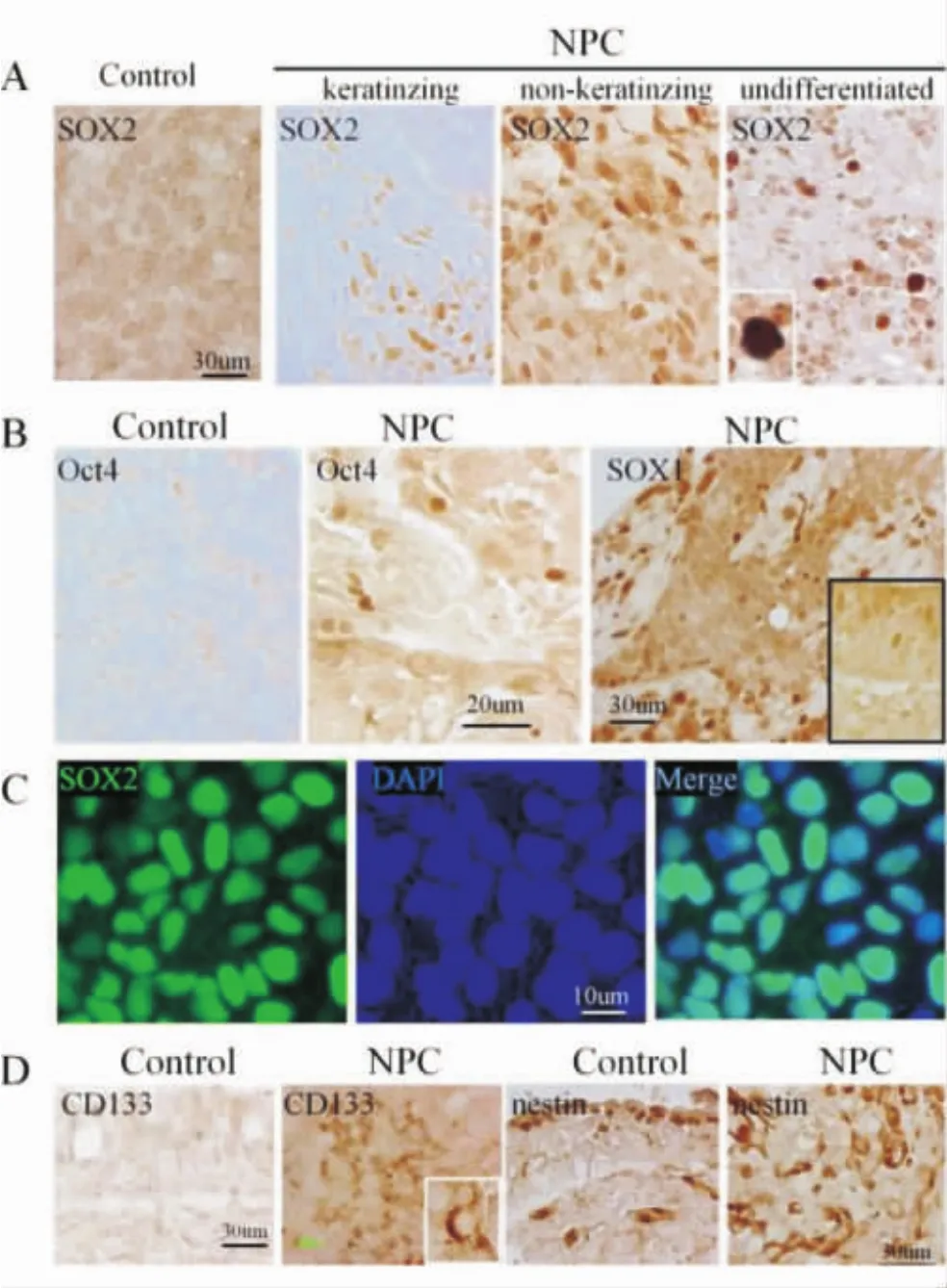
图1.A:SOX2在正常对照组黏膜中无明显表达但在鼻咽癌组织中均是高表达;B:OCT4在正常对照组黏膜中无明显表达但在鼻咽癌组织中均是高表达;C:SOX2在胚胎干细胞中高表达;D:CD-133在正常黏膜中无表达而在鼻咽癌组织中高表达,nestin在正常黏膜中表达很少,而在鼻咽癌组织中高表达
与细胞增殖相关的蛋白,如 Ki-67、PCNA以及MCM2等在大多数的鼻咽癌细胞上有表达,其中中分化非角化型(49.3%)以及未分化型(51.5%)的增殖指数显著高于高分化角化型(31.2%)(P<0.05)(图2)。
与正常鼻咽部组织相比,Notch1受体(阳性率为78.1%,25/32)及其配体 Jagged1(阳性率为 71.9%,23/32)的表达在鼻咽癌细胞中是显著升高的。同时Notch1受体的激活形式 NICD(阳性率为 68.8%,22/32)以及其下游的靶蛋白Hes1(阳性率为65.6%,21/32)在Notch1阳性细胞上也有表达。双标免疫组织化学表明,在NICD阳性细胞上同时也表达Ki-67,表明这些细胞也具有很强的增殖性(图3)。双标免疫组织化学同时还表明在SOX2以及OCT4阳性细胞上,也有NICD的表达。此外,Hes1在此类细胞的表面也有表达(图4)。
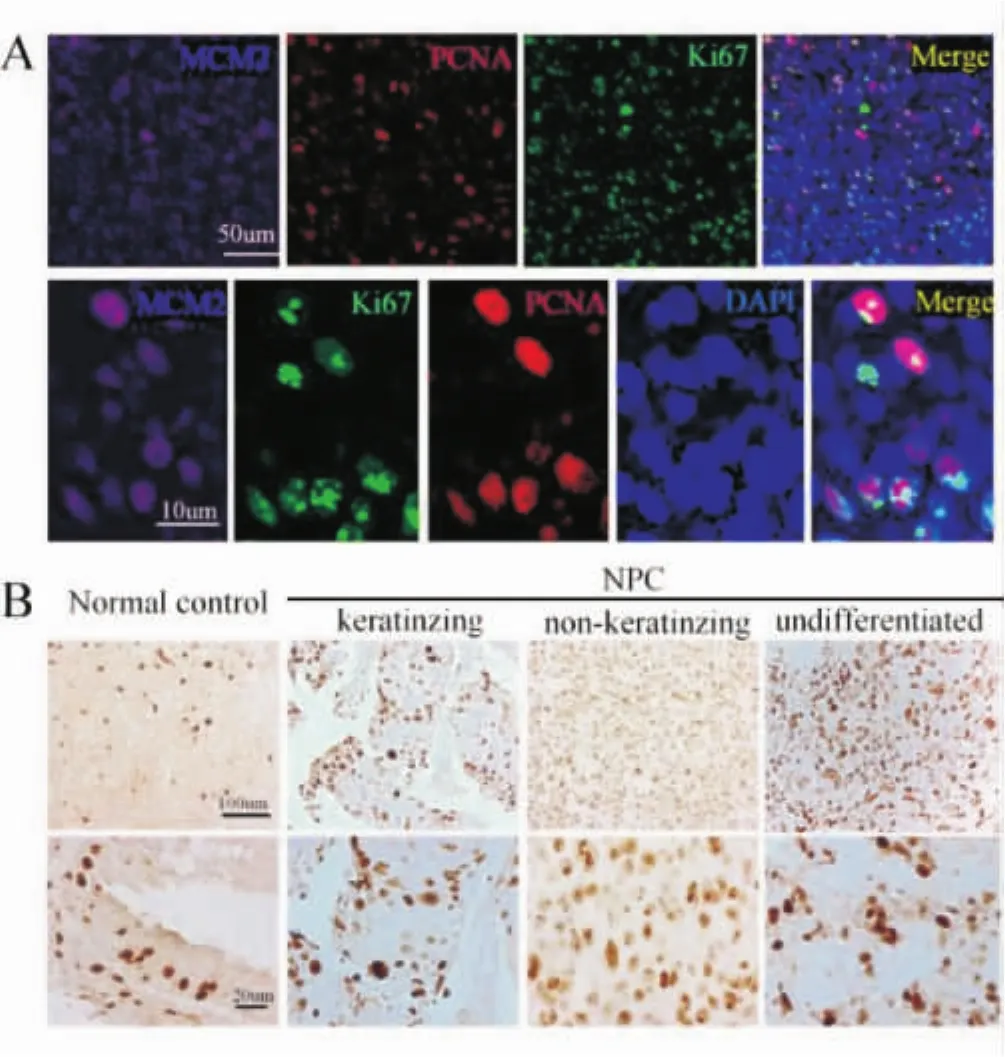
图2.各型鼻咽癌组织的细胞均具有较高的增殖指数,分化良好的角化型NPC增殖指数显著低于中分化角化型以及未分化型NPC A:为双标免疫组织化学结果;B为免疫组织化学结果。其中上排均为低倍镜,下排均为高倍镜
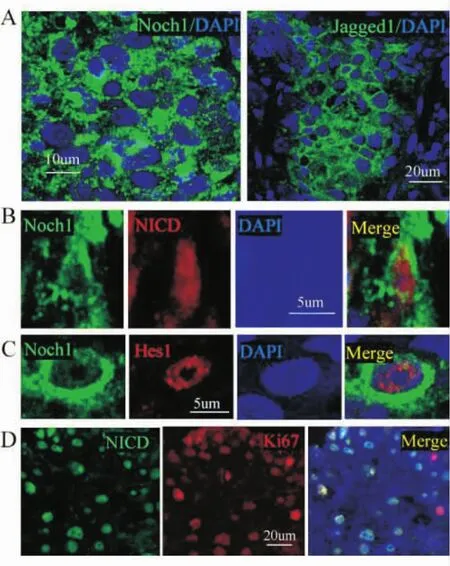
图3.A:鼻咽癌组织中Notch1受体及其配体Jagged1蛋白在鼻咽癌细胞中均有表达;B:Notch1受体活化形式NICD蛋白;C:NICD蛋白下游靶基因蛋白Hes1在Notch1受体阳性细胞上的表达;D:Ki-67在NICD阳性细胞上的表达

图4.A、B:分别显示NICD在SOX2以及OCT4阳性细胞上的表达情况;C、D:分别显示Notch1受体活化形式NICD及其下游靶蛋白Hes1在SOX2及OCT4阳性表达细胞中的表达情况,表明鼻咽癌肿瘤干细胞中Notch1信号途径是激活的
3 讨论
在本研究中,我们发现胚胎干细胞的表面标记物SOX2和OCT4在鼻咽癌组织的一小部分细胞中有表达,而在正常组织中无表达。同时这一部分细胞还表达有其他一些干细胞的表面标记物(图1)。这一结果表明,在鼻咽癌细胞组织中也存在着肿瘤干细胞样细胞。双标免疫组织化学进一步显示这部分细胞增殖相关蛋白高表达,具有高度的增殖性(图2)。此外我们还发现,Notch1受体及其配体在鼻咽癌细胞中也有表达,其受体的激活形式NICD及其下游靶蛋白Hes1等在SOX2和OCT4阳性细胞表面均有表达,这一结果提示Notch1信号途径在这些细胞上呈激活状态(图3~4)。
SOX2和OCT4是表达在胚胎干细胞表面的2种重要转录因子,其对于维持胚胎干细胞的多能分化潜能具有重要作用[7-8]。有研究[9]表明,敲除这2个转录因子的胚胎干细胞丧失了多能分化潜能。我们的研究表明,这2个重要的胚胎干细胞转录因子在人鼻咽癌组织的一小群细胞里面有表达。因此在鼻咽癌组织中也存在着肿瘤干细胞样细胞。
Notch信号途径是一个高度保守的信号途径,主要控制特定细胞的分化、增殖、凋亡以及干细胞发育过程的维持。其对成体干细胞增殖的控制作用已经在多种细胞内得到了证实,如血液细胞和神经细胞等[10]。近期的研究[11]表明,Notch信号途径的激活在多种人类恶性肿瘤的形成及进展中均具有重要作用。这些肿瘤包括神经纤维瘤、皮肤癌、肺癌以及前列腺癌等。
在与配体结合后,Notch受体被γ-分泌酶水解从而转变为其活化形式NICD。NICD进入细胞核后可以与转录因子CSL结合形成NICD/CSL复合物,该复合物可以使CSL从转录抑制因子转变成转录活化因子,并最终激活Hes以及Herp等靶基因[12]。本研究中,我们观察到NICD以及Hes1在鼻咽癌细胞中均有表达,这表明Notch1信号途径在鼻咽癌细胞中是激活的。更重要的是Notch1信号途径激活的细胞均是胚胎干细胞标志蛋白阳性的细胞。已有诸多的证据表明,Notch信号途径在实体恶性肿瘤的发生中具有重要意义[13-14],因此我们推测,Notch信号途径在鼻咽癌组织中肿瘤干细胞的调控进而影响鼻咽癌的生物学特性上具有重要意义。越来越多的证据表明,肿瘤干细胞在治疗抵抗以及复发中具有重要意义,因此靶向肿瘤干细胞的有效治疗可以为恶性肿瘤包括鼻咽癌的治疗提供一种新的途径。
[1]Anguineti G,Geara FB,Garden AS,et al.Carcinoma of the nasopharynx treated by radiotherapy alone:determinants of local and regional control[J].Int J Radiat Oncol Biol Phys,1997,37(5):985-996.
[2]Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci USA,2003,100(7):3983-3988.
[3]Singh SK,Hawkins C,Clarke ID,et al.Identification of human brain tumour initiating cells[J].Nature,2004,432(7015):396-401.
[4]Lang SH,Frame FM,Collins AT.Prostate cancer stem cells[J].J Pathol,2009,217(2):299-306.
[5]Zhang S,Balch C,Chan MW,et al.Identification and characterization of ovarian cancer-initiating cells from primary human tumors[J].Cancer Res,2008,68(11):4311-4320.
[6]Li C,Heidt DG,Dalerba P,et al.Identification of pancreatic cancer stem cells[J].Cancer Res,2007,67(3):1030-1037.
[7]Nichols J,Zevnik B,Anastassiadis K,et al.Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4 [J].Cell,1998,95(3):379-391.
[8]Avilion AA,Nicolis SK,Pevny LH,et al.Multipotent cell lineages in early mouse development depend on SOX2 function[J].Genes Dev,2003,17(1):126-140.
[9]Matin MM,Walsh JR,Gokhale PJ,et al.Specific knockdown of Oct4 and beta2-microglobulin expression by RNA interference in human embryonic stem cells and embryonic carcinoma cells[J].Stem Cells ,2004,22(5):659-668.
[10]Dontu G,Jackson KW,McNicholas E,et al.Role of Notch signaling in cell-fate determination of human mammary stem/progenitor cells[J].Breast Cancer Res,2004,6(6):605-615.
[11]Rizzo P,Osipo C,Foreman K,et al.Rational targeting of Notch signaling in cancer[J].Oncogene,2008,27(38):5124–5131.
[12]Artavanis-Tsakonas S,RandMD,Lake RJ.Notch signaling:cell fate control and signal integration in development[J].Science,1999,284(5415):770-776.
[13]Lee CW,Simin K,Liu Q,et al.A functional Notch-survivin gene signature in basal breast cancer[J].Breast Cancer Res,2008,10(6):R97.
[14]Garzia L,Andolfo I,Cusanelli E,et al.MicroRNA-199b-5p impairs cancer stem cells through negative regulation of HES1 in medulloblastoma[J].PLoS ONE,2009,4(3):4998.
