生物法合成AA-2G的菌种产酶条件及转化方法研究
2012-10-30关丽杰
邵 双, 丁 淼, 关丽杰
(沈阳化工大学制药与生物工程学院,辽宁沈阳 110142)
L-抗坏血酸(即维生素C,VC)为水溶性维生素,其作为酸性药剂、还原剂、抗氧化剂、漂白剂以及化学反应物、食品和饮料中的稳定剂[1]被广泛使用.临床上主要用于防治坏血病和传染病,促进创伤愈合,是作为辅助治疗的保健药品.在化妆品中可作为还原剂、紫外线吸收剂和黑色素形成抑制剂.但L-抗坏血酸还原性强,极不稳定,极易被热和氧化剂破坏,尤其是光、重金属和荧光物质能促进其氧化[2],使其在应用方面受到很大限制.因此,如何增强稳定性是其应用时急需解决的首要问题.近期,人们致力于L-抗坏血酸的衍生物研究,试图找出既具有L-抗坏血酸的作用,又具有高稳定性的衍生物.2-氧-α-D-吡喃型葡萄糖基抗坏血酸(AA-2G)是由日本林原生物化学研究所与冈山大学药学系共同发现的,其具有更高的稳定性及抗氧化性,同时更易于吸收和利用[3-6].AA-2G的化学合成十分困难,而采用糖基转移酶,如α-葡萄糖苷酶、环麦芽糊精聚糖转移酶等[7],可将糖及供体的D-吡喃型葡萄糖基部分转移到L-抗坏血酸的2-碳位置的羟基基团上脱水生成AA-2G,该生物转化法是生产AA-2G可行途径.然而迄今,我国对大量生产AA-2G的技术尚不成熟,本文对提高AA-2G合成效率的方法进行探讨.
1 材料与方法
1.1 实验材料
供试菌种为沈阳化工大学生物工程实验室筛选并保藏的环麦芽糊精聚糖转移酶产酶菌种SHⅢA,该菌种为反硝化利斯特氏菌.菌种培养基为:可溶性淀粉 20 g,蛋白胨 5 g,Mg2SO4·7H2O 0.1 g,K2HPO40.5 g,Na2CO32 g,蒸馏水 1 000 mL,pH 7.平板培养基加琼脂7 g/L.
1.2 实验方法
1.2.1 环麦芽糊精聚糖转移酶酶活测定
菌种发酵液以4 000 r/min离心20 min,取上清液即为粗酶.取10 μL稀释10倍的酶液,加入0.2 mol/mL甘氨酸-NaOH-NaCl缓冲液(pH8.55)0.2 mL,再加入质量分数为0.2%的可溶性淀粉液0.2 mL,振荡,于40℃水浴反应10 min,立即加入0.5 mL 0.5 mol/mL醋酸溶液终止反应,然后加入3 mL质量分数为0.005%的碘液显色,同时以蒸馏水为空白,不加酶液为对照,于700 nm波长处测定吸光度(OD值).使吸光度下降10%的酶量定义为一个酶活单位.按以下公式计算:

式中a为对照组的吸光度,b为样品的吸光度
1.2.2 AA-2G的合成方法
在预先放好质量分数为0.2%硫脲2 mL的试管中加入质量分数为2%的L-抗坏血酸溶 液10 mL、质量分数为4%的 α-环糊精10 mL、发酵上清液20 mL,调节pH为6,抽真空后将试管放入恒温摇床中,在200 r/min、上盖锡纸、45℃条件下反应20 h.反应结束后加入1 mmol/L的 CuSO4溶液0.2 mL,以除去未反应的残余L-抗坏血酸,100℃灭酶2 min.
1.2.3 AA-2G含量测定
标准加入法.采用稀释适当倍数的待测反应液配制L-抗坏血酸的系列梯度浓度溶液,以此为标准溶液,于700 nm波长处测定吸光度(OD值),绘制标准曲线.
1.2.4 菌种产酶条件的优化
菌种采用1.1中的培养基进行培养,分别针对菌种培养的碳源、氮源、金属离子、pH值、温度、接种量、培养时间7个因素,设计单因子实验,重复3次,培养后测定菌悬液中环麦芽糊精聚糖转移酶酶活,探知最佳菌种产酶条件.碳源分别采用可溶性淀粉、糊精、葡萄糖、蔗糖、乳糖、麦芽糖、果糖,每种碳源均取20 g/L,替代1.1培养基中的可溶性淀粉.
氮源采用硫酸铵、氯化铵、酵母膏、蛋白胨、硝酸钾、尿素,每种氮源的含氮量相当于5 g/L蛋白胨,替代1.1培养基中的蛋白胨.
在前述确定的最佳培养基中分别添加Ca2+、Mn2+、Co2+、Fe2+、Cu2+、Fe3+、Zn2+、Na+、K+的硝酸盐或硫酸盐,浓度均为0.5 mmol/L,以考察金属离子对产酶活性的影响.
在培养6~96 h范围内,间隔6 h连续测定酶活,探知最佳菌种培养时间.
分别设置培养基的 pH 为 6、7、8、9、10、11、12、13,探知最佳 pH 值.
分别设置培养温度为 20、25、30、35、40、45℃,探知最佳培养温度.
分别设置接种量为6%、8%、10%、12%、15%、20%进行菌株发酵,测定酶活以确定最佳培养条件.
1.2.5 AA-2G的合成条件优化
产酶菌种采用1.2.4确定的最佳条件进行培养,菌悬液离心上清液为环麦芽糊精聚糖转移酶粗酶液,以L-抗坏血酸为底物合成AA-2G.设计单因子实验,3次重复,考察反应温度、糖基供体的种类、L-抗坏血酸的浓度、反应时间及底物与糖基供体的浓度比对AA-2G合成的影响.
反应温度分别设置为 20、25、30、35、40、45℃,以确定最佳温度.
糖基供体分别选用糊精、麦芽糖、羧甲基纤维素钠、β-环糊精、玉米淀粉,以确定底物.
VC质量分数分别设置为2%、6%、10%、14%、18%、22%、26%,以确定最佳质量分数.
在确定VC最佳质量分数基础上,采用最佳糖基供体,设置VC与糖基供体的质量比率分别为 1∶0.5、1∶0.75、1∶1、1∶1.5、1∶2.
反应时间分别设置为 20、30、44、54、68 h.测定AA-2G的含量,探明AA-2G最佳合成条件.
2 结果与分析
2.1 菌种产酶条件的优化
2.1.1 碳源对菌种产酶活性的影响
分别采用7种碳源培养菌种后测定酶活,结果绘于图1.由图1可知:麦芽糖为碳源时酶活最高,达513 U/mL,其次为果糖和蔗糖,采用葡萄糖时酶活仅为63 U/mL.故在后续实验中均采用麦芽糖为碳源.
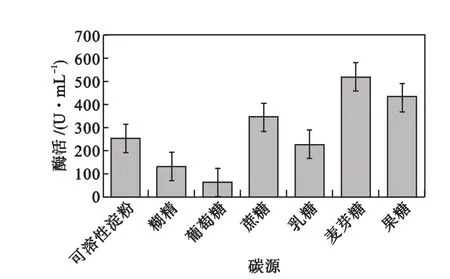
图1 碳源种类对菌种产环麦芽糊精聚糖转移酶活性的影响Fig.1 Effect of carbon source on CGTase activity produced by the given bacteria
2.1.2 氮源对菌种产酶活性的影响
分别采用6种氮源进行菌种培养后测定酶活,结果绘于图2.由图2可知:蛋白胨为氮源时酶活最高,达1 200 U/mL,其次为硫酸铵和氯化铵,采用尿素时酶活仅为619 U/mL.故在后续实验中均采用蛋白胨为氮源.

图2 氮源对菌种产环麦芽糊精聚糖转移酶活性的影响Fig.2 Effect of nitrogen source on CGTase activity produced by the given bacteria
2.1.3 金属离子对菌种产酶活性的影响
在培养基中分别添加9种金属离子进行菌种培养后测定酶活,结果绘于图3.

图3 金属离子对菌种产环麦芽糊精聚糖转移酶活性的影响Fig.3 Effect of metallic ion on CGTase activity produced by the given bacteria
由图3可知:添加 Cu2+时酶活最高,达1 083 U/mL,添加Mn2+和Co2+也可获得较高酶活,添加K+时酶活仅为398 U/mL.若培养基中不添加金属离子,则酶活更低,为267 U/mL.故在后续实验中均添加Cu2+.
2.1.4 pH值对菌种产酶活性的影响
培养基pH在6~13变化时的酶活结果绘于图4.结果显示:酶活随pH升高而增大,当pH值为10时酶活最高,随后降低.故在后续实验中pH均调整为10.

图4 pH对菌种产环麦芽糊精聚糖转移酶活性的影响Fig.4 Effect of pH on CGTase activity produced by the given bacteria
2.1.5 培养温度对菌种产酶活性的影响
培养温度在20~45℃范围内变化时的酶活结果绘于图5.结果显示:酶活随温度升高而增大,当温度为35℃时酶活最高,随后降低.故在后续实验中培养温度均为35℃.

图5 温度对菌种产环麦芽糊精聚糖转移酶活性的影响Fig.5 Effect of temperature on CGTase activity produced by the given bacteria
2.1.6 接种量对菌种产酶活性的影响
由图6可知:接种量对酶活的影响较大,当接种量为10%时,酶活最高.故后续实验的接种量均为10%.
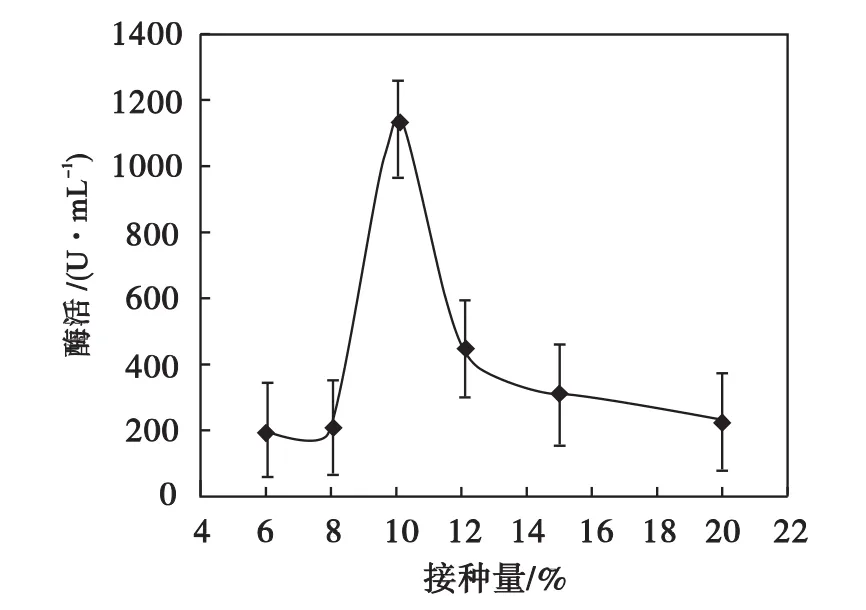
图6 接种量对菌种产环麦芽糊精聚糖转移酶活性的影响Fig.6 Effect of inoculation amount of bacteria on CGTase activity
2.1.7 培养时间对菌种产酶活性的影响
在6~96 h内连续测定酶活,结果绘于图7.结果显示:随着培养时间延长,酶活逐渐增大,72 h时酶活最高,达1 080 U/mL,随后逐渐降低.故在后续实验中菌种的培养时间均为72 h.

图7 培养时间对菌种产环麦芽糊精聚糖转移酶活性的影响Fig.7 Effect of cultural time on CGTase activity produced by the given bacteria
采用上述最佳产酶条件,即麦芽糖为碳源,蛋白胨作为氮源,金属离子为Cu2+,pH值为10,培养温度为35℃,接种量为10%,培养微生物,进行验证试验.最高酶活可达1 130 U/mL.
2.2 AA-2G的合成条件优化
采用2.1的最佳产酶条件培养菌种,获得粗酶液,对生物转化法合成AA-2G进行研究.
AA-2G含量的测定采用标准加入法.以AA-2G质量浓度为横坐标,700 nm波长处的吸光度(OD值)为纵坐标,绘制标准曲线,其为不经过原点的直线,如图8所示.

图8 AA-2G含量标准曲线Fig.8 The standard curve of AA-2G content
2.2.1 糖基供体种类对AA-2G合成的影响
由表1可知:β-环糊精作为糖基供体时,AA-2G的产量最高,为3.68 g/L,其次为麦芽糖,羧甲基纤维素钠的产量最低.在后续实验中均以β-环糊精为糖基供体.

表1 糖基供体对AA-2G合成的影响Table 1 Effect of donors of glycosyl on AA-2G synthesis
2.2.2 VC质量分数对AA-2G合成的影响
以不同VC质量分数进行反应,当其为22%时,AA-2G的含量最高,为6.76 g/L,18%时产量也较高,而10%以下时,AA-2G产量均较低(见表2).在后续实验中VC质量分数均采用22%.

表2 VC质量分数对AA-2G合成的影响Table 2 Effect of concentration of VC on AA-2G synthesis
2.2.3 反应温度对AA-2G合成的影响
合成AA-2G时的反应温度以20℃最为适宜,产量可高达7.93 g/L,25℃和30℃时稍有降低,当反应温度达40℃及以上时,产量急剧降低(见表3).这是由于在微生物培养中,酶活最高时的温度为35℃,高温可能引起酶活下降,从而导致AA-2G的合成减缓.在后续实验中反应温度均为20℃.

表3 反应温度对AA-2G合成的影响Table 3 Effect of reaction temperature on AA-2G synthesis
2.2.4 反应时间对AA-2G合成的影响
表4显示:反应时间为30 h时,AA-2G的含量最高,为7.23 g/L,再延长反应时间,产量不仅没有提高,反而明显降低.研究表明:环麦芽糊精聚糖转移酶具有催化AA-2G生物合成的作用,也有催化逆反应即AA-2G分解的双向作用[8],故反应时间过长,存在AA-2G逆反应发生的现象,引起产量降低.

表4 反应时间对AA-2G合成的影响Table 4 Effect of reaction time on AA-2G synthesis
2.2.5 VC与糖基供体质量比对AA-2G合成的影响
当VC的质量分数为22%时,VC与β-环糊精的质量比为1∶1.5时,AA-2G的含量最高,为8.60 g/L(表5).

表5 VC与β-环糊精质量比对AA-2G合成的影响Table 5 Effect of ratio of VC and β-cyclodextrin on AA-2G synthesis
3 结论与讨论
(1)供试菌种产环麦芽糊精聚糖转移酶的最佳条件为:麦芽糖为碳源,蛋白胨作为氮源,金属离子为Cu2+,pH值为10,培养温度为35℃,接种量为10%,酶活性可达1 130 U/mL.该酶活值较之其它研究偏低,可能是测定方法不同所致,在合成反应中证明该酶活能满足生产需求.
(2)生物法合成AA-2G的最佳反应条件为:反应温度20℃,VC质量分数为22%,β-环糊精作为糖基供体且其质量分数为33%,反应时间为30 h,AA-2G的产量可高达8.60 g/L.据曹新志(2008)的研究,获得AA-2G的产量为95.36 mg/L[8],而王鹏等(2008)为 410 mg/L[9],黄敏等(2006)为 104.21 mg/L[10],与本文测得的产量差异较大,这里不排除测定方法差异、生物异质性等因素所致,但更主要的是菌种的差异,还有转化方法的不同,如实验中发现,将传统的水浴锅改进为摇床中反应,使生产率大大提高,并使高浓度底物的投加成为可能.本文中的AA-2G产率具有非常大的应用价值,值得在此基础上继续研究.
[1] 赵丽华,裘娟萍,黄敏,等.抗坏血酸糖类衍生物的研究进展[J].饲料工业,2004,25(2):28.
[2] 王红梅.营养与食品卫生学[M].上海:上海交通大学出版社,2000:51.
[3] Kubota M,Tsusaki K,Higashiyama T,et al.Alphaisomaltosyl-glucosaccharide Synthase,Process for Producing the Same and Use There of:US,7241606[P].2007-07-10.
[4] Mukai K,Tsusaki K,Kubota M,et al.Process for Producing 2-O-alpha-D-glucopyranosyl-L-ascorbic Acid:EP,1553186[P].2005-07-13.
[5] Sadako N,Tsuneyuki O.Bioavailability of 2-O-α-dglu-copyranosyl-l-ascorbic Acid as Ascorbic Acid in Healthy Humans[J].Nutrition,2009,6(25):686-691.
[6] Ichiyama K,Mitsuzumi H,Zhong M,et al.Promotion of IL-4-and IL-5-dependent Differentiation of Anti-muprimed B Cells by Ascorbic Acid 2-glucoside[J].Immunology Letters,2009,122(2):219-226.
[7] 田辉,杨国武,徐颐玲,等.环状糊精与环状糊精葡萄糖基转移酶[J].工业微生物,1995,25(2):33-38.
[8] 曹新志,明红梅.生物合成葡萄糖基-L-抗坏血酸产酶条件及转化条件的优化[J].粮食与油脂,2008(5):17-20.
[9] 王鹏,李江华,陆键,等.生物转化法合成葡萄糖基抗坏血酸的产酶菌株筛选及发酵条件优化[J].食品与发酵工业,2008,34(9):53.
[10]黄敏,裘娟萍,钟莉.酶法生产葡萄糖基维生素C的产酶条件及转化条件优化[J].中国食品添加剂,2006(2):100-104.
