自然杀伤细胞分离、培养方法的建立
2012-10-30朱向情刘凌吴琼陈翠竹雷力王强马丽华庞荣清赵晶何洁张晓晓阮光萍潘兴华
朱向情 刘凌 吴琼 陈翠竹 雷力 王强 马丽华 庞荣清 赵晶 何洁 张晓晓阮光萍 潘兴华
自然杀伤细胞(natural killer cells,NK)是指一类无需预先致敏就可以杀伤某些血液系统肿瘤和变异转化细胞的细胞类群。NK细胞是机体先天获得性免疫系统重要的组成细胞之一,因其杀伤靶细胞无需致敏,可以在免疫应答早期发挥作用;同时NK细胞免疫应答的早期还能释放多种趋化因子和细胞因子,调节机体的特异性免疫应答。因此NK细胞对肿瘤的治疗比较理想,但是人体内NK细胞的数量很少,只占外周血的5﹪~ 10﹪,需要体外扩增到一定的数量后,才能进行治疗。本实验的目的是建立一种简单、高效获得NK细胞的方法。
材料和方法
一、材料
RPMI 1640(美国 GIBCO 公司),淋巴细胞分离液(上海荣盛生物试剂厂),双抗:100万U/ml青霉素和 100 μg/ml链霉素(华北制药厂),rIL-2 10万U/ml(昆明总医院制剂室生产),苯丙氨酸甲酯(L-Phenylalanine methylamine ester,PME,美国Sigma公司)。
二、方法
(一)单个核细胞的分离
取健康人外周血10 ml,枸橼酸盐抗凝。无菌室内,转入 50 ml离心管中,加入 40 ml生理盐水,混匀,2000 ×g离心 3 min 除去上清,加入生理盐水至50 ml,重悬。将细胞悬液平均分配至两支加有20 ml淋巴细胞分离液的离心管中,2000 ×g离心 20 min。吸取以单个核细胞为主的白色云雾层至另一离心管中,加入适量的生理盐水,2000 ×g离心 3 min 除去淋巴细胞分离液。
(二)NK细胞的分离方法和培养扩增
1.NK细胞的分离方法:采用PME法。因PME可进入细胞内,代谢生成苯丙氨酸进入溶酶体内,降低溶酶体内渗透压,使溶酶体破裂,释放出酶使细胞溶解,从而有效去除富含溶酶体的单个核巨噬细胞、B细胞等,但同时不改变淋巴细胞的表型和细胞毒性。利用PME这一特性,将分离得到的单个核细胞,用5 mmol/L PME室温处理40 min,并轻轻的震荡。然后用生理盐水洗涤2 次,1800 ×g离心 3 min。
2.NK细胞的培养扩增:将PME处理后的单个核细胞,加入RPMI 1640完全培养基[含10﹪小牛血清、pH = 7.2],在塑料培养瓶和 6孔板中分别加入 10 ml和 2 ml,每组加 rhIL-2(6000 U/ml)并调整细胞浓度为 5 × 106/ml。培养 3~ 5 h,移去未黏附细胞的悬液,收集黏附于板底表面的细胞,调成细胞浓度为 2 × 106/ml,同时补充 IL-2,细胞终浓度为 6000 U/ml,继续培养,每 3 d 换液1次。
(三)NK细胞活性的检测
1.流式细胞术检测:取单细胞悬液于流式管中,加 1× 磷酸盐缓冲液(phosphate buffer, PBS)4ml 1800 ×g离心 5 min,弃上清,重复 3 次,调节细胞浓度为约 1 × 106个 /100 μl;加抗体(CD16,CD56,CD3),轻轻吹打混匀,4℃避光孵育30 min;加 1 × PBS 4 ml 1800 ×g离心 5 min, 弃上清,重复3次,加500 μl 1 × PBS,轻轻吹打混匀;上机检测。
2.四甲基偶氮唑盐(MTT)比色法:用MTT法检测NK细胞的杀伤活性。在培养的第1、4、7、10、14 天分别取细胞,充分洗涤,以 1 × 106/ml的浓度将效应细胞和靶细胞(A549)加于96孔板(均为3个复孔)中,孵育48 h后,加入MTT 10 μl/孔,4 h 后离心弃上清,加 500 ml/L 无水乙醇和500 g/L二甲基亚砜混合液200 μl/孔,充分吹打、混匀,在酶标仪上读取A450nm值,并按下列公式计算NK细胞的杀伤率。
杀伤率 (﹪) = {1 - [杀伤孔的A值 - 效应孔的A值 ] /靶细胞孔的A值 } ×100﹪
(四)统计学分析方法
采用SPSS17.0软件进行统计学分析,NK细胞表面CD16、CD56、CD3的表达率用相对数表示,不同时间NK细胞杀伤率用x± s不同效靶浓度组间及不同培养时间NK细胞的杀伤率比较采用随机区组方差分析,以P<0.05有统计学意义。
结 果
一、NK细胞的形态学观察
NK 细胞 3~ 5 h 开始贴壁,贴壁后,将悬浮细胞弃掉,重悬NK细胞。在IL-2的刺激下第3天开始增殖,出现集落,第7天时集落最多(图1)。

图1 奥林巴斯相差显微镜下观察NK细胞形态(×100)
二、流式细胞术检测NK细胞表面抗原
收集培养7 d的NK细胞,调整细胞浓度为10 × 106/ml。用流式细胞检测仪检测细胞表面CD16,CD56,CD3的表达率,以确定NK细胞的纯度。结果CD3-表达率为96.5﹪,CD3+表达率为3.1﹪,CD16+和CD56+表达率为31.0﹪(图2)。

图2 诱导培养7d后单个核细胞中CD3+与CD3-流式细胞术检测结果
三、MTT法检测NK细胞的杀伤活性
本实验检测了5个时间点(第1,4,7,14天),3 个效靶浓度比(5:1、10:1、20:1)(图3)。从图中可以看出,第1天和第4天,效靶比为20:1的情况下,杀伤性是最好的,而效靶比在10:1的情况下,杀伤性是最差的;当诱导培养到第7天的时候,开始发生变化,随着效靶比的比率增高,杀伤性反而降低;诱导培养的第10天,效靶比在10:1的浓度下,杀伤性最好;诱导培养的第14天,效靶比在5:1的情况下,杀伤率是最好的(表1)。

图3 不同时间不同效靶浓度的杀伤率
讨 论
NK细胞在感染性疾病中的研究取得了很大的成果。Fortis等[1]报道了NK细胞与HIV-1和人T细胞白血病病毒的相互作用。还有研究报道:发现抗鼠巨细胞病毒需要MHC样糖蛋白活化Ly49H,阐明了不同种系小鼠对CMV敏感性不同的可能原因。NK细胞的激活大多是细胞因子或趋化因子介导的间接作用,而不是直接的NK受体的作用,所以对于利什曼病NK细胞主要是通过细胞因子起作用的;另外,NK细胞还参与锥虫病、鼠弓形体、疟原虫等早期感染的防御[2-4]。研究者们还利用高时间分辨膜电容测定和荧光成像技术发现NK细胞产生分泌性溶酶体,在对抗肿瘤、抗病毒和细胞介导的异体移植排斥反应中发挥重要的防御作用[5]。
表1 培养不同时间NK细胞的杀伤率(﹪,±s)
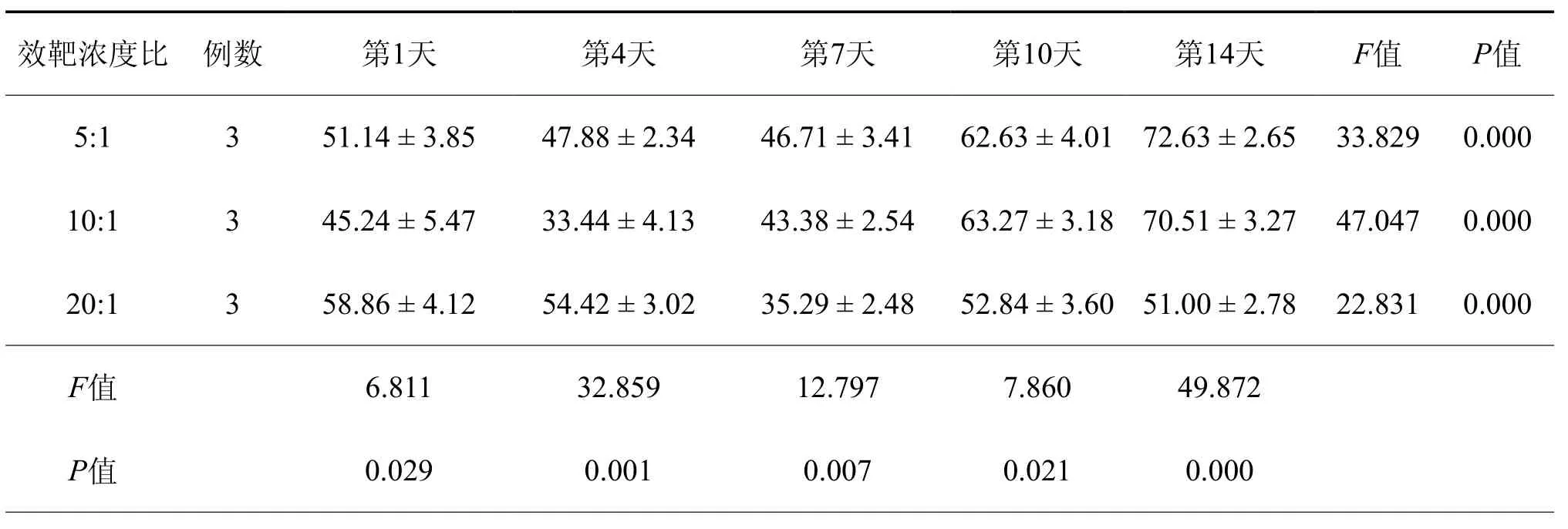
表1 培养不同时间NK细胞的杀伤率(﹪,±s)
效靶浓度比 例数 第1天 第4天 第7天 第10天 第14天 F值 P值5:1 3 51.14 ± 3.85 47.88 ± 2.34 46.71 ± 3.41 62.63 ± 4.01 72.63 ± 2.65 33.829 0.000 10:1 3 45.24 ± 5.47 33.44 ± 4.13 43.38 ± 2.54 63.27 ± 3.18 70.51 ± 3.27 47.047 0.000 20:1 3 58.86 ± 4.12 54.42 ± 3.02 35.29 ± 2.48 52.84 ± 3.60 51.00 ± 2.78 22.831 0.000 F值 6.811 32.859 12.797 7.860 49.872 P值 0.029 0.001 0.007 0.021 0.000
NK细胞作为机体固有免疫的重要组成部分是机体抗肿瘤、抗感染的第一道天然防线。随着对NK细胞生物功能及活化机制的了解,NK细胞在造血干细胞/骨髓移植的辅助治疗及肿瘤过继免疫治疗方面的作用倍受关注。最近在异基因造血干细胞移植中发现供者异源反应性NK细胞可以发挥移植物抗白血病效应,并减少移植物抗宿主病的发生,故输注供者异源反应性NK细胞已经成为临床移植辅助治疗的新策略[6-7]。
本研究用淋巴分离液的方法从外周血分离得到单个核细胞,用PME处理除去单个核巨噬细胞和B细胞,得到较为纯化的NK细胞,用IL-2诱导的方法,纯化NK细胞。实验结果显示:(1)光镜显微镜下,细胞在诱导的第3天开始出现细胞集落,第7天时,细胞的集落最多;(2)流式细胞术的检测结果,表明细胞在诱导的第7天,CD3-为 90.5﹪,CD15+CD56+为 31﹪;(3)MTT检测结果显示,单个核细胞在诱导培养的第1天和第4天,效靶比为20:1的情况下,杀伤性是最好的,而效靶比在10:1的情况下,杀伤性是最差的,当诱导培养到第7天的时候,开始发生变化,随着效靶比的比率增高,杀伤性反而降低,诱导培养的第10天,效靶比在10:1的浓度下,杀伤性好,诱导培养的第14天,效靶比在5:1的情况下,杀伤率是最好的。
实验结果表明:本研究在用NK细胞治疗患者的时候应该选择诱导培养了7 d的细胞,因为这时候的细胞首先扩增的数量是最多的,其次杀伤性是最强的,最后就是少量的细胞就能够达到一定的疗效。本实验为NK细胞应用于临床提供了理论依据。
1 Fortis C, Tasca S, Capiluppi B, et al. Natural killer cell function in HIV-1 infected patients[J]. J Biol Regul Homeost Agents, 2002,16(1):30-32.
2 Une C, Andersson J, Eloranta ML, et al. Enhancement of natural killer(NK) cell cytotoxicity and induction of NK cell-derived interferon-gamma (IFN-gamma) display different kinetics during experimental infection with Trypanosoma cruzi [J]. Clin Exp Immunol, 2000,121(3): 499-505.
3 SherA, Collazzo C, Scanga C, et al. Induction and regulation of IL-12-dependent host resistance to Toxop lasma gondii [J]. Immunol Res, 2003,27 (2-3): 521-528.
4 Stevenson MM, Su Z, Sam H, et al. Modulation of host responses to blood-stage malaria by interleukin-12: from therapy to adjuvant activity [J]. Microbes Infect, 2001,3(1):49-59.
5 Liu DF, Xu L, Yang F, et al. Rapid biogenesis and sensitization of secretory lysosomes in NK cells mediated by target-cell recognition[J]. Proc Natl Acad Sci USA, 2005,102(1): 123-127.
6 Passweg JR, Stern M, Koehl U, et al. Use of natural killer cells in hematopoetic stem cell transplantation[J]. Bone Marrow Transplant, 2005,35(7):637-643.
7 李晓红,高春记.异基因造血干细胞移植中NK细胞的作用 [J].中国实验血液学杂志 , 2006,8(4): 350-354.
