重组腺病毒载体负载树突状细胞诱导乙肝病毒特异性细胞毒性T淋巴细胞
2012-10-30陶然李进张克马世武姜维李溢柔周向军
陶然 李进 张克 马世武 姜维 李溢柔 周向军
特异性细胞免疫反应是机体清除感染病毒和变异细胞的主要机制,体内特异性细胞免疫反应的启动需要抗原递呈细胞(antigen presenting cells,APC),主要包括树突状细胞(dendritic cells,DC)对抗原的递呈[1-2]。慢性乙肝患者体内针对乙肝病毒(hepatitis B virus,HBV)的特异性免疫应答低下,DC功能障碍(如捕获抗原能力下降或成熟受阻等)被认为是主要原因之一[3-5]。本研究探索了用携带有HBV核心抗原(hepatitis B core antigen,HBcAg)基因的重组腺病毒 CHB3体外感染DC进行抗原负载的方法和效果,为慢性乙肝患者体内免疫反应低下提供解决方案。
材料和方法
一、实验材料
1.研究标本:健康志愿者,知情告知并签署知情同意书,肝素钠抗凝管抽取外周静脉血50 ml。
2.主要试剂:淋巴细胞分离液(美国Hyclone公司);GM-CSF、IL-4、Cocktail、IL-2(美国PeproTech公司);1640培养液,AIM-V培养液(美国Invitrogen公司);PAA淋巴细胞培养液(德国PAA公司);CD86- FITC、CD83- PE、CD80- PEcy5、HLA-DRFITC、CD14-APC、CCR7-PE、FITC羊抗鼠荧光二抗(美国BD公司);HBcAg-pentamer-PE检测试剂(美国Proimmune公司)。
二、实验方法
1.外周血单个核细胞(peripheral blood mononuclear cells,PBMC)的分离及 DC 的体外培养:700 ×g离心 20 min 分离血浆,剩余血应用磷酸盐缓冲液(phosphate buffer saline,PBS)1:3稀释后,淋巴细胞分离液分离PBMC,细胞计数,用RPMI1640基培重悬细胞,调整细胞密度为 5 × 106个 /ml,接种于 24 孔板中,每孔接种1 ml,然后置于 37℃、5﹪CO2培养箱内静置培养,1.5 h后,在超净工作台内,吸除未贴壁细胞,并应用无菌杜氏磷酸缓冲液(dulbecco's phosphate buffered saline,DPBS)液洗涤细胞 3 次,最后加入 rhGM-CSF( 800 U/ml)、rhIL-4( 400 U/ml)、青霉素 100 U/ml、链霉素 100 U/ml,并分别用 2﹪ 自体血浆(autologous plasma,AP)的 RPMI1640 完全培养基(或 AIM-V)0.5 ml,37℃、5﹪CO2培养箱内培养。10 h后,吸除上清,并用RPMI1640基培洗涤细胞3次,最后应用上述加入细胞因子、抗生素和含有 2﹪AP的RPMI1640完全培养基(或AIM-V)1 ml,37℃、5﹪CO2培养箱内培养。体外培养的第3、5天半量换液。
2.重组腺病毒载体感染DC:为研究重组腺病毒载体能否感染DC并介导外源抗原在DC中的表达,选取健康志愿者2例,分离PBMC诱导培养DC。选用携带HBV核心抗原的腺病毒载体CHB3以不同的滴度感染第6天DC,感染剂量分别为5 MOI、10 MOI、20 MOI、40 MOI。 感染24 h后,收集感染细胞裂解后取上清进行免疫分析仪检测(图1)。其中阳性对照组为20 μg/ml HBcAg 蛋白,阴性对照组为 Ad-GFP 40 MOI感染组。
为研究HFP3对重组腺病毒感染DC细胞效率的影响,选用携带绿色荧光蛋白(green fluorescent protein,GFP)的腺病毒载体Ad-GFP以不同的滴度感染DC,感染剂量分别为2.5 MOI、5 MOI、10 MOI、20 MOI,分为 2 组,一组不加HFP3;另一组加入HFP3 50 μmol/L。感染24 h后,用荧光显微镜观察GFP蛋白的表达,并用流式细胞仪分析GFP阳性细胞比例(图2)。
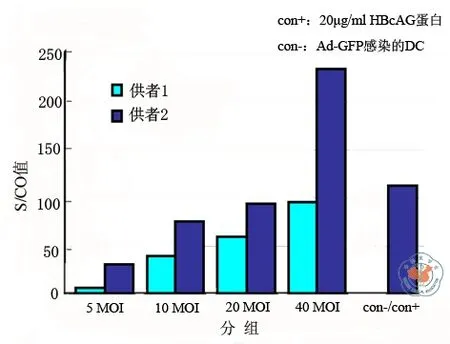
图1 选用携带HBV核心抗原的腺病毒载体 CHB3 以不同的滴度感染第6天DC,感染剂量分别为 5 MOI、10 MOI、20 MOI、40 MOI。感染24 h后,收集感染细胞裂解上清进行免疫分析仪检测。其中阳性对照组为20μg/ml HBcAg蛋白,阴性对照组为 Ad-GFP 40 MOI感染组。结果显示在空载病毒 Ad-GFP 感染的 DC 中未检测到HBcAg 蛋白的表达,但在 CHB3 感染的 DC 中检测到 HBcAg 的高效表达,其表达水平随感染剂量的增加而提高

图2 选用携带 GFP 的腺病毒载体 Ad-GFP以不同的滴度感染 DC,感染剂量分别为2.5 MOI、5 MOI、10 MOI、20 MOI,分为 2 组,一组不加 HFP3;另一组加入 HFP3 50 μmol/L。图a为感染 24 h后,用荧光显微镜观察 GFP 蛋白的表达(×100),图b为用流式细胞仪分析GFP 阳性细胞比例。结果显示加入 HFP3感染组,感染效率约提高 3~ 10 倍。
3.目的基因的表达检测:(1)荧光显微镜下观察Ad-GFP表达,Ad-GFP感染DC24 h后,倒置荧光显微镜(Nikon,ELIPSE Ti)拍照记录。(2)Elisa法检查培养上清中的乙肝核心抗原,CHB3腺病毒感染 DC 24 h后,收获 DC,用 PBS洗 3次,冻融法裂解细胞,离心取上清,用雅培免疫分析仪检测细胞裂解上清中核心抗原含量。(3)ICS法检测DC内乙肝核心抗原,CHB3腺病毒感染DC 24 h后,收获DC,用PBS洗2次,用流式胞内间接染色法染色,一抗为鼠抗人HBcAg单抗,二抗为羊抗鼠IgG-FITC。
4.DC表面标志检测:为了研究腺病毒载体感染对DC分化发育的影响,选取健康志愿者6例,分离PBMC诱导培养DC。用CHB3病毒感染iDC,培养 24 h 后收集细胞,取 1 × 106个细胞置于流式检测管中,1 ml PBS离心洗涤细胞2次,加入流式单克隆抗体CD83-PE、CD86-FITC和CD80-PEcy5(或 CCR7-PE、CD14-APC、HLADR-FITC)各10μl,并设同型对照,4℃避光孵育30 min;1 ml的 PBS 溶液离心洗涤 2 次,加入 2﹪多聚甲醛 100 μl重悬细胞并固定 20 min,流式细胞仪分析 CD14、CD80、CD83、CD86、CCR7和HLA-DR的表达(图3)。

图3 CHB3病毒载体CHB3感染DC流式检测结果
5.五聚体检测:(1)选取2例HLA-A2阳性、HBV表面抗体和核心抗体阳性的健康志愿者,用优化方案培养DC进行CHB3负载,感染的DC用Cocktail促成熟。(2)淋巴细胞用培养液以 2 × 106个 /ml 的浓度重悬。220 ×g离心8 min,收集正常培养的DC和感染后的DC,用培养液将其以 2 × 105DC/ml 的浓度重悬。将DC 1 ml/ 孔(2 × 105个 / 孔)加入 12 孔板中,再加入 1 ml/ 孔的淋巴细胞(2 × 106个 / 孔),即 DC和淋巴细胞的比例为1:10。将共培养的细胞放入CO2培养箱中,按要求的时间收集细胞进行五聚体检测。(3)收细胞,每管(1~ 2 )× 106个细胞,每份样品共 2 管。用 PBS 2 ml洗涤 (600 ×g离心5 min)1次,在倒掉废液前检查是否有细胞沉淀块。收集洗涤的细胞至新的离心管中,分别加10 μl Pentamer或于1管中混合,在22℃避光孵育 10 min;用 PBS 2 ml 洗涤 1 次细胞,600 × g,离心 5 min,弃上清;2 管均加入 3~5 μl CD8-APC,4℃避光孵育 20 min;再用 PBS 2 ml 洗涤1次,弃上清;重悬于200μl 2﹪多聚甲醛,流式细胞仪检测。CD8-APC单染管为对应的同型对照。流式检测时收集细胞数为 (1~ 2)×105个,用美国BD公司的Cell Quest软件进行分析。HBV特异性 CTL 细胞的阳性率 (﹪) = penta+CD8+/ CD8+× 100﹪。
三、统计学分析方法
应用统计软件SPSS17.0进行统计分析,采用不同时间iDC的分子表达差异,以P< 0.05为差异有统计学意义。
结 果
一、细胞形态图
DC 体外培养 5~ 7 d 时,流式细胞仪检测发现细胞明显增大(图4),未成熟DC为半贴壁状态,细胞圆而透亮,表面有细小轴突,大部分为单个,少数聚集成簇。加入抗原刺激4 h后,细胞伸长贴壁,胞质向外延伸,聚集形成集落。不同培养基培养的DC形态不同。
二、重组腺病毒载体感染DC
在空载病毒Ad-GFP感染的DC中未检测到HBcAg蛋白的表达,但在CHB3感染的DC中检测到HBcAg的高效表达,其表达水平甚至比阳性对照组更高,并在一定范围内与病毒滴度呈正比。
三、HFP3对重组腺病毒感染DC效率的影响
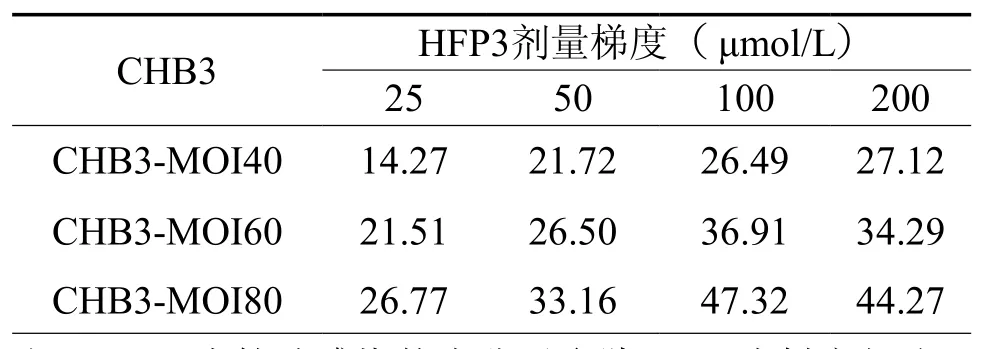
表1 不同HFP3剂量梯度对重组腺病毒感染DC效率的影响(﹪)
加入HFP3辅助腺病毒感染DC,感染效率约提高3~ 10倍。为研究病毒剂量和HFP3的最佳用量,以不同 CHB3 梯度(40 MOI、60 MOI、80 MOI)及不同 HFP3 梯度(25 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L)组合分别感染 DC,感染24 h后,收集DC,用流式胞内间接染色法检测DC胞内HBcAg蛋白的表达(表1)。经双变量F检验分析,感染效率与CHB3-MOI差异有统计学意义(P= 0.0002),感染效率与 HFP3 浓度差异有统计学意义(P= 0.0004)。结果表明,感染效率在一定范围内与病毒滴度MOI和HFP3用量呈正比。综合最佳DC培养方案和最佳HFP3浓度,检测腺病毒CHB3对DC的感染效率和感染后DC活细胞比例均可达80﹪以上(图5)。
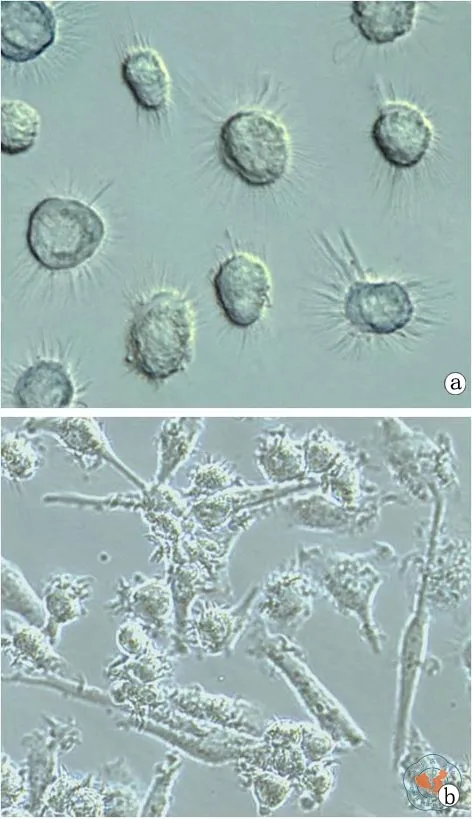
图4 光学显微镜下观察抗原刺激前后DC细胞形态
四、腺病毒负载DC表面标志检测
CD14各组均为阴性显示各组DC均已从单核成功分化。腺病毒载体CHB3感染能活化iDC,使得iDC的CD80、CD86和CCR7分子的表达上调但差异无统计学意义 (P=0.209、0.430、0.054),CD83和HLA-DR的表达不受腺病毒载体影响。为了进一步阐述感染DC的功能状态,研究了这些细胞对Cocktail刺激的应答情况[6]。iDC感染后加Cocktail 促成熟24 h后进行检测,结果发现,Cocktail刺激能诱导感染DC的成熟,具体表现为CD80、CD83、CD86和CCR7分子的显著上调,结果有统计学意义 (P=0.0019、0.017、0.021、0.0016)。

图5 不同CHB3梯度下对DC的感染效率与活细胞比例
五、腺病毒CHB3载体负载的DC诱导HBcAg特异性CTL
以自体非贴壁PBMC细胞为对照,这类志愿者的PBMC内有HBcAg特异性CTL的本底水平分别为0.25﹪和0.19﹪,经过CHB3负载的DC体外刺激仅1周后,HBcAg特异性CTL的水平显著上调 7~ 8 倍,分别为 1.98﹪ 和 1.37﹪( 图6)。
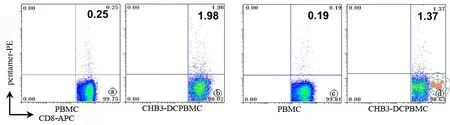
图6 病毒CHB3负载DC诱导HBcAg特异性CTL流式细胞图
讨 论
我国是HBV感染的高发地区,目前HBsAg携带率达7.18﹪,超过1.1亿人,需要进行抗病毒治疗的慢性乙型肝炎(chronic hepatitis B, CHB)患者约为2000万,其中25﹪~ 40﹪可发展为肝硬化和肝癌,每年约70万人死于乙肝相关并发症,包括肝硬化、肝癌,HBV感染严重威胁着人民的生命健康。目前尚无根治HBV感染的药物,现有的治疗药物存在复发率高,耐药或有效率较低的局限性。因此,临床上迫切需要探索新的治疗方法,以解决目前抗病毒治疗过程中存在的问题。
尽管CHB的发病机制目前尚不完全清楚,但现有的证据表明:影响HBV的致病并不完全依赖于病毒本身[7],宿主对HBV的免疫反应可能在致病因素中起到了重要的作用[8]。急性HBV感染者,机体针对HBV会产生强烈的多特异性免疫反应,而慢性HBV感染者则出现弱的免疫反应[9]。Chisari等[10]通过HBV转基因鼠模型研究发现:HBV抗原诱导的细胞免疫应答对于清除细胞内的HBV发挥重要的作用,作为“双刃剑”,它也参与了HBV感染引起肝细胞炎症损伤的过程。在清除HBV的过程中,包括溶胞机制及非溶胞机制,而且非溶胞机制中IFN-γ,TNF等细胞因子起到主要作用,可以缩短乙肝病毒共价闭合环状DNA的半衰期,从而达到抑制HBV DNA复制的目的。而慢性乙肝患者体内CTL功能减弱是导致乙肝慢性化的关键性因素,CTL的功能恢复是免疫治疗CHB的重要目标。因此,除了应用抗病毒治疗外,增加针对HBV的自身免疫细胞数量,进行免疫重建是一条治疗CHB的新思路。
本研究以DC作为切入点,探索了用携带有HBcAg基因的重组腺病毒在体外感染DC,将HBcAg基因带入DC内表达,使内源性HBcAg经DC加工递呈,从而诱导HBV特异性CTL反应的可行性。
DC作为已分化的、有丝分裂后期的免疫细胞,难以转染外源基因,常规方法往往转染效率低下。腺病毒载体能够转染这类非分裂细胞,但需要很高的病毒剂量,转染达到100 MOI~ 1000 MOI以上。Naoki等[11]的研究结果显示腺病毒的离心感染法能在一定程度上提高DC的感染效率,但研究表明,较高的腺病毒感染剂量或长时间离心操作都会严重影响DC活性(结果未显示)。为了探索一种优化的腺病毒载体感染DC的方法,既能用较低的病毒剂量获得较高的感染效率,又不影响DC活性,引入了一种新的HFP3短肽辅助感染,结果表明HFP3能显著提高腺病毒载体负载DC的效率3~ 10倍,感染效率在一定范围内与HFP3用量呈正比。采用优化的HFP3感染方案,腺病毒CHB3对DC的感染效率可达到80﹪~ 90﹪以上;腺病毒载体CHB3的感染能活化未成熟DC,使得未成熟DC的CD80、CD86和CCR7分子的表达上调。
重组腺病毒负载的DC与PBMC共孵育后,应用五聚体检测发现:这2例志愿者均可以诱导出针对HBcAg18–27肽特异性的CTL,与PBMC相比明显升高。重组腺病毒的DC体外诱导T细胞生成针对HBcAg肽特异性的CTL,这是非常重要的。对于CHB患者,若应用DC疫苗直接注射方法可能会诱导体内PBMC生成针对HBV的CTL,或者采用体外进行免疫功能重建并回输给患者,可能会起到清除HBV的目的。目前仅得到的是初步结果,今后的工作还应扩大样本量,并体外检测HBV感染自然史的不同阶段,DC疫苗是否也会诱导出针对HBV的特异性CTL。
DC疫苗是目前最具开发潜力的疫苗之一,国外已有200多项DC疫苗临床研究方案在进行中。在2011年荷兰召开的国际细胞治疗年会(ISCT年会)上,DC被广泛认为是一种安全而有效的细胞免疫治疗方法。本研究系统地比较了腺病毒载体CHB3的抗原负载对DC表型功能的影响以及感染DC体外激活抗原特异性CTL的能力。这些结果更好地刻画了腺病毒载体介导的DC抗原负载条件,为DC细胞的临床应用提供了理论基础。
1 Kawakami Y, Fujita T, Kudo C, et al. Dendritic cell based personalized immunotherapy based on cancer antigen research[J]. Front Biosci, 2008, 13: 1952-1958.
2 Xu H, Cao X. Dendritic cell vaccines in cancer immunotherapy: from biology to translational medicine[J]. Front Med, 2011, 5(4):323-332.
3 Rodrigue-Gervais IG, Rigsby H, Jouan L, et al. Dendritic cell inhibition is connected to exhaustion of CD8+T cell polyfunctionality during chronic hepatitis C virus infection[J]. J Immunol, 2010, 184(6):3134-3144.
4 Arima S, Akbar SM, Michitaka K, et al. Impaired function of antigen-presenting dendritic cells in patients with chronic hepatitis B:localization of HBV DNA and HBV RNA in blood DC by in situ hybridization[J]. Int J Mol Med, 2003, 11(2): 169-174.
5 Van der Molen RG, Sprengers D, Binda RS, et al. Functional impairment of myeloid and plasmacytoid dendritic cells of patients with chronic hepatitis B[J]. Hepatology, 2004, 40(3):738-746.
6 Helmut J, Ulrich K, Gabriele M, et al. Pro-inflammatory cytokines and prostaglandins induce maturation of potent immunostimulatory dendritic cells under fetal calf serumfree conditions[J]. Eur. J. Immunol, 1997, 27: 3135-3142.
7 Fattovich G. Natural history and prognosis of hepatitis B[J]. Semin Liver Dis, 2003, 23(1): 47-58.
8 Stanislas P, Bertrand N , Françoise D, et al. Efficacy and limitations of a specific immunotherapy in chronic hepatitis B[J]. J Hepatol, 2001, 34(6): 917-921.
9 Chang JJ, Lewin SR. Immunopathogenesis of hepatitis B virus infection[J]. Immunol Cell Biol, 2007,85(1):16-23.
10 Guidotti LG, Chisari FV. Noncytolytic control of viral infections by the innate and adaptive immune response[J]. Annu Rev Immunol, 2001, 19: 65-91.
11 Naoki N, Yasuhiko N, Tsutomu S, et al. Novel centrifugal method for simple and highly efficient adenovirusmediated green fluorescence protein gene transduction into human monocyte-derived dendritic cells[J]. Journal of ImmunologicalMethods, 2001, 253:1
