前列腺癌细胞系中干祖细胞的分选和鉴定
2012-10-30马志方许召良岳亮郝振文王东文
马志方 许召良 岳亮 郝振文 王东文
越来越多的证据表明肿瘤干细胞客观存在,并在肿瘤的发生发展过程中起重要作用[1-4],这部分细胞只占全部肿瘤细胞很小的比例,但与肿瘤的复发和转移密切相关,研究发现许多肿瘤对化疗药物耐受和放疗不敏感都与肿瘤干细胞有关。随着对肿瘤干细胞进一步的认识及肿瘤发病机制的研究,人们发现肿瘤干细胞与干细胞存在许多相似之处,这些细胞具有自我更新和分化的潜能,并且有较强的转移和侵袭能力[5]。本研究探讨采用荧光激活流式细胞分选前列腺癌细胞系,得到前列腺癌干祖(stem/progenitor, S/P)细胞,并进一步鉴定其表面标志物的表达,以及细胞的生长和侵袭特性。
材料和方法
一、主要材料
RPMI1640培养基(美 国 Invitrogen公司);10﹪胎牛血清(美国Gibco公司);荧光定量聚合酶链反应(PCR)试剂盒、反转录反应和SYBR等定量PCR所需要试剂(美国BIO-RAD公司);CD133、α2β1整合素、CK8、CD44、PSA、AR 和β-actin等定量RT-PCR引物(上海生工生物工程公司);流式细胞分选仪(美国BD公司);荧光显微镜及数字图像摄影系统(日本Olympus公司);LNCaP细胞株(中国典型培养物保藏中心);CD133/2 (293C3)-PE 鼠抗人单克隆抗体(美国Miltenyi公司),CD44-FITC鼠抗人单克隆抗体(美国BD公司);CD133兔抗人一抗、CK8鸡抗人多克隆一抗(美国Abcam公司);CD44鼠抗人多克隆一抗(美国eBioscience公司);AR(C-19)兔抗人多克隆一抗、Integrin β1 (N-20)、GADPH (6c5)鼠抗人单克隆抗体和PSA (A67B/E3)鼠抗人单克隆抗体(美国 Santa Cruz公司)。
二、方法
1.细胞培养和荧光激活细胞分选(florescence-activated cell sorting, FACS):将 细胞培养于含10﹪胎牛血清的RPMI1640培养基中,置于37℃、含5﹪ CO2的恒温培养箱内培养,每天更换1次培养液;待细胞培养至85﹪融合时,更换培养液,继续在相同条件下培养24 h;选择状态良好、95﹪融合且位于指数生长期的细胞备用。0.5﹪Trypsin-EDTA消化,磷酸盐缓冲 液 (phosphate buffer saline, PBS) 漂 洗并 离心后重悬于 PBS 中,细胞计数约 1×106个 /ml,用CD133-PE和CD44-FITC鼠抗人单克隆抗体标记,置于4℃孵育20 min;PBS洗2次后以流式细胞仪检测和分选,流式检测均重复3次。分选后的S/P细胞培养于无血清,加有数种生长因子的RPMI1640条件培养液。
2.定量RT-PCR检测S/P细胞相关标志物的表达:PCR引物设计如下:α2β1整合素上游5'-GTCGGGGGCTTCAACTTAGAC-3';下游 5'-CCTGGCTGGCTGGTATTAGC-3';CD133上游5'-AGCCTTCATCCACAGATGCT-3';下游 5'-GTG CATTTCTCCACATTT-3';CK8 上游5'-TGGAGTCTCGCCTGGAAG-3';下游5'-CCTCGTACTGTGCCTTGAC-3';CD44 上游5'-TTTGCATTGCAGTCAACAGTC-3';下游5'-GTTACACCCCAATCTTCATGTCCAC-3';PSA 上游 5'-GGTGACCAAGTTCATGCTGTG-3';下游 5'-GTGTCCTTGATCCACTTCCG-3';AR上游5'-TAGCCCCCTACGGCTACA-3';下游5'-TTCCGAAGACGACAAGATGGAC-3';β-actin上游 5'-CATGTACGTTGCTATCCAGGC-3';下游 5'-CTCCTTAATGTCACGCAGAT-3';每个样品加样重复3孔。实验分3组,分别为传代培养组、非S/P组和S/P组。Trizol提取培养细胞的总 RNA,定量后取 2 μg(10 μl),加 Oligo dT 1 μl,DNTP(10 mmol/L) 1 μl,DDW(DEPC) 2 μl,总 反应体系14 μl,在PCR仪上行反转录反应。条件为先 65℃ 5 min,然后加 superscript Ⅲ酶 1 μl,缓冲液 4 μl,DTT (0.1 mol/L) 1 μl,反应体系 20 μl,42℃ 50 min,70℃ 15 min。反应结束后加 180 μl双蒸水稀释,-20℃保存,使用时再稀释10倍。定量PCR反应体系10μl,包 括 cDNA 4 μl,5 MM primer mixture 1 μl,SYBR-490 5μl,采用2步法,反应条件为第一步95℃ 2 min,一个循环;第二步 95℃ 10 s, 55℃ 30 s,40 个循环。
3.Western blot检测S/P细胞相关标志物的表达:分为传代培养组、非S/P组和S/P组。培养的细胞用适量PBS洗1次,吸净,加适量RIPA裂解液,含蛋白酶抑制剂,冰上放置30 min,将裂解液转移至 EP 管,4℃ 14000 ×g离心 10 min,将上清液转至新的EP管(蛋白液),测定浓度。配制SDS/PAGE凝胶,取30 μg蛋白加适量缓冲液上样,电泳 50 V 30 min,接着 100 V 1.5~ 2.0 h。根据胶的大小剪出一片PVDF膜,膜的大小应略微小于胶的大小。将膜置于甲醇中浸泡1 min,再移至转移缓冲溶液中待用。在一浅盘中打开转移盒,将一个预先用转移缓冲溶液浸泡过的海绵垫放在转移盒的黑色筛孔板上,在海绵垫的上方放置经转移缓冲溶液浸湿的滤纸,小心地将胶板放在滤纸上,并注意排除气泡。将PVDF膜放在胶的上方同时注意排除气泡,再在膜的上方放上一张同样用转移缓冲溶液浸湿过的3 mm滤纸并赶出气泡,放置另一张浸泡过的海绵垫,关闭转移盒。将转移盒按照正确的方向放入转移槽中,转移盒的黑色筛孔板贴近转移槽的黑色端,转移盒的白色筛孔板贴近转移槽的白色端,填满转移缓冲溶液同时防止出现气泡。连接电源,在4℃条件下维持恒压100 V,1h。将膜移出至封闭液(5﹪牛奶PBST)封闭至少1 h。加入适量封闭缓冲溶液稀释的一抗(1:500~ 1:1000),室温轻轻摇动 2 h 以上。从容器中倒出一抗封闭缓冲溶液,用PBET缓冲溶液清洗3次,每次10 min。接着加入适量封闭缓冲溶液及稀释的二抗(1:5000),室温轻轻摇动60 min,倒出二抗及封闭缓冲溶液,用PBST缓冲溶液清洗3次,每次10 min。倒掉PBST缓冲溶液,并加入显影剂,在图像分析仪下采集图像并分析。
4.免疫荧光法检测S/P细胞相关标志物的表达:将培养的细胞克隆用冰甲醇置于冰上固定15 min,PBS 轻柔冲洗 3 次,每次 10 min,室温下5﹪牛血清白蛋白PBS封闭液封闭非特异结合位点30 min,吸掉封闭液,滴加封闭液稀释的一抗(稀释比 1:500~ 1:100)室温下孵育 2 h,PBS 漂洗3次,每次10 min,滴加适量封闭液稀释的二抗室温下避光孵育60 min。吸掉液体,适当干燥,用含有 DAPI的封片液封片,在 Olympus IX70 荧光显微镜下观察拍照。
5.球体形成实验检测S/P细胞自我更新能力:分为传代培养组、非S/P组和S/P组。单个细胞悬液 (1×103, 悬于 50 μl培养液 ) 与 Matrigel 50 μl混匀(用前置于冰上),100 µl混合液沿着 24孔低黏附培养板(美国BD公司)边沿缓缓加入。每种细胞重复3孔。培养板置于37 ℃培养箱中10 min,然后加入 500 µl特殊培养液。特殊培养液为无血清的上皮基础培养液,另加有ProstaLife LifeFactors(德国 Lifeline cell technology)。每 3天换液1次,细胞培养14 d后在Olympus光学显微镜下计数。
6.软琼脂糖凝胶肿瘤克隆形成实验检测S/P细胞成瘤性:配制0.8﹪的琼脂糖凝胶(熔于RPMI-1640培养液),微波炉加热至充分溶解,将凝胶铺于6孔板,每孔2 ml。将非S/P组和S/P组消化,重悬。适当温度(37℃)的0.8﹪的琼脂糖凝胶与预置的细胞悬液(3000个/3 ml)1:1体积混合成0.4﹪含细胞的琼脂糖凝胶(6 ml,每种细胞每孔加2 ml,重复3孔),待下层凝胶冷却凝固后,铺于6孔板上层。待上层胶凝固后每孔再加入2 ml的含血清的RPMI-1640培养液提供营养支持。每3 d换培养液。2周后用1 mg/ml碘硝基四唑紫(INT)对细胞克隆进行染色,37 ℃培养过夜,计数 > 2 mm 的克隆。
三、统计学分析方法
采用SPSS 16.0 统计软件进行统计分析,各标志物定量PCR结果、球体形成实验结果和肿瘤克隆形成实验结果,CD133、CD44、AR、CK8、PSA等指标用x± s表示,组间比较采用独立t检验。以P<0.05为差异有统计学意义。
结 果
一、细胞培养和FACS
CD133和CD44双阳性的细胞数量为(1.1±0.3)﹪。用离心管收集分选的S/P细胞和非S/P细胞备用。流式分选的结果见图1。的表达

图1 人前列腺癌细胞荧光激活流式分选结果
二、定量RT-PCR检测S/P细胞相关标志物
在原代细胞、非S/P细胞和S/P细胞中,用本方法检测S/P细胞的主要标志物CD133、CD44和α2β1整合素的mRNA表达,同时检测分化成熟的腺上皮细胞标志物AR、CK8和PSA的mRNA表达,结果如图2所示,与非S/P细胞比较,S/P细胞中干祖细胞主要标志物CD133、CD44和α2β1整合素的mRNA表达较非S/P细胞明显增 高(t=17.376,3.859,8.611;P=0.000,0.021,0.001);相反,S/P细胞中分化成熟的腺上皮细胞标志物AR、CK8和PSA的mRNA表达非常低 (t=3.518,11.372,3.845;P=0.029,0.000,0.018)。
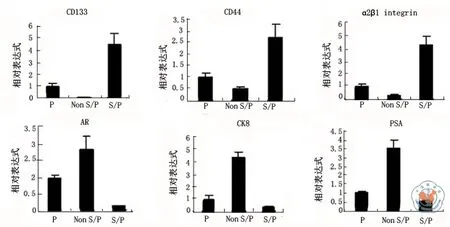
图2 定量RT-PCR检测分选出的人前列腺癌S/P细胞中干祖细胞标志物mRNA的表达
三、Western blot检测S/P细胞相关标志物的表达
在原代细胞、非S/P细胞和S/P细胞中,用本方法检测S/P细胞的主要标志物CD133、CD44和α2β1整合素的蛋白表达,同时检测分化成熟的腺上皮细胞标志物AR、CK8和PSA的蛋白表达,结果如图3所示,与非S/P细胞比较,S/P细胞中干祖细胞主要标志物CD133、CD44和α2β1整合素的蛋白表达明显增高;相反,S/P细胞中分化成熟的腺上皮细胞标志物AR、CK8和PSA的蛋白表达明显降低。
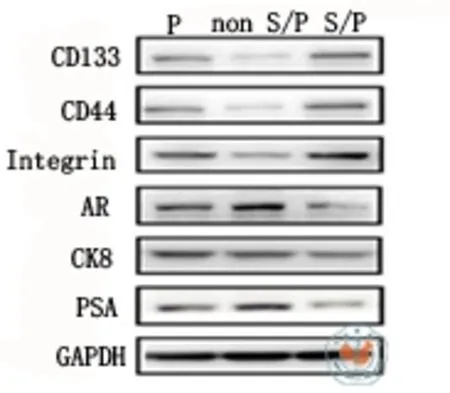
图3 Western blot检测分选出的人前列腺癌S/P细胞中干祖细胞标志物蛋白的表达
四、免疫荧光法检测S/P细胞相关标志物的表达
在非S/P细胞和S/P细胞中,用本方法检测S/P细胞的主要标志物CD133和α2β1整合素的蛋白表达,同时检测分化成熟的腺上皮细胞标志物CK8和AR的蛋白表达,结果如图4所示,与非S/P细胞比较,S/P细胞中干祖细胞主要标志物CD133和α2β1整合素的蛋白表达明显增高;相反,S/P细胞中分化成熟的腺上皮细胞标志物CK8和AR的蛋白表达明显降低。

图4 荧光显微镜下观察细胞荧光染色情况(×400)
五、球体形成实验检测S/P细胞自我更新能力
细胞培养14d后非S/P细胞和S/P细胞形成前列腺球的数量分别为(4.35±0.87)个和(35.12±4.56)个 ,差异具有统计学意义(t =13.013,P =0.000),说明分选出的 S/P 细胞具有较强的自我更新能力。并且在显微镜下观察(×100),S/P细胞形成的前列腺球体积较大,细胞数多(图5)。
六、软琼脂糖凝胶肿瘤克隆形成实验检测

图5 光学显微镜下观察人前列腺球体(×100)S/P细胞成瘤性
细胞培养2周后非S/P细胞和S/P细胞可以在软琼脂凝胶中克隆性生长,阳性克隆数分别为(18.34±1.21) 个克隆和 (82.27±7.54) 个克隆;S/P细胞与非S/P细胞比较差异有统计学意义(t =8.617,P =0.001,图6)。肿瘤细胞体外克隆形成能力是反映肿瘤细胞恶性程度及其转移潜能的重要指标。软琼脂糖凝胶实验表明,S/P细胞克隆性生长和转移潜能较非S/P细胞明显增强。
讨 论

图6 软琼脂糖凝胶肿瘤克隆形成实验,观察人前列腺细胞肿瘤克隆形成情况
细胞表面黏附分子CD133,是具有独特的5个跨膜结构域和2个大的N-糖基化细胞外环的跨膜糖蛋白,其表达的一个显著特点就是随着细胞的分化迅速下调,这使得它成为一个分离和鉴定干细胞和祖细胞的独特分子标志物。CD44也是一种细胞表面跨膜糖蛋白,属于黏附分子类,其分布十分广泛,主要参与细胞间及细胞与基质间的特异性粘连过程,且在恶性肿瘤的发生、发展中起着十分重要的作用。目前CD44作为多种已知肿瘤干细胞的标记物,也逐渐受到人们的进一步关注。在前列腺癌组织中已经证实可以分选出干细胞样的肿瘤细胞。Collins等[6]较早报道在不同分级分期的前列腺癌患者肿瘤组织中均分选出表型为 CD44+/α2β1integrinhi/CD133+的干细胞样细胞,发现这些细胞占细胞总数的0.1﹪,具有自我更新、增殖和分化的潜能,并且成瘤性和侵袭能力较强,这些细胞与真正的干细胞还有差异,一般称之为S/P细胞。Guzmán-Ramírez等[7]从前列腺癌患者肿瘤中取出的上皮部分进行三维培养,发现有前列腺球体形成,并且可以传代,说明部分细胞具有自我更新的能力;检测细胞分子标志物,形成球体的细胞具有上皮基层细胞的特点 CK5+/CK14+/CK19high/CK18- /low/ c-met+/AR-/low/PSA-/low,同时具有正常干细胞的标志CD49b+/CD49f+/CD44+/ΔNp63+/Nestin+/CD133+,进一步明确了前列腺癌肿瘤组织含有少量干细胞特点的细胞。另外研究发现前列腺癌细胞中CD44+CD24-的亚群具有干细胞的部分特性,侵袭性和成瘤性明显增强[8]。但是这些细胞在前列腺癌发生发展过程中具体发挥怎样的作用,其机制如何还有待深入研究。
原代细胞的培养和传代较为困难,为了进一步研究前列腺癌S/P细胞的作用和相关调控机制,不少学者尝试在前列腺癌细胞系中分选S/P细胞。常用的分选方法有免疫磁珠法和荧光激活流式细胞分选[9-10],课题组采用2种方法都可以成功地分选出S/P细胞,相对于前者,后者可以同时多抗体标记肿瘤细胞。课题组发现,相比采用CD133、CD44和α2β1整合素3种抗体标记或者采用其中单一抗体标记肿瘤细胞,采用CD133和CD44双抗体标记肿瘤细胞可以得到合适的一定数量S/P细胞,有利于进一步的功能和机制研究。同时,课题组不仅在LNCaP细胞,而且在PC3、C4-2等细胞系中采用同样的方法都可以分选出S/P细胞,具有S/P细胞的分子标志物,与非S/P细胞比较,S/P细胞具有较强的自我更新能力和成瘤性。
S/P细胞的特点是具有特殊的分子标志物,有分化潜能,并有较强的自我更新能力和成瘤性,一般认为细胞球体形成实验和琼脂糖凝胶细胞克隆实验可以反映上述能力。课题组采用不同的方法,在RNA和蛋白等不同水平检测了分选出S/P细胞的标志物,结果证实这部分细胞确实为S/P细胞;并且同时检测了分化成熟的腺上皮细胞标志物,在S/P细胞中,这些细胞标志物表达明显较低,表明分选出的细胞还没有分化成熟,可能有分化潜能。课题组研究结果进一步发现,在不同细胞系中S/P细胞的比例不同,PC3细胞中的S/P细胞远多于LNCaP细胞,这与PC3细胞的来源和生物学特性相一致,即PC3具有更强的生长和侵袭能力。
本研究成功地从多种人前列腺癌细胞系中分选出S/P细胞并鉴定,为进一步研究S/P细胞在前列腺癌的发生发展过程中的具体作用和机制提供了实验模型。
1 Germann M, Wetterwald A, Guzmán-Ramirez N, et al. Stem-like cells with luminal progenitor phenotype survive castration in human prostate cancer[J]. Stem Cells, 2012, 30(6):1076-1086.
2 Lawson DA, Zong Y, Memarzadeh S, et al. Basal epithelial stem cells are efficient targets for PCa initiation[J]. PNAS, 2010, 107(6): 2610-2615.
3 Mulholland DJ, Xin L, Morim A, et al. Lin-Sca-1+CD49fhigh stem/ progenitors are tumor-initiating cells in the Pten-null prostate cancer model[J]. Cancer Res, 2009, 69(22):8555-8562.
4 Taylor RA, Toivanen R, Risbridger GP. Stem cells in prostate cancer: treating the root of the problem[J]. Endocr Relat Cancer, 2010, 17(4):273-285.
5 Lang SH, Frame FM, Collins AT. Prostate cancer stem cells[J]. J Pathol, 2009, 217(2): 299-306.
6 Collins AT, Berry PA, Hyde C, et al. Prospective identification of tumorigenic prostate cancer stem cells[J]. Cancer Res, 2005, 65(23):10946-10951.
7 Guzmán-Ramírez N, Völler M, Wetterwald A, et al. In vitro propagation and characterization of neoplastic stem/progenitor-like cells from human prostate cancer tissue[J]. The Prostate, 2009, 69(15):1683-1693.
8 Hurt EM, Kawasaki BT, Klarmann GJ, et al. CD44+CD24-prostate cells are early cancer progenitor/stem cells that provide a model for patients with poor prognosis[J]. British Journal of Cancer, 2008, 98(4):756-765.
9 Chen W, Wang GM. Gene expression profiling of cancer stem cells in the Du145 prostate cancer cell line[J]. Oncol Lett, 2012, 3(4):791-796.
10 Singh S, Chitkara D, Mehrazin R,et al. Chemoresistance in prostate cancer cells is regulated by miRNAs and hedgehog pathway[J]. PLoS One, 2012, 7(6):e40021.
