儿茶素和表儿茶素异构体的高效逆流色谱分离制备
2012-10-27曹学丽
成 超,尹 鹭,曹学丽*,徐 静
(北京工商大学食品学院,食品添加剂与配料北京高校工程研究中心,北京 100048)
儿茶素和表儿茶素异构体的高效逆流色谱分离制备
成 超,尹 鹭,曹学丽*,徐 静
(北京工商大学食品学院,食品添加剂与配料北京高校工程研究中心,北京 100048)
应用高效逆流色谱法(HPCCC)对茶叶中的儿茶素和表儿茶素两种同分异构体的分离制备方法进行研究。结果表明:以正己烷-乙酸乙酯-水(体积比1:20:20)为两相溶剂系统,上相为固定相,下相为流动相,可以实现儿茶素和表儿茶素的完全分离。采用138mL的分离柱、1g儿茶素粗提物,在120min内一次制备即可得到纯度在95%以上的表儿茶素约35mg,纯度在99%以上的儿茶素325mg,纯度90%~99%的儿茶素100mg。
表儿茶素;儿茶素;异构体;高效逆流色谱;分离制备
儿茶素(catechins,C)又称茶单宁、儿茶酚,是茶叶中黄烷醇类物质的总称,是绿茶中最主要的生物活性成分,其含量可占到茶叶干质量的15%~35%[1]。大量研究表明,儿茶素具有有效清除自由基、抗氧化、抗菌消炎、抗病毒、抗癌抗突变、改善心血管疾病症状及调节免疫系统的作用[2-4]。
茶叶中的儿茶素分为表型和非表型两大类,其中以表型的表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)和表儿茶素没食子酸酯(epicatechin gallate,ECG)的含量最为丰富,约占儿茶素总量的70%[5]。近年来的研究表明,茶叶中儿茶素的表型和非表型异构化与其清除自由基活性之间有着密切的关系[6]。因此对茶叶中不同儿茶素类成分的分离制备方法研究及对于其构效关系的深入研究具有重要意义。
已经有众多文献报道[7-11]茶叶中的儿茶素类成分的分离,但大多采用传统的柱色谱方法。高效逆流色谱(high-performance counter-current chromatography,HPCCC)是一种连续高效的快速液-液分配色谱分离技术[12-13]。由于其无需任何固体分离介质,物质之间依据分配系数的不同而实现分离,因此它具有制备量大、分离效率高、回收率高等优势,广泛应用于天然产物中活性物质的分离制备。逆流色谱在儿茶素类物质的分离制备中也有广泛的应用[14-18]。
儿茶素(C)和表儿茶素(epicatechin,EC)(图1)是茶叶中存在含量较低的一对异构化儿茶素,对二者的大量制备分离方法的研究报道较少。本实验对高效逆流色谱法制备分离茶叶提取物中儿茶素和表儿茶素异构体方法及放大分离的可行性进行研究,为儿茶素和表儿茶素单体的大量制备提供参考。
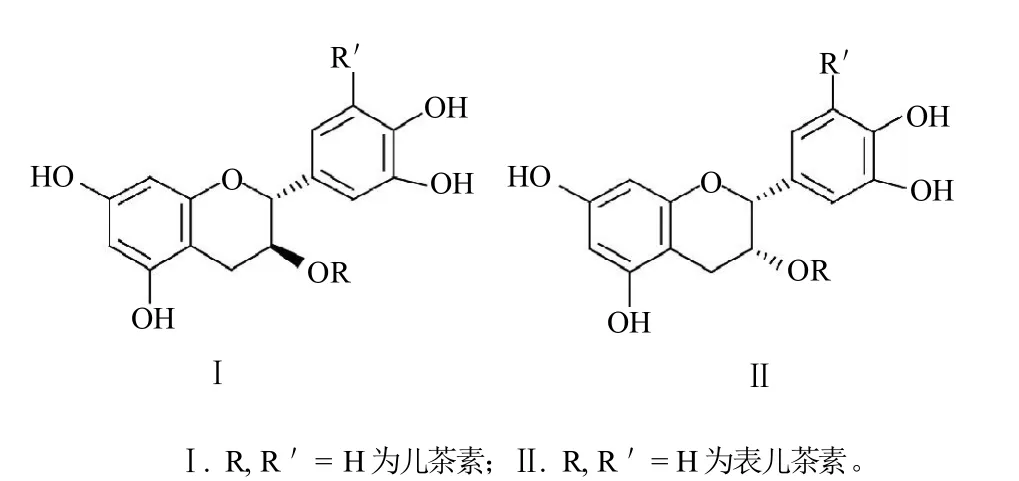
图1 儿茶素(C)和表儿茶素(EC)的化学结构式Fig. 1 Chemical structures of catechin and epicatechin
1 材料与方法
1.1 材料与试剂
儿茶素粗提物(绿茶提取物分离) 北京绿色金可生物技术公司;儿茶素、表儿茶素对照品 中国食品药品检定研究院;正己烷、乙酸乙酯 北京化工厂;N,N-二甲基甲酰胺、冰乙酸(色谱纯) 天津市光复精细化工研究所;甲醇(色谱纯) 美国Fisher Scientific公司;纯水由Millipore-Q纯水机自制。
1.2 仪器与设备
1100高效液相色谱仪(配有四元梯度泵、自动进样器、二极管阵列检测器)、高效逆流色谱仪 (配有22.5mL分析柱和138mL制备柱两种分离柱,聚四氟乙烯管内径0.8mm;同时配低压梯度泵及可变波长检测器) 美国Agilent公司。
1.3 方法
1.3.1 高效逆流色谱分离溶剂体系选择
采用分析型逆流色谱分析柱,以正己烷-乙酸乙酯-水为两相溶剂体系,首先配制两相溶剂不同体积比(1:6:6、1:10:10、1:20:20、0:1:1)的溶剂体系,将其充分混合后,静置分层,上相为固定相,下相为流动相,进行条件优化,选出最佳溶剂体系。操作条件:分离柱体积:22.5mL;转速:1600r/min;检测波长:280nm;流速:1.0mL/min;进样量:20mg;分离温度:30℃。
1.3.2 制备高效逆流色谱分离条件
经过分析柱优化筛选出正己烷-乙酸乙酯-水溶剂体系,将其充分混合后,静置分层,上相为固定相,下相为流动相。分离柱体积:138mL;转速:1600r/min;检测波长:280nm,分别对流速、进样量进行进一步调整,选择最佳制备条件。
1.3.3 HPLC色谱分析条件
色谱柱:Diamonsil C18(200mm×4.6mm,5μm),柱温:30℃;流动相A:二甲基甲酰胺-甲醇-乙酸体积比40:2:1.5,B:纯水;梯度洗脱:0~10min,80%~70% B;10~20min,70%~60% B;20~25min,保持60% B;25~30min,60%~80% B;流速:1.0mL/min;进样量:10μL;检测波长:278nm。
2 结果与分析
2.1 儿茶素粗提物的HPLC分析

图2 儿茶素粗提物的HPLC色谱图Fig. 2 HPLC chromatogram of crude catchine extract
由图2可知,HPLC外标法分析儿茶素粗提物,测得提取物中儿茶素和表儿茶素的含量分别为84.5%和7.55%。
2.2 分析型高效逆流色谱筛选溶剂体系

图3 儿茶素粗提物在不同溶剂体系下的分析型逆流色谱图Fig. 3 Analytical HPCCC chromatograms of crude catchine extract in different solvent systems
[14-17]的分离EGCG和GCG的溶剂体系,结合儿茶素和表儿茶素的极性,选择以正己烷-乙酸乙酯-水为基础的溶剂体系,并利用分析型逆流色谱分离柱,对正已烷、乙酸乙酯、水以1:6:6、1:10:10、1:20:20、0:1:1不同体积配比下的分离效果进行了快速考察,结果如图3所示。通过对每个峰级分的HPLC分析,EC和C的出峰顺序与HPCCC相反。随着体系中正己烷比例的降低,EC和C的分离度依次增大。在采用1:6:6配比的体系时,二者已基本达到基线分离。继续降低直至正己烷比例为0时,二者分离度虽可进一步提高,但分离时间也相应延长。因此,选择正己烷-乙酸乙酯-水体积比1:20:20进行制备分离。
2.3 制备逆流色谱分离条件优化
首先采用选择好的体积比1:20:20正己烷-乙酸乙酯-水溶剂体系,根据制备柱和分析柱的放大倍数(约6倍),以进样量120mg、流速6.0mL/min进行分离,考察EC和C的制备分离效果,如图4所示。在上样量和流速以与柱体积等倍数放大时,可以在不延长分离时间的情况下,获得同样的放大分离效果,这正是高效逆流色谱的优势所在。为了使上样量进一步提高,因而又考察了5.0mL/min和4.0mL/min两个稍低流速下的分离效果,由图4可知,随着流速的降低,EC和C的分离度由0.819增加到0.923。因此选择在4.0mL/min流速条件下,进一步考察上样量对二者分离效果的影响,如图5所示。在同一流速条件下,随着上样量由120、240mg提高到500mg,目标物的出峰时间有所提前,二者的分离度有所降低。
2.4 在优化条件下的制备分离
根据上述的条件优化结果,考察了在2.0mL/min流速下,上样量为500mg时的分离效果,如图6所示。与图5相比,在同样上样量的情况下,EC和C的分离度明显改善。进而考察了在上样量为1g时的分离效果,经过一次分离(约120min),从77min开始,以10mL/管收集流分,共收集9管,依次编号1~9,2号管可得95%纯度以上表儿茶素约35mg;4号和8号管所得90%~99%纯度的儿茶素100mg。5、6、7号管所得99%以上纯度的儿茶素325mg。图7分别给出了EC (95%纯度)和C (99%纯度)的HPLC分析图谱,可知EC和C的分离效果很好。
3 讨 论
本实验采用高效逆流色谱实现了儿茶素和表儿茶素两种同分异构体的完全分离。通过采用选择好的溶剂体系,在柱体积相差约6倍的制备柱和分析柱之间进行放大实验,在上样量和流速与柱体积等倍数放大时,可在不延长分离时间的情况下,获得同样的放大分离效果,这正是高效逆流色谱的优势所在。通过在此基础上,本实验又进行进一步的条件优化和潜力挖潜,在柱体积放大约6倍的情况下,获得了上样量放大50倍的理想制备分离效果。即在柱体积为138mL的制备柱上,对1g儿茶素粗提取进行了分离,在120min内一次制备即可得到纯度在95%以上的表儿茶素和99%以上的儿茶素纯品。若将流速进一步降低,在上样量或产品的纯度上还可以进一步提高,但是分离时间会相应延长。因此,在放大分离时,需要综合考虑分离度、上样量和分离时间之间的关系,以求得分离效率的最大化。
参考文献:
[1] HARBOWY M E, BALENTINE D A. Tea chemistry[J]. Crit Rev Plant Sci, 1997, 16: 415-480.
[2] 杨贤强, 王岳飞, 陈留记, 等. 茶多酚化学[M]. 上海: 上海科学技术出版社, 2003: 109-386.
[3] 廖音娟, 胡长平. 表没食子儿茶素没食子酸酯抗肝癌作用机制研究进展[J]. 中南药学, 2012, 10(2): 132-136.
[4] 梁丽琴, 金刚, 党建章, 等. 儿茶素对脑胶质瘤细胞U251增殖的抑制作用及机制初探[J]. 实用医学杂志, 2011, 27(9): 1526-1528.
[5] 宛晓春. 茶叶生物化学[M]. 3版. 北京: 中国农业出版社, 2003: 9-15.
[6] 徐懿, 屠幼英, 钟小玉. 茶儿茶素异构化研究现状[J]. 中草药, 2008,39(7): 1106-1109.
[7] 王传金, 魏运洋, 朱广军, 等. 聚酰胺色谱法分离制备高纯度表没食子儿茶素没食子酸酯[J]. 应用化学, 2007, 24(4): 443-447.
[8] 戚向阳, 谢笔钧, 胡慰望. 高纯度表没食子儿茶素没食子酸酯(EGCG)的分离与制备[J]. 精细化工, 1994, 11(4): 40-46.
[9] 王霞, 高丽娟, 林炳昌. 表没食子儿茶素没食子酸酯(EGCG)的分离与制备[J]. 食品科学, 2005, 26(9): 242-246.
[10] 钟世安, 周春山, 杨娟玉. 高效液相色谱法分离纯化酯型儿茶素的研究[J]. 化学世界, 2003(5): 237-245.
[11] 刘晓辉, 江和源, 尧渝. 高纯度儿茶素的制备技术[J]. 中国茶叶, 2009(8): 8-11.
[12] ITO Y, CONWAY W D. High speed countercurrent chromatography[M]. New York: John Wiley, 1996.
[13] 曹学丽. 高速逆流色谱分离技术及应用[M]. 北京: 化学工业出版社,2005.
[14] CAO Xueli, TIAN Yu, ZHANG Tianyou, et al. Separation and purification of three individual catechins from tea polyphenol mixture by CCC[J]. Journal of Liquid Chromatography Related Technologies, 2001, 24(11/12): 1723-1732.
[15] CAO Xueli, ITO Y. Preparation and purification of epigallocatechin by high-speed countercurrent chromatograph[J]. Journal of Liquid Chromatography Related Technologies, 2004, 27(1): 145-152.
[16] 陈理, 邓丽洁, 陈平. 高速逆流色谱分离同分异构体[J]. 色谱, 2006(6): 570-573.
[17] YANAGIDA A, SHOJI A, SHIBUSAWA Y, et al. Analytical separation of tea catechins and food-related polyphenols by high-speed countercurrent chromatography[J]. Journal of Chromatography A, 2006, 1112:195-201.
[18] 曹学丽, 王尉, 裴海闰. 逆流色谱技术及其在食品领域的应用进展[J]. 北京工商大学: 自然科学版, 2010, 28(3): 6-11.
Preparative Separation of Catechin and Epi-Catechin by High Performance Counter-Current Chromatography
CHENG Chao,YIN Lu,CAO Xue-li*,XU Jing
(Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, School of Food and Chemical Engineering,Beijing Technology and Business University, Beijing 100048, China)
High performance counter-current chromatography (HPCCC) was used for the separation and preparation of two isomers, catechin and epicatechin from crude extract of green tea. The results indicated that catechin and epicatechin could be separated completely by HPCCC using a two-phase solvent system composed of hexane, ethyl acetate and water (1:20:20,V/V) to form an upper phase as the stationary phase and a lower phase as the mobile phase. By using a 138 mL separation column,approximately 35mg of epicatechin (> 95% purity) and 325mg of (> 99% purity) or 100mg of (90% - 99% purity) cetechin were obtained from 1 g of crude extract through one-step separation in 120 min.
epicatechin;catechin;isomers;high-performance counter-current chromatography (HPCCC) ;separation and purification
TS207.3
A
1002-6630(2012)15-0140-04
2012-04-11
成超(1987—),男,硕士研究生,研究方向为生物分离工程。E-mail:chengchao-56@163.com
*通信作者:曹学丽(1967—),女,教授,博士,研究方向为生物分离技术。E-mail:caoxl@th.btbu.edu.cn
