猪胃黏蛋白偶联磁珠和聚乙二醇富集检测青葱和葡萄中诺如病毒的比较研究
2012-10-27张其刚潘良文TIANPeng
张其刚,潘良文*,李 想,方 筠,TIAN Peng
(1.上海出入境检验检疫局,上海 200135;2.华东理工大学生物工程学院,上海 200237;3. Western Regional Research Center, Agricultural Research Service, United States Department of Agriculture, Albany, CA 94710, USA)
猪胃黏蛋白偶联磁珠和聚乙二醇富集检测青葱和葡萄中诺如病毒的比较研究
张其刚1,2,潘良文1,*,李 想1,方 筠1,TIAN Peng3
(1.上海出入境检验检疫局,上海 200135;2.华东理工大学生物工程学院,上海 200237;3. Western Regional Research Center, Agricultural Research Service, United States Department of Agriculture, Albany, CA 94710, USA)
目的:以青葱与葡萄为材料,建立以猪胃黏蛋白偶联磁珠(PGM-MB)和聚乙二醇8000(PEG8000)富集检测水果、蔬菜中诺如病毒的方法。方法:确定病毒原液中的相对病毒量,梯度稀释病毒原液并进行实时荧光-聚合酶链式反应检测,以每个反应管内的荧光信号达到设定的域值时所经历的循环数值与病毒量(实时荧光-聚合酶链式反应单位数)的常用对数值绘制标准曲线和线性方程;人工接种诺如病毒于青葱与葡萄表面,洗脱后,分别用PEG8000和PGM-MB富集诺如病毒,实时荧光-聚合酶链式反应扩增,用标准曲线对回收的病毒进行相对定量。结果:基质为青葱时,高接种量条件下,两种富集方法的病毒回收效果相当,低接种量下,PGM-MB法的富集回收率高于PEG8000法,且PGM-MB的检测下限更低;基质为葡萄时,PGM-MB法的富集回收率均高于PEG8000法,且检测下限更低。结论:PGM-MB富集效果良好,快速方便,适合应用于水果和蔬菜中的诺如病毒的富集检测。
诺如病毒;猪胃黏蛋白偶联磁珠;聚乙二醇8000;实时荧光-聚合酶链式反应
诺如病毒属于杯状病毒科,是人类非细菌性急性肠胃炎的主要病原体[1]。诺如病毒的基因组为7.5kD左右的单股正链RNA,按照RNA聚合酶区和衣壳蛋白区的核苷酸与氨基酸序列,可分为5个基因组型。其中GI、GII、GIV型可感染人类,GIII、GV型只感染动物,GII型是引起食品感染的主要致病型[2-3]。
以食物和水为载体的“粪-口”途径是诺如病毒传播的主要途径[4],食用受污染的食物和水均会使人患急性肠胃炎。食品中诺如病毒检测的报道多关于贝类,但最近研究表明,水果、蔬菜也是诺如病毒感染的重要载体[5-7]。水果、蔬菜中诺如病毒的富集方法主要有聚乙二醇(polyethylene glycol,PEG)沉淀、超滤浓缩与膜过滤[8],这些方法分别有耗时长、设备要求高、步骤较多等缺点。近几年的文献报道表明,人类组织血型抗原(histo-blood group antigens,HBGA)是诺如病毒入侵人体的受体[9-10]。猪胃黏蛋白(porcine gastric mucin,PGM)含有多种组织血型抗原,猪胃黏蛋白偶联磁珠(porcine gastric mucin-conjugated magnetic beads,PGMMB)可结合不同基因型的诺如病毒株。国外已有利用PGM-MB富集检测水、生菜、草莓中诺如病毒的报道[11-12]。
国内鲜有检测水果、蔬菜中诺如病毒的报道,相关的检测方法也未建立。PEG8000沉淀法在富集食品中诺如病毒的运用最为广泛,潘良文[13]、刘军义[14]等以此建立了检测贝类中诺如病毒的标准。本研究分别用PEG8000和PGM-MB富集方法,对青葱与葡萄基质中诺如病毒的富集检测进行比较研究。
1 材料与方法
1.1 材料与试剂
GII.4诺如病毒 上海国际旅行卫生保健中心;PGMMB 美国农业部西太平洋农业研究中心;青葱、葡萄上海市徐汇区水果菜市场。
1×PBS缓冲液 上海生工生物工程有限公司;甘氨酸缓冲液、CBS缓冲液(0.0745mol/L柠檬酸,0.0255mol/L柠檬酸钠,pH3.6)、PEG8000溶液(16% PEG8000,0.525mol/L NaCl) 上海朗晟生物科技有限公司;TIANamp病毒RNA提取试剂盒(Cat. No. SD101) 北京天根生物科技有限公司;Prime ScriptTM反转录试剂盒(Cat.No. DRR036A)、Premix ExTaqTM实时荧光扩增试剂盒(Cat. No. DRR039S) 大连宝生物工程有限公司。
1.2 仪器与设备
5810R型台式离心机、ThermoStat plus恒温孵育器、Mastercycler Gradient PCR仪 德国Eppendorf公司; Roto-Shake®Genie Rotator/Rock 多功能摇床 美国Scientific Industries公司;ABI Prism®7300型荧光定量PCR仪 美国Applied Biosystems公司。
1.3 方法
1.3.1 病毒原液的制备
用1×PBS缓冲液10倍稀释病毒粪便样品,充分混匀,8000×g离心20min后得到病毒悬浮液,分装为每管20μL,作为病毒原液,-80℃保存备用。
1.3.2 RT-PCR单位的确定和标准曲线绘制
诺如病毒目前还不能进行体外培养,对其难以准确定量。梯度稀释病毒原液,定义用实时荧光-聚合酶链式反应(real-time polymerase chain reaction,RT-PCR)方法能稳定检出的最高稀释倍数10-x(x>0)的病毒悬浮液中所含的病毒量为1个RT-PCR单位(RTU)。
以140μL 104、103、102、10RTU和1RTU的5个浓度梯度的病毒悬浮液,用TIANamp病毒提取试剂盒提取病毒RNA,反转录,实时荧光RT-PCR扩增绘制标准曲线。
1.3.3 病毒的人工接种
称取5g新鲜的葡萄或青葱样品,在样品表面均匀接种14μL诺如病毒悬浮液,于生物安全柜内放置30min至病毒悬浮液完全被样品表面吸附并干燥。另取葡萄或青葱样品,不进行接种处理作为阴性对照。
1.3.4 病毒的富集与RNA提取
PEG8000富集法:将样品放入50mL离心管中,加入35mL甘氨酸缓冲液。多功能摇床室温振荡30min,4℃、3000×g离心3min,转移上清液至一新离心管中。上清液中加入等体积16%的PEG8000溶液,振荡混匀,冰上放置过夜;4℃、12000×g离心30min;弃上清液,用140μL 1×PBS缓冲液重悬浮沉淀;按照TIANamp病毒RNA提取试剂盒说明提取纯化病毒RNA。
PGM-MB富集法:将样品放入50mL离心管中,加入35mL ddH2O。多功能摇床室温振荡30min,4℃、3000×g离心3min,转移上清至一新离心管。上清中加入15mL CBS缓冲液,颠倒混匀后加入100μL PGM-MB;室温、低速振荡30min,磁力分离架上静置30min;转移磁珠至1.5mL离心管,用1mL 1×PBS缓冲液清洗3次后,用140μL 1×PBS缓冲液重悬浮磁珠;95℃ 5min热释放病毒;4℃,磁力分离架上静置5min;转移上清液,按照TIANamp病毒RNA提取试剂盒说明提取纯化病毒RNA。
1.3.5 反转录与实时荧光RT-PCR扩增
反转录体系为10μL,包括2μL 5×RT Master Mix、3μL RNase Free ddH2O、5μL RNA溶液。反应条件为:37℃,15min;85℃,5s。实时荧光RT-PCR反应的引物探针序列分别为:COG2F[15]:5′-CARGARBC NATGTTYAGRTGGATGAG-3′;COG2R:5′-TCGACGCCATCT TCATTCACA-3′;G2P:5′-FAMTGGGAGGGCGATCGCAATCT-BHQ1-3′。实时荧光RTPCR反应体系为20μL,包括1×Premix ExTaq,上下游引物各为0.2μmol/L,探针为0.15μmol/L,1×ROX荧光染料,2μL病毒cDNA溶液。扩增条件为:95℃、30s,95℃、5s,60℃、31s;45个循环。
2 结果与分析
2.1 两种富集方法回收率的比较
2.1.1 RTU的确定和标准曲线绘制
回收率是评定检测方法的一个重要指标,要比较各富集方法的回收率,首先需要确定接种与回收的病毒量。由于诺如病毒还不能在细胞或组织中培养,本研究以RTU表示诺如病毒量,以每个反应管内的荧光信号达到设定的域值时所经历的循环数(Ct)值为纵坐标、lg(RTU)为横坐标建立标准曲线。根据标准曲线的转换可得到EG8000富集方法和PGM-MB富集方法回收的病毒量,进而计算并比较回收率。
梯度稀释病毒原液至稀释倍数10-3、10-4、10-5、4×10-6、2×10-6、10-6,提取病毒RNA,反转录,实时荧光RT-PCR扩增。稀释倍数为2×10-6的病毒悬浮液有扩增,但不能全部检出,且Ct值不稳定;稀释倍数为4×10-6病毒悬浮液经3次重复实验均能稳定检出,认为4×10-6为可稳定检出的最高稀释倍数,因此定义140μL稀释倍数为4×10-6的病毒悬浮液为1RTU,则140μL的病毒原液中含有的病毒量为2.5×105RTU。以140μL病毒稀释倍数为4×10-2、4×10-3、4×10-4、4×10-5、4 × 10-6(分别对应104、103、102、10RTU 和1RTU)的病毒悬浮液绘制的标准曲线(图1)。扩增效率E值为0.864,相关系数R2为0.999。
2.1.2 回收率的比较
2.1.2.1 以青葱为基质时回收率的比较
为比较以青葱为基质时PEG8000与PGM-MB富集的回收率,选择14μL稀释倍数为2.5×10-2、5×10-3、1×10-3(对应的病毒量分别为625、125、25RTU)的诺如病毒悬浮液接种于青葱表面。在这3个接种量条件下,PEG8000与PGM-MB富集均能稳定检出(表1)。
表1 以青葱为基质时PEG8000和PGM-MB方法富集回收率的比较(±s,n=3)Table 1 Recovery rates of viruses from inoculated green onions by PEG8000 and PGM-MB methods (±s,n=3)
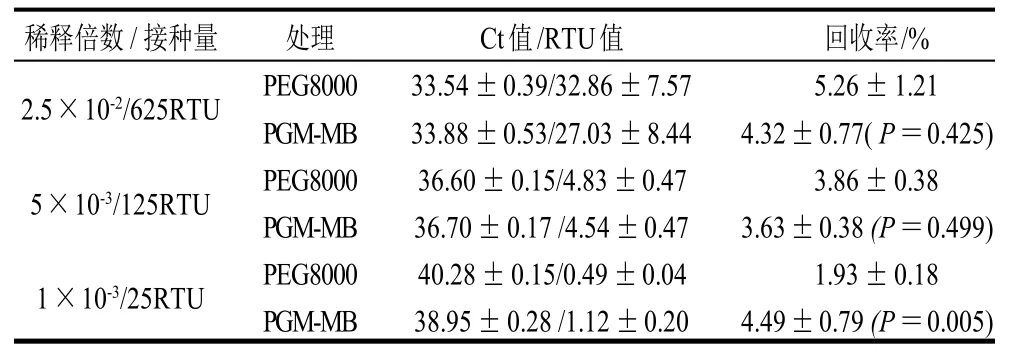
表1 以青葱为基质时PEG8000和PGM-MB方法富集回收率的比较(±s,n=3)Table 1 Recovery rates of viruses from inoculated green onions by PEG8000 and PGM-MB methods (±s,n=3)
注:t-检验中P>0.05,表明两组数据无显著差异;P<0.05表明有差异显著。下同。
稀释倍数/接种量 处理 Ct值/RTU值 回收率/%2.5×10-2/625RTU PEG8000 33.54±0.39/32.86±7.57 5.26±1.21 PGM-MB 33.88±0.53/27.03±8.44 4.32±0.77( P=0.425)5×10-3/125RTU PEG8000 36.60±0.15/4.83±0.47 3.86±0.38 PGM-MB 36.70±0.17 /4.54±0.47 3.63±0.38 (P=0.499)1×10-3/25RTU PEG8000 40.28±0.15/0.49±0.04 1.93±0.18 PGM-MB 38.95±0.28 /1.12±0.20 4.49±0.79 (P=0.005)
由表1可知,接种量为625RTU时,PEG8000富集和PGM-MB富集的平均回收率分别为5.26%、4.32%;接种量为125RTU时,PEG8000富集和PGM-MB富集的平均回收率分别为3.86%、3.63%。接种量分别为625、125 RTU时,P值分别为0.425、0.499。接种量为25RTU时,PEG8000和PGM-MB富集的平均回收率分别为1.93%、4.49%,P值为0.005。
2.1.2.2 以葡萄为基质时回收率的比较
同样选择14μL稀释倍数为2.5×10-2、5×10-3、1×10-3(对应病毒量分别为625、125、25RTU)的诺如病毒悬浮液接种于葡萄表面。在这3个接种量条件下,PEG8000与PGM-MB富集的3次重复均能稳定检出(表2)。
由表2可知,接种的病毒量为625、125RTU与25RTU时,PEG8000的平均回收率分别为7.88%、5.27%和5.11%,PGM-MB的平均回收率分别为46.47%、31.95%和16.40%,PGM-MB的平均回收率均高于PEG8000;t检验的P值分别为P<0.001、P=0.003和P<0.001。
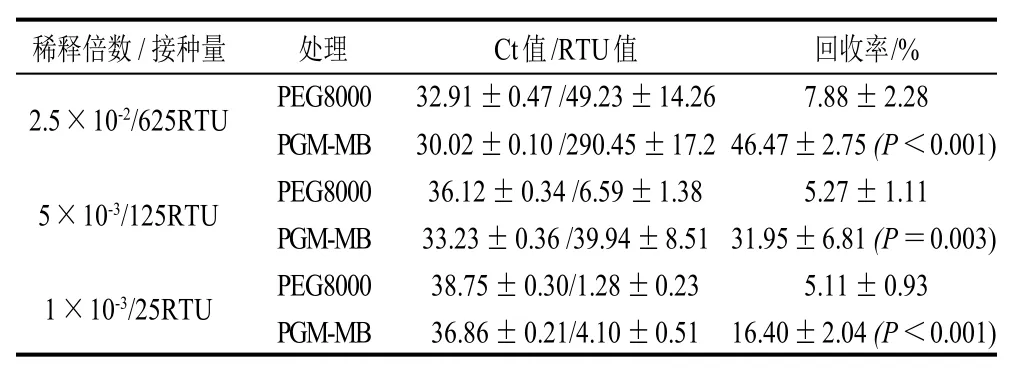
表2 以葡萄为基质时PEG8000和PGM-MB方法富集回收率的比较Table 2 Recovery rates of viruses from inoculated grapes by PEG8000 and PGM-MB methods
2.2 两种富集方法检测下限的比较
2.2.1 以青葱为基质的比较
为比较PEG8000与PGM-MB富集方法的检测下限,选择14μL稀释倍数为1×10-3、2×10-4、4×10-5、8×10-6(对应病毒量分别为25、5、1、0.2RTU)的病毒悬浮液接种于青葱表面,设3次重复。4个接种量下,PEG800富集可检测到25RTU,3次重复均能检出(表3);PGM-MB富集可检测到5RTU,检出情况为3次重复检出2次。
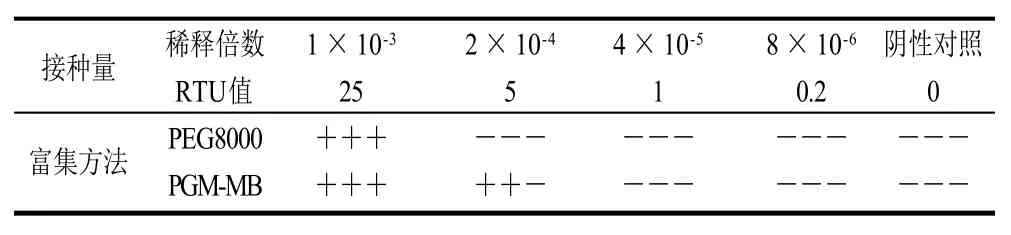
表3 以青葱为基质的检测下限比较Table 3 Detection limit of viruses for inoculated green onions by PEG8000 and PGM-MB methods
2.2.2 以葡萄为基质的比较
同样选择14μL稀释倍数为1×10-3、2×10-4、4×10-5、8×10-6(对应病毒量分别为25、5、1、0.2RTU)的诺如病毒悬浮液接种于葡萄表面,设3次重复。由表4可知,PEG8000富集可检测到5RTU,检出情况为3次重复检出2次;PGM-MB富集可检测到1RTU,检出情况为3次,重复检出1次。
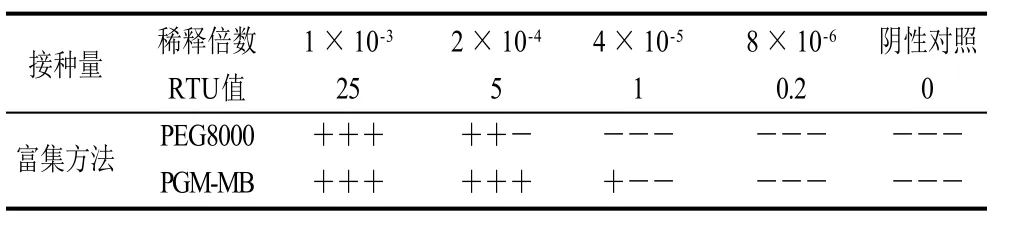
表4 以葡萄为基质的检测下限比较Table 4 Detection limit of viruses for inoculated grapes by PEG8000 and PGM-MB methods
3 讨 论
病毒的富集是检测食品基质中诺如病毒的一个关键步骤,本研究对PEG8000沉淀和PGM-MB的优缺点进行了比较。研究表明:基质为青葱时,在低浓度的病毒接种量条件下, PGM-MB富集的检测下限更低,其回收率也显著高于PEG8000富集;基质为葡萄时,PGMMB富集的回收率均显著高于PEG8000富集,且检测下限更低。由于食品基质中的诺如病毒污染水平往往很低,因此,检测下限越低的方法越能更好的保障食品安全。通过比较研究,认为PGM-MB富集法更适合应用于青葱、葡萄中诺如病毒的检测。
Guevremont等[16]用PEG8000富集法对青葱中诺如病毒的检测进行了研究,其采用的洗脱缓冲液为含有磷酸盐肉汤的甘氨酸缓冲液,RNA提取法为TRIzol裂解法,接种量为100RTU时,可稳定检出,对于接种量为1、10RTU的样品可部分检出,该研究没有进行病毒回收率的研究;本研究中,青葱的病毒接种量为25RTU以上时,PEG8000和PGM-MB富集法均能稳定检出,PGMMB方法的检测下限更低,可部分检测到5RTU接种病毒量。
Kim等[17]用PEG8000富集法对葡萄中诺如病毒的检测进行了研究,其研究结果表明,采用PEG8000富集时,葡萄基质中诺如病毒的回收率为2.6%~19.7%(平均值为8.05%)。本研究中,PEG8000富集葡萄基质中诺如病毒的回收率为5.11%~7.88%(平均值为6.09%),与 Kim等[11]的研究结果相当;而本研究采用的PGM-MB富集方法,回收率为16.40%~46.47%(平均值为31.61%),远高于Kim等报道和本研究报道的PEG8000富集方法。
本研究应用PGM-MB富集检测青葱、葡萄中的诺如病毒,除了其回收率和检测下限整体优于PEG8000方法外,PGM-MB方法最大的优势是节省时间。PEG8000富集法多为过夜富集,具有耗时较长、步骤较多、操作麻烦等缺点,包括RT-PCR检测时间在内,耗时在24h以上;而利用PGM-MB富集检测可在4~6h内完成,能快速检测食品基质中的诺如病毒,该方法简便快捷,能有效的去除RT-PCR反应抑制因子。因此,PGM-MB作为一种新的诺如病毒富集方法适用于水果、蔬菜样品的诺如病毒富集检测。
[1] LOPMAN B A, REACHER M H, Van DUIJNHOVEN Y, et al. Viral gastroenteritis outbreaks in Europe, 1995-2000[J]. Emerging Infectious Diseases, 2003, 9(1): 90-96.
[2] SCIPIONI A, MAUROY A, VINJE J, et al. Animal noroviruses[J]. The Veterinary Journal, 2008, 178(1): 32-45.
[3] Zheng Duping, ANDO T, FANKHAUSER R L, et al. Norovirus classification and proposed strain nomenclature[J]. Virology, 2006, 346(2):312-323.
[4] KOOPMANS M, DUIZER E. Foodborne viruses: an emerging problem[J]. Int J Food Microbiol, 2004, 90(1): 23-41.
[5] DUBOIS E, AGIER C, TRAORE O, et al. Modified concentration method for the detection of enteric viruses on fruits and vegetables by reverse transcriptase polymerase chain reaction or cell culture[J]. J Food Prot, 2002, 65(12): 1962-1969.
[6] COTTERELLE B, DROUGARD C, ROLLAND J, et al. Outbreak of norovirus infection associated with the consumption of frozen raspberries,France, March 2005[J]. Euro Surveill, 2009, 10(17): E050428.1.
[7] LOPMAN B, ADAK G K, REACHER M, et al. Two epidemiologic patterns of norovirus outbreaks: surveillance in England and Wales,1992-2000[J]. Emerg Infect Dis, 2003, 9(1): 71-77.
[8] FUMIAN T M, LEITE J P, MARIN V A, et al. A rapid procedure for detecting noroviruses from cheese and fresh lettuce[J]. Journal of Virological Methods, 2009, 155(1): 39-43.
[9] TAN Ming, JIANG Xi. Norovirus and its histo-blood group antigen receptors: an answer to a historical puzzle[J]. TRENDS in Microbiology,2005, 13(6): 285-293.
[10] HARRINGTON P R, VINJE' J, MOE C L, et al. Norovirus capture with histo-blood group antigens reveals novel virus-ligand interactions[J]. Journal of Virology, 2004, 78(6): 3035-3045.
[11] TIAN Peng, ENGELBREKTSON A, MANDRELL R. Two-log increase in sensitivity for detection of norovirus in complex samples by concentration with porcine gastric mucin conjugated to magnetic beads[J]. Appl Environ Microbiol, 2008, 74(14): 4271-4276.
[12] TIAN Peng, YANG D, MANDRELL R. A simple method to recover norovirus from fresh produce with large sample size by using histo-blood group antigen-conjugated to magnetic beads in a recirculating affinity magnetic separation system (RCAMS)[J]. Int J Food Microbiol, 2011,147(3): 223-227.
[13] 潘良文, 张舒亚, 李晓虹, 等. 贝类产品中诺沃克病毒的实时荧光RTPCR检测方法研究[J]. 检验检疫科学, 2004, 14(5): 1-3.
[14] 刘军义, 潘良文, 张舒亚, 等. SN/T 1635—2005 贝类中诺沃克病毒检测方法普通RT-PCR方法和实时荧光RT-PCR方法[S].
[15] KAGEYAMA T, KOJIMA S, SHINOHARA M, et al. Broadly reactive and highly sensitive assay for Norwalk-like viruses based on real-time quantitative reverse transcription-PCR[J]. J Clin Microbiol, 2003, 41(4): 1548-1557.
[16] GUEVREMONT E, BRASSARD J, HOUDE A, et al. Development of an extraction and concentration procedure and omparison of RT-PCR primer systems for the detection of hepatitis A virus and norovirus GII in green onions[J]. J Virol Methods, 2006, 134(1/2): 130-135.
[17] KIM H Y, KWAK I S, HWANG I G, et al. Optimization of methods for detecting norovirus on various fruit[J]. J Virol Methods, 2008, 153(2):104-110.
Comparative Detection of Human Noroviruses in Green Onion and Grape Using Porcine Gastric Mucin-Conjugated Magnetic Beads and Polyethylene Glycol Enrichment
ZHANG Qi-gang1,2,PAN Liang-wen1,*,LI Xiang1,FANG Yun1,TIAN Peng3
(1. Shanghai Entry-Exit Inspection and Quarantine Bureau, Shangha 200135, China;2. School of Biotechnology, East China University of Science and Technology, Shanghai 200237, China;3. Western Regional Research Center, Agricultural Research Service, United States Department of Agriculture, Albany, CA 94710, USA)
Objective: To establish and compare two detection methods for human norovirus (HuNoV) in fruit (grape) and vegetable (green onion) samples using porcine gastric mucin-conjugated magnetic beads (PGM-MB) and polyethylene glycol 8000 (PEG8000), respectively. Methods: 1 RTU was defined from a consistently (triplicate) positive qRT-PCR signal of viral RNA extract with 4 × 10-6dilution. A standard curve (1 to 10000 RTU) was established to convert Ct values to corresponding RTUs with an equation ofy(Ct) = -3.6967 lg (RTU) +39.12 withR2of 0.999. Green onion and grape samples were inoculated with various amounts of HuNoV, eluted and concentrated using PGM-MB or PEG8000 method. Viral RNA was extracted and quantified by qRT-PCR. Student,st-test was used for statistical analysis. Results: The virus recovery rate by PGM-MB method((31.61 ± 15.04)%) was significantly higher than that obtained by PEG precipitation method ((6.09 ± 1.56)%) at all doses of HuNoV inoculated onto grapes (P<0.001). For virus-inoculated green onions, the virus recovery rates from higher inoculation doses (625 RTU and 125 RTU) were comparable between both methods. However, the virus recovery rate by PGM-MB method from a lower dose of HuNoV (25 RTU) inoculated onto green onion samples was significant higher ((4.49± 0.79)%) than that from PEG precipitation method ((1.93 ± 0.18)%). In addition, PGM-MB method showed a lower detection limit than PEG precipitation method. Conclusion: PGM-MB method requires less time than PEG precipitation method, produces higher yieldof HuNoV from various food samples, and hence exhibits higher sensitivity.
norovirus;porcine gastric mucin-conjugated magnetic beads;polyethylene glycol 8000;real-time polymerase chain reaction (RT-PCR)
2011-10-25
国家质检总局科技计划项目(2010IK147)
张其刚(1983—),男,硕士研究生,研究方向为生物化学分子生物学。E-mail:zqghy2004@126.com
*通信作者:潘良文(1966—),男,研究员,博士,研究方向为食品安全检测。E-mail:panlw888@126.com
TS201.6;R155.5
A
1002-6630(2012)16-0241-05
