反应温度和反应时间对抗坏血酸-赖氨酸Maillard反应体系中挥发性化合物形成的影响
2012-10-27谭志伟余爱农
谭志伟,余爱农
(湖北民族学院化学与环境工程学院,湖北 恩施 445000)
反应温度和反应时间对抗坏血酸-赖氨酸Maillard反应体系中挥发性化合物形成的影响
谭志伟,余爱农
(湖北民族学院化学与环境工程学院,湖北 恩施 445000)
采用顶空固相微萃取-气相色谱-质谱联用技术对抗坏血酸-赖氨酸Maillard反应体系在不同反应温度和时间条件下产物进行分析鉴定,共鉴定出包括吡嗪、醛、呋喃、醇、苯胺和喹啉在内的28个化合物,其中16个吡嗪化合物为主要香味化合物,考察反应温度和反应时间对产物特别是对吡嗪化合物的影响。结果表明:随着反应温度的升高和反应时间的延长,吡嗪类化合物的总量均增加;其中,随反应温度的升高,相对于其他吡嗪化合物,2,5-二甲基吡嗪、2-乙基-3-甲基吡嗪、2-乙基-5-甲基吡嗪、3-乙基-2,5-二甲基吡嗪和2-甲基吡嗪的量明显增加,随反应时间的延长,2,5-二甲基吡嗪的量明显增加。
Maillard反应;抗坏血酸-赖氨酸;反应温度;反应时间;吡嗪化合物
Maillard反应是一类重要的非酶褐变(non-enzymic browning)反应,主要发生在羰基化合物(如还原糖)与含氨基的化合物(如氨基酸和蛋白质)之间,在食品加工如烹煮、烘烤等过程中产生色素和特征香气,赋予食品以色、香和特定的风味,但在食品贮运过程发生此类反应,则会加速食品的变质,因而一直是食品化学、食品工艺学、香料化学和食品加工与贮运等领域的研究热点。抗坏血酸本身在水果、蔬菜及动物肝脏等许多食品中广泛存在,且常作为食品添加剂如抗氧化剂添加到食品中,因此继还原糖之后,基于抗坏血酸-氨基酸Maillard反应体系的研究越来越多[1-14],但对该反应产物中香味化合物的报道却较少。 Mikova等[1]在抗坏血酸与氨的反应产物中共检出5种咪唑衍生物,其中3种化合物的结构得以鉴定。Davidek等[2]从L-脱氢抗坏血酸分别与氨和甘氨酸的反应中,共分离鉴定出甲基吡嗪等5个吡嗪类化合物;Seck等[3]从抗坏血酸与苯丙氨酸反应中分离鉴定出丙基苯、糠醛等9种化合物;Rogacheva等[10]报道了抗坏血酸分别与赖氨酸、甘氨酸和谷氨酸反应,分离鉴定了11、10个和7个挥发性化合物,并考察了反应时间对挥发性产物的影响。Adams等[14]对抗坏血酸与20种氨基酸在K2CO3存在条件下焙烘产生的吡嗪类化合物进行研究。最近研究[15-17]发现在不同pH值条件下抗坏血酸与苏氨酸、丝氨酸、丙氨酸和半胱氨酸反应体系中香味化合物的形成,在pH8条件下产物中香味化合物的种类、产量最多。
Maillard反应过程十分复杂,反应液的pH值、反应温度、反应时间、压力和反应物比例等因素都对反应结果产生影响,研究[15-17]发现反应液的pH值主要影响挥发性产物的种类而影响最终产品的香味。加热温度和时间是食品的热处理过程中影响产品颜色和香味的两个重要加工工艺参数。Jousse等[18]认为反应温度和时间主要影响Maillard反应的动力学,而对挥发性产物的种类影响较小。Ellis[19]认为高温对Maillard反应有利,但没有列出具体的实验数据。目前,对抗坏血酸与赖氨酸反应体系中挥发性产物的研究报道只发现前述两篇文献,Rogacheva等[10]将物质的量比为1:1的抗坏血酸与赖氨酸在100℃条件下分别反应1、7h和50h,最多只分离出11种挥发性产物,其中只鉴定出4种吡嗪化合物;Adams等[14]将物质的量比为1:1:0.1的抗坏血酸、赖氨酸和K2CO3在160℃条件下焙烘20min,共鉴定出15种烷基吡嗪化合物,并认为抗坏血酸的还原性是影响吡嗪类化合物形成机理的重要因素,且K2CO3的存在促进吡嗪化合物的形成。除此之外,未发现反应温度和时间对于抗坏血酸与赖氨酸反应挥发性产物的影响的报道。Maillard反应产物中的吡嗪化合物通常具有坚果和烤香等特征香气,是许多蒸煮、煎烤类食物中如煮熟的大马哈鱼[20]、烤咖啡[21]和炒麦芽[22]等的主要香气成分。鉴于此,本实验基于抗坏血酸与赖氨酸反应体系,采用顶空固相微萃取-气相色谱-质谱联用(headspace solidphase microextraction-gas chromatograph-mass spectrometer,HS-SPME-GC-MS)技术,研究反应温度和时间对模式反应形成香味化合物特别是吡嗪类化合物的影响,并对吡嗪类化合物的形成机理进行合理的推测,为抗坏血酸与氨基酸反应体系中吡嗪类化合物的形成机理和动力学研究提供参考,并为含有抗坏血酸的食品的热加工工艺的研究提供指导。
1 材料与方法
1.1 材料与试剂
DB-5MS毛细管色谱柱(30m×250μm,0.25μm) 美国Agilent科技有限公司;固相微萃取头DVB/CAR/PDMS(50/30μm,灰色) 美国Supelco公司;P160004厚壁耐压反应瓶 北京欣维尔玻璃仪器有限公司。
抗坏血酸(分析纯) 上海国药集团化学试剂有限公司;赖氨酸(分析纯) 上海源聚生物科技有限公司;Na2HPO4、NaH2PO4、NaOH 均为分析纯;C5~C22正构烷烃标准物 美国Pure Chemical Analysis有限公司;实验用水皆为二次蒸馏水。
1.2 仪器与设备
GC(6890N)-MS(5975I)气相色谱-质谱联用仪 美国Agilent科技有限公司;固相微萃取手动进样器 美国Supelco公司;精密电子天平 瑞士Startorius公司;PHSJ-4A型实验室pH计 上海金鹏分析仪器有限公司;MSC-400型磁力加热搅拌器 德国Wiggen Hauser公司。
1.3 样品制备
准确称取0.7045g(4.0mmol)抗坏血酸溶于40mL 0.20mol/L的Na2HPO4-NaH2PO4缓冲溶液(pH8),用固体NaOH将溶液pH值调至8.00,然后加入0.5848g(4.0mmol)赖氨酸,搅拌,使其完全溶解,用100mL P160004厚壁耐压反应瓶密封,在(80±2)、(100±2)、(120±2)、(140±2)、(160±2)℃油浴中搅拌加热,反应120min后用冷水快速冷却至室温,调节反应液的pH7.00,在冰箱中冷藏,待HS-SPME-GC-MS分析,以考察反应温度对反应产物中香气成分的影响。制备同样的反应液,在(140±2)℃条件下反应不同时间(30、60、90、120、150、180min),以考察反应时间对反应产物中香气成分的影响。每个样品平行制备2份。
1.4 HS-SPME-GC-MS分析
取7mL反应液置于15mL专用萃取瓶中,在40℃条件下平衡15min后,插入固相微萃取头DVB/CAR/PDMS(50/30μm,灰色),在40℃条件下顶空萃取40min,采用 GC-MS联用技术进行分析,挥发物用DB-5MS毛细管色谱柱分离。固相微萃取头插入气相色谱进样口在250℃条件下解析4.0min;采用分流进样,分流比为1:30。柱室温度采用程序升温:40℃保温5min,再以5℃/min升温至260℃,然后以15℃/min升温至280℃,保温1min。GC-MS接口温度为280℃;质谱电子电离(electron ionization,EI)源:70eV;电子倍增电压:1753V;质量扫描范围:30~400u;扫描速率:1scan/s。C5~C22正构烷烃在相同条件下分析,以计算待测化合物的线性保留指数(linear retention index,LRI)。被分离出来的化合物经计算机检索并与标准谱图库NIST 08谱库和 Wiley 275谱库对照,对正反匹配度均大于800(最大值为1000)的化合物,计算其LRI与文献中(http://webbook. nist.gov/chemistry/name-ser.html)报道的该化合物的LRI进行比较,对其进一步辅助定性。被分离鉴定化合物的总离子流(total ion chromatogram,TIC)峰面积采用Agilent GC-MS工作站在设定积分阈值为16.5时积分获得。每个样品平行分析2次,实验结果以“平均值±标准偏差”表示。
2 结果与分析

图1 抗坏血酸-赖氨酸反应体系在pH8和(140±2)℃条件下反应150min生成的挥发性成分的总离子流色谱图Fig.1 Total ion current chromatogram of volatile compounds generated from model system containing ascorbic acid and lysine under the reaction conditions: pH 8, reaction temperature of (140 ± 2) ℃and reaction time of 150 min
由图1和表1、2可知,结果共分离鉴定出28个化合物,其中包括16个吡嗪类化合物、4个醛类化合物、2个呋喃、1个苯胺、2个酚类化合物、1个醇和2个喹啉类化合物。吡嗪类化合物是该反应体系中产生的主要的香味化合物,具有坚果、烤香等香气,是许多蒸煮、煎烤类食物中如煮熟的大马哈鱼[20]、烤咖啡[21]和炒麦芽[22]等的主要香气成分。
2.1 吡嗪类化合物形成的可能路径
文献[23]报道了在食品热加工过程中吡嗪类化合物的形成路径有多种可能。一般认为在抗坏血酸-氨基酸反应体系中吡嗪类化合物按以下途径形成:抗坏血酸热降解产生乙二醛、丙酮醛和丁二酮等二羰基化合物[24],生成的二羰基化合物与氨基酸发生Strecker降解反应产生α-氨基乙醛、α-氨基丙酮和α-氨基丁二酮;α-氨基乙醛自缩合反应产生3,6-二氢吡嗪,3,6-二氢吡嗪被氧气氧化生成吡嗪[25],与乙醛反应生成乙基吡嗪[26];α-氨基丙酮自缩合反应生成的2,5-二甲基-3,6-二氢吡嗪[27]与氧气和乙醛反应分别生成2,5-二甲基吡嗪和3-乙基-2,5-二甲基吡嗪;α-氨基乙醛和α-氨基丙酮缩合反应生成2-甲基-3,6-二氢吡嗪,2-甲基-3,6-二氢吡嗪被氧气氧化生成甲基吡嗪,与乙醛反应可以生成2-乙基-3-甲基吡嗪、2-乙基-5-甲基吡嗪和2-乙基-6-甲基吡嗪三种同分异构体;α-氨基丙酮和α-氨基丁二酮缩合反应产物2-乙基-5-甲基-3,6-二氢吡嗪被氧气氧化可生成2-乙基-5-甲基吡嗪,与乙醛反应生成2,3-二乙基-5-甲基吡嗪和3,5-二乙基-2-甲基吡嗪。上述反应中的乙醛可来自于氨基酸的Strecker降解反应[23]。
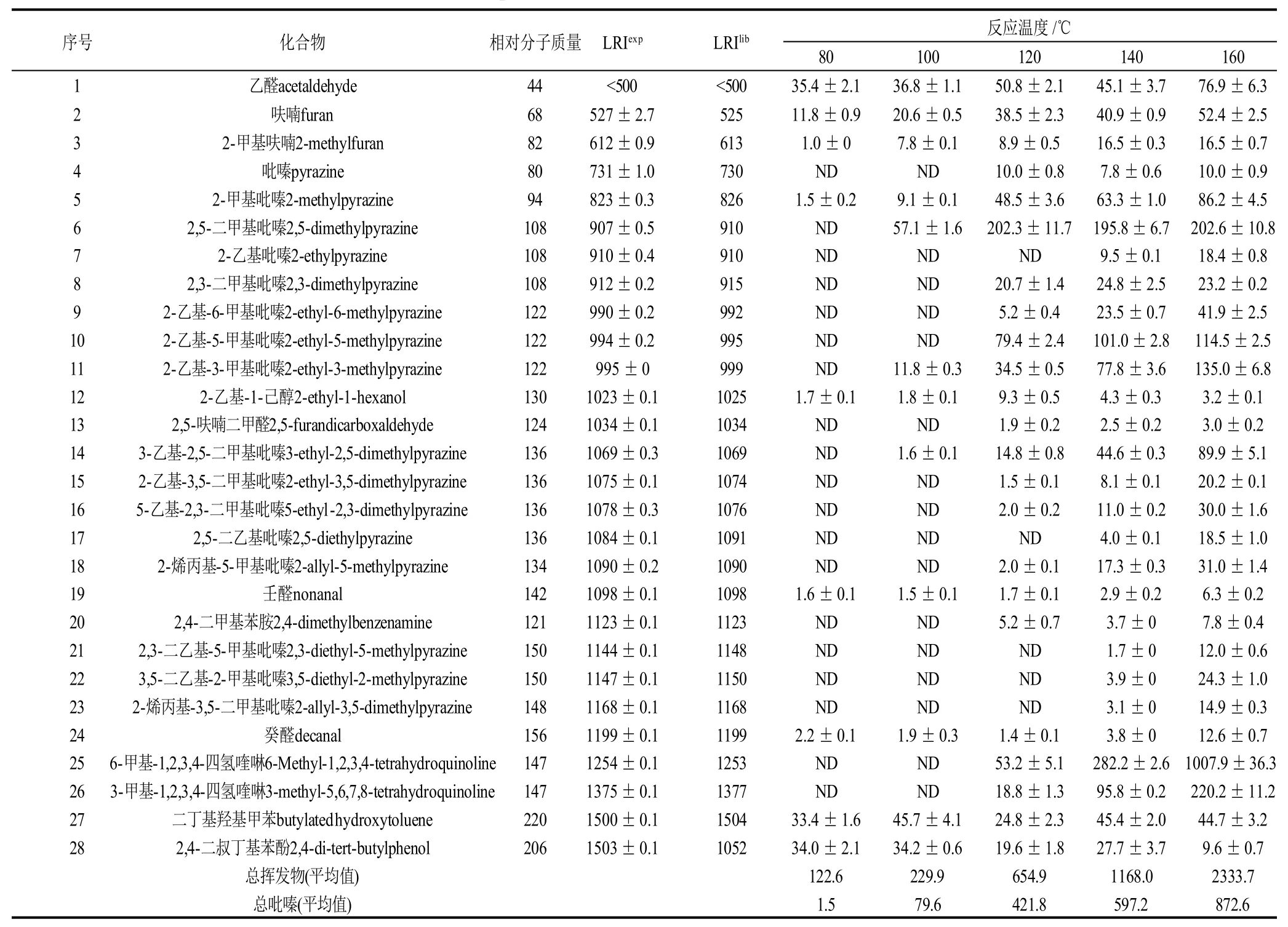
表1 抗坏血酸-赖氨酸反应体系在不同反应温度下形成的挥发性化合物(峰面积×106)Table 1 Volatile compounds generated from model system containing ascorbic acid and lysine under the reaction conditions:pH 8 and reaction time of 150 min
2.2 反应温度对吡嗪化合物形成的影响
如表1所示,抗坏血酸-赖氨酸反应体系在80℃条件下反应120min时,产物中检出乙醛、呋喃、2-甲基呋喃、2-甲基吡嗪、2-乙基-1-己醇、壬醛、癸醛、二丁基羟基甲苯,2,4-二叔丁基苯酚共9个挥发性产物。反应达到100℃时比80℃时多检出了2,5-二甲基吡嗪、2-乙基-3-甲基吡嗪和3-乙基-2,5-二甲基吡嗪3个吡嗪化合物。反应温度为120℃时,2-乙基吡嗪、2,5-二乙基吡嗪、2,3-二乙基-5-甲基吡嗪、3,5-二乙基-2-甲基吡嗪和2-烯丙基-3,5–二甲基吡嗪5个吡嗪化合物没有检出。反应温度达到140℃后,共分离鉴定出28个挥发性产物,反应温度达到160℃时,鉴定出的挥发性产物的种类并没有增加。在该反应体系中,当反应温度达到一定程度时,反应温度主要影响Maillard反应的动力学,而对挥发性产物的种类影响较小,与前述Jousse等[18]的结论是一致的。
如图2A所示,随着反应温度的升高,产物中总吡嗪的量随之增加,总吡嗪峰面积从80℃时的1.5×106增加到160℃时的872.6×106。结果表明,该反应体系,较高的反应温度有利于吡嗪类香味化合物的形成。如图2B所示,随反应温度升高,产物中2-甲基吡嗪、2,5-二甲基吡嗪、2,3-二甲基吡嗪、2-乙基-6-甲基吡嗪、2-乙基-5-甲基吡嗪、2-乙基-3-甲基吡嗪、3-乙基-2,5-二甲基吡嗪、5-乙基-2,3二甲基吡嗪和2-烯丙基-5-甲基吡嗪9个吡嗪化合物的量增加较明显,其中,2,5-二甲基吡嗪在100℃检出时峰面积只有57.1×106,温度升高到120℃时达到202.3×106,再升高温度,其量增加不明显,是主要的吡嗪化合物。2-甲基吡嗪是在80℃时唯一被检出的吡嗪化合物,温度升高到160℃时,峰面积从1.5×106增加到86.2×106,增加明显;其次是2-乙基-3-甲基吡嗪、3-乙基-2,5-二甲基吡嗪,反应温度从100℃升高到160℃时,峰面积分别从11.8×106、1.6×106增加到135.0×106、89.9×106; 2-乙基-5-甲基吡嗪峰面积从120℃的79.4×106增加到160℃时的114.5×106。结果表明,该反应体系,升高反应温度,对2-甲基吡嗪、2,5-二甲基吡嗪、2-乙基-5-甲基吡嗪、2-乙基-3-甲基吡嗪和3-乙基-2,5-二甲基吡嗪这5个吡嗪化合物的形成有利。结合上述吡嗪类化合物形成的可能途径分析,反应温度升高,能促使抗坏血酸热降解生成乙二醛和甲基乙二醛,并与赖氨酸反应生成氨基乙醛和氨基丙酮。从主要生成的吡嗪类化合物分析,高温能促进氨基丙酮的自缩合反应以及氨基乙醛和氨基丙酮的缩合反应。
2.3 反应时间对吡嗪化合物形成的影响
如表2所示,反应30min时,产物中2-乙基吡嗪和2-乙基-3-甲基吡嗪两个吡嗪类化合物没有检出,反应60min后所有28种挥发性化合物均被检出。
如图3A所示,随反应时间的延长,产物中总吡嗪的量基本上呈线性增加,峰面积从30min时的394.0×106增加到180min时的765.2×106。结果表明,延长反应时间对该反应体系中吡嗪类香味化合物的形成有利,但不如反应温度影响那么明显。如图3B所示,随反应时间的延长,产物中2-甲基吡嗪、2,5-二甲基吡嗪、2,3-二甲基吡嗪、2-乙基-6-甲基吡嗪、2-乙基-5-甲基吡嗪、2-乙基-3-甲基吡嗪、3-乙基-2,5-二甲基吡嗪和2-烯丙基-5-甲基吡嗪8个吡嗪类化合物的量有较明显的增加,其中,2,5-二甲基吡嗪反应进行到30min时峰面积就达到181.3×106,为主要的吡嗪化合物,随反应时间的延长,其峰面积增加不明显,反应到180min时也仅为199.6×106;另外,2-甲基吡嗪、2-乙基-3-甲基吡嗪和3-乙基-2,5-二甲基吡嗪的峰面积随反应时间的延长都有增加,但均不明显;2-乙基-5-甲基吡嗪的量在反应时间30~120min之间增加不明显,再延长反应时间,峰面积从120min的101.1×106明显增加到180min的170.1×106。由此表明,随反应时间的延长,该反应体系中2,5-二甲基吡嗪、2-乙基-5-甲基吡嗪、2-甲基吡嗪、2-乙基-3-甲基吡嗪、3-乙基-2,5-二甲基吡嗪5个主要的吡嗪化合物产量均有增加,但不是特别明显。吡嗪类化合物的产量随反应时间的变化可能与吡嗪类化合物的形成机理、反应速率有关,短时间内就达到较高的产量且随反应时间的延长其产量增加不明显的吡嗪类化合物,其生成速率较快,如2,5-二甲基吡嗪。

表2 抗坏血酸-赖氨酸反应体系在pH8、(140±2)℃条件下反应不同时间形成的挥发性化合物(峰面积×106)Table 2 Volatile compounds generated from model system containing ascorbic acid and lysine under the reaction conditions: pH 8 and reaction temperature of (140 ± 2) ℃

图3 反应时间对吡嗪产量(A)和总吡嗪中几种主要吡嗪含量(B)的影响Fig.3 Effect of reaction time on the yield of pyrazines (A) and content change of several major pyrazines (B)
3 结 论
本实验采用顶空固相微萃取-气相色谱-质谱联用技术对抗坏血酸-赖氨酸反应体系在pH8条件下生成的挥发性化合物进行了分离和鉴定,共鉴定出28个化合物,其中有16个吡嗪类香味化合物,大多为烷基吡嗪,如2-甲基吡嗪、2,5-二甲基吡嗪、2-乙基-5-甲基吡嗪、2-乙基-6-甲基吡嗪、3-乙基-2,5-二甲基吡嗪和2-烯丙基-5-甲基吡嗪等。进一步探讨反应温度和反应时间对反应体系挥发性产物中吡嗪类香味化合物的影响,并对该反应体系中吡嗪类化合物形成的可能途径进行了分析。研究表明,随反应温度的升高,总吡嗪的量显著增加,其中,2-甲基吡嗪的量增加最为明显,其次是2-乙基-3-甲基吡嗪、2-乙基-5-甲基吡嗪、3-乙基-2,5-二甲基吡嗪。值得注意的是,2,5-二甲基吡嗪在温度升高到120℃时产量达到较高的值,反应温度再升高,其量增加不明显,是主要的吡嗪化合物。随反应时间的延长,总吡嗪的量也有增加但不如反应温度那么明显,其中,2,5-二甲基吡嗪、2-乙基-5-甲基吡嗪、2-乙基-3-甲基吡嗪和3-乙基-2,5-二甲基吡嗪的量都有增加,但均不特别显著。结果表明,反应温度和反应时间对该反应体系中吡嗪的形成有重要影响,反应温度表现的更为显著。吡嗪类化合物的产量随反应时间的变化可能与吡嗪类化合物的形成机理、反应速率有关,较短的反应时间内产量就达到较高的值且随反应时间的延长增加不明显的吡嗪类化合物,最有可能的原因是其生成速率较快,如2,5-二甲基吡嗪。该研究结果可对抗坏血酸与氨基酸的Maillard反应体系中吡嗪类化合物的形成机理的研究提供参考,对含抗坏血酸的食品的热加工工艺的研究具有指导意义。
[1] MIKOVA K, DAVIDEK J. Formation of alkylimidazoles in a system containingL-ascorbic acid and ammonia[J]. Nahrung, 1975, 19(2): 155-161.
[2] DAVIDEK J, VELISEK J, ZELINKOVA Z, et al. Pyrazine in the reaction ofL-dehydroascorbic acid with ammonia and glycine[J]. J Food Sci, 1977, 42(1): 277-278.
[3] SECK S, CROUZET J. Formation of volatile compounds in sugarphenylalanine and ascorbic acid-phenyllanine model systems during heat treatment[J]. J Food Sci, 1981, 46(3): 790-793.
[4] HARTMANN G J, SCHEIDE J D, HO C T. Effect of water activity on the major volatiles produced in a model system approximating cooked meat[J]. J Food Sci, 1984, 49(2): 607-613.
[5] KENNEDY J F, RIVERA Z S, WARNER F P, et al. Analysis of carbohydrates and amino acids in aqueous solutions ofL-ascirbic acid and correlation of their role in nonenzymic browning of vitamin C[J]. J Micronutr Anal, 1989, 6(1): 1-17.
[6] LOSCHER J, KROH L, WESTPHAL G, et al.L-ascorbic acid: A carbonyl component of nonenzymic browning reactions. Part 2. Aminocarbonyl reactions ofL-ascorbic acid[J]. Zeitschrift fur Lebensm Unters For, 1991, 192(4): 323-327.
[7] YIN D Z, BRUNK U T. Oxidized ascorbic acid and reaction products between ascorbic and amino acids might constitute part of age pigments[J]. Mech Ageing Dev, 1991, 61(1): 99-112.
[8] DAVIES C G A, WEDZICHA B L. Ascorbic acid browning: the incorporation of C1 from ascorbic acid into melanoidins[J]. Food Chem,1994, 49(2): 165-167.
[9] ROGACHEVA S, KUNCHEVA M, PANCHEV I, et al.L-Ascorbic acid in nonenzymatic reactions. Reaction with glycine[J]. Zeitschrift fur Lebensm Unters For, 1995, 200(1): 52-58.
[10] ROGACHEVA S, VERHE R, OBRETENOV C. Aroma compounds formation in the interaction ofL-ascorbic acid withα-amino acids[M]//TAYLOR A, MOTTRAM D. Flavour science: recent developments.Cambridge, UK: The Royal Society of Chemistry, 1996: 250-253.
[11] ROGACHEVA S, KUNCHEVA M, PANCHEV I, et al. Melanoidin formation inL-ascorbic acid-amino acids interaction. A comparotive study[J]. Nahrung, 1999, 43(2): 105-108.
[12] OBRETENOV C, DEMYTTENAERE J, ABBASPOUR T K, et al.Flavor release in the presence of melanoidins prepared fromL-(+)-ascorbic acid and amino acids[J]. J Agric Food Chem, 2002, 50(15): 4244-4250.
[13] FAN X, RENEKER L W, OBRENOVICH M E, et al. Vitamin C mediates chemical aging of lens crystallins by the Maillard reaction in a humanized mouse model[J]. P Nati Acad Sci USA, 2006, 103(45):16912-16917.
[14] ADAMS A, DE KIMPE N. Formation of pyrazines from ascorbic acid and amino acids under dry-roasting conditions[J]. Food Chem, 2009,115(4): 1417-1423.
[15] Yu Ainong, DENG Qihui. Volatiles from the Maillard reaction ofL-ascorbic acid andL-alanine at different pHs[J]. Food Sci Biotechnol,2009, 18(6): 1495-1499.
[16] YU Ainong, ZHANG Aidong. The effect of pH on the formation of aroma compounds produced by heating amodel system containingL-ascorbic acid withL-threonine/L-serine[J]. Food Chem, 2010, 119(1): 214-219.
[17] YU Ainong, ZHANG Aidong. Aroma compounds generated from thermal reaction ofL-ascorbic acid withL-cysteine[J]. Food Chem, 2010,121(4): 1060-1065.
[18] JOUSSE F, JONGEN T, AGTEROF W, et al. Simplified kinetic scheme of flavor formation by the Maillard reaction[J]. J Food Sci, 2002, 67(7):2534-2542.
[19] ELLIS G P. The Maillard reaction[M]//WOLFROM M L. Advances in carbohydrate chemistry. New York: Academic Press, 1959: 63-134.
[20] METHVEN L, TSOUKKA M, ORUNA-CONCHA M J, et al. Influence of sulfur amino acids on the volatile and nonvolatile components of cooked salmon (Salmo salar)[J]. J Agric Food Chem, 2007, 55(4):1427-1436.
[21] DE OLIVEIRA A L, EBERLIN M N, CABRAL F A. Prediction of the solubility of aromatic compounds from Brazilian roasted coffee (2-methylpyrazine; 2-furfurylalcohol; 2,5-dimethylpyrazine;γ-butyrolactone and 2-furfurylacetate) in SC-CO2[J]. J Chem Eng Jpn, 2009, 42(4): 219-230.
[22] CHANNELL G A, YAHYA H, COOK D J. Thermal volatile generation in barley malt: on-line MS studies[J]. J Am Soc Brew Chem, 2010, 68(4): 175-182.
[23] AMRANI H M, CERNY C, FAY L B. Mechanisms of formation of alkylpyrazines in the Maillard reaction[J]. J Agric Food Chem, 1995, 43(11): 2818-2822.
[24] VEMIN G, CHAKIB S, ROGACHEVA S, et al. Themal decomposition of ascorbic acid[J]. Carbohyd Res, 1998, 305(1): 1-15.
[25] ABRAHAM F J, MD ABUL H S. Formation of pyrazines in hydroxyacetaldehyde and glycine nonenzymatic browning Maillard reaction:A computational study[J]. Food Chem, 2007, 103(4): 1208-1216.
[26] SHIBAMOTO T, AKIYAMA T, SAKAGUCHI M, et al. A study of pyrazine formation[J]. J Agric Food Chem, 1979, 27(5): 1027-1031.
[27] MD ABUL H S. Formation of pyrazines in dihydroxyacetone and glycine Maillard reaction: a computational study[J]. Food Chem, 2006, 98(3): 403-415.
Effects of Reaction Temperature and Time on Generation of Volatile Compounds from Maillard Reaction of Ascorbic Acid and Lysine
TAN Zhi-wei,YU Ai-nong
(School of Chemistry and Environmental Engineering, Hubei University for Nationalities, Enshi 445000, China)
The identification of volatile compounds generated from the Maillard reaction of ascorbic acid and lysine at different reaction temperatures and reaction durations was performed using headspace solid-phase microextraction-gas chromatographymass spectrometry (HS-SPME-GC-MS). Twenty-eight volatile compounds were identified, including pyrazines, aldehydes,furans, alcohols, benzenamines and quinolines. Sixteen pyrazines were the primary aromatic compounds. The effects of reaction temperature and time on the generation of volatile compounds, especially pyrazines, were investigated. The results showed that increased total amount of pyrazines was observed with increasing reaction temperature and time. Meanwhile, the generation of 2,5-dimethylpyrazine, 2-ethyl-3-methylpyrazine, 2-ethyl-5-methylpyrazine, 3-ethyl-2,5-dimethylpyrazine and 2-methylpyrazine revealed a significant increase during the reaction between ascorbic acid and lysine with increasing reaction temperature, and an obvious high yield of 2,5-dimethylpyrazine was achieved due to increasing reaction time.
Maillard reaction;ascorbic acid-lysine;reaction temperature;reaction time;pyrazines
TS201.7
A
1002-6630(2012)16-0124-06
2011-06-03
国家自然科学基金面上项目(20876036);湖北省教育厅自然科学研究项目(B2011901)
谭志伟(1977—),男,副教授,硕士,主要从事食品化学及食用香料合成研究。E-mail:tanzw1112@sohu.com
