北五味子种子和果肉中的活性成分比较
2012-10-27李立顺时维静马迅兵
李立顺,时维静*,马迅兵
(安徽科技学院食品药品学院,安徽 凤阳 233100)
北五味子种子和果肉中的活性成分比较
李立顺,时维静*,马迅兵
(安徽科技学院食品药品学院,安徽 凤阳 233100)
目的:比较北五味子种子和果肉中活性成分的差异。方法:采用薄层色谱法比较北五味子种子、果肉和果实中木脂素成分含量;采用苯酚-硫酸法测定种子、果肉和果实及果肉不同组分糖的含量;薄层色谱法分析三氟乙酸水解后,果肉不同组分单糖组成。结果:北五味子木脂素类主要在种子中;北五味子在果肉和种子中的总糖含量分别为169.34、5.366mg/g;果肉中各组分糖含量分别为醇溶组分117.06mg/g、醇沉组分75.67mg/g、多糖组分12.37mg/g。三氟乙酸水解后薄层分析,醇溶组分主要由葡萄糖组成,多糖组分主要由葡萄糖、半乳糖组成。结论:北五味子种子和果肉中活性成分存在明显差异。
北五味子;种子;果肉;木脂素;多糖
北五味子为木兰科植物五味子Schisandra chinensis(Turcz.) Baill.的干燥成熟果实,主产于辽宁、黑龙江、吉林、内蒙古等地。五味子始载于《神农本草经》,作为名贵中药具有悠久的历史,不仅有良好的医疗保健作用,也是国家卫生部公布的药食同源品之一。
现代药理研究表明,五味子有保肝益肾、保护心脑血管、镇痛、镇静、催眠、抗衰老、抗肿瘤、降血糖和免疫增强作用[1]。五味子主要含木脂素(8%)[2]、多糖(11.98%)[3]、挥发油、三萜、有机酸、氨基酸和无机元素等。《中国药典》(2010年版)规定,五味子药材中含五味子醇甲不得少于0.40%[4]。国内外对五味子的活性成分研究多集中在木脂素和多糖[5-8]。本实验比较北五味子果实,种子和果肉中活性成分的差异,为更好地利用五味子开发保健食品提供参考,也为临床用药、炮制和生产提供科学依据。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 药材与试剂
北五味子(产地:辽宁)购于安徽省亳州市。经安徽科技学院食品药品分析检测中心时维静教授鉴定为木兰科植物五味子Schisandra chinensis(Turcz.) Baill.的干燥成熟果实。
对照品均购自中国食品药品检定研究院。五味子甲素(批号:110764-200408)、五味子乙素(批号:110765-20050)、五味子醇甲(批号:110857-200709)、鼠李糖(批号:111683-200401);D-阿拉伯糖(批号:111506-200001);蔗糖(批号:111507-200001);D-无水葡萄糖(批号:110833-200904);乳糖(批号:111646-200301);半乳糖(批号:100226-200404);D-木糖(批号:111508-200404);高效硅胶G、GF254薄层板(规格:20cm×10cm,批号:20090724) 青岛海洋化工厂;超纯水;三氟乙酸、重蒸酚等均为分析纯。
1.1.2 仪器与设备
CAMAG TLC SCANNER 3薄层扫描仪、LINOMAT 5半自动点样仪、TCL VISALIZER薄层色谱成像文件系统 瑞士Camag公司;CP225D准微量天平 德国赛多利斯公司;TU-1810SPC紫外-可见分光光度计 北京普析通用仪器有限公司。
1.2 方法
1.2.1 果实及果肉和种子的分离制备
取北五味子果实500g,50℃干燥12h,置干燥器中放凉。精密称取100.00g三份,分别加水润透,分离果肉与种子,再置干燥箱中50℃干燥,放凉,称量,记录。
1.2.2 种子、果肉和果实中木脂素类测定
1.2.2.1 对照品溶液的制备
精确称取北五味子甲素,五味子乙素,五味子醇甲对照品:2.0、1.8、3.0mg分别置2mL容量瓶中,加二氯甲烷溶解定容,摇匀,即得。
1.2.2.2 供试品溶液的制备
精密称取五味子种子、果肉和果实粉末1.00g,分别置具塞三角烧瓶中,加二氯甲烷20mL,超声提取(功率250W,频率35kHz)30min,滤过,滤液蒸干,残渣加二氯甲烷溶解,定容至2mL作为供试品液。
1.2.2.3 薄层色谱条件与检测
取20cm×10cm硅胶GF254高效薄层板,110℃活化30min;采用半自动点样仪喷雾点样,带宽6.00mm;底边高度10mm;点样量:供试品溶液,果肉4μL、种子2μL、果实2μL,均为2个重复;对照品溶液分为高浓度(S1)和低浓度(S2)分别点于同一轨道,五味子乙素5、1μL;五味子甲素3、0.5μL;五味子醇甲4、1μL,3个重复。样品和对照品共12个轨道在同一薄层板上。以石油醚(30~60℃)-甲酸乙酯-甲酸(15:5:1,V/V)为展开剂,于双槽展开缸预饱和20min,薄层板平衡20min,上行展开展距8cm。室温18℃,相对湿度约55%。
展开后,挥干溶剂,于薄层色谱成像系统254nm波长处拍摄荧光薄层色谱图。
使用薄层扫描仪,单波长反射直线扫描法,λ=254nm,狭缝4.00mm×0.30mm,扫描速率20mm/s获得扫描光谱图。采用外标两点法,进行线性回归。
对薄层板的同一斑点每间隔1~2h扫描测定一次,考查12h内的稳定性。精密吸取对照液各2μL,分别点于同一薄层板上,共5个点,依法展开、扫描测定,进行精密度考查。采用样品与对照品同板点样、展开、扫描,外标两点法测定,线性回归方程计算含量。
1.2.3 北五味子种子、果肉和果实总糖检测
1.2.3.1 供试品溶液的制备
精密称取干燥的北五味子果肉、种子和果实粉末各2.0g, 置于索氏提取器中,加入石油醚(60~90℃)水浴回流提取3次,每次1h,弃提取液。将药粉挥干溶媒后,置于圆底烧瓶中,加蒸馏水100mL,加热回流提取3次,每次1h,合并滤液,水浴浓缩后,定容至250mL,备用。
1.2.3.2 标准系列溶液的制备
精密称定1 0 5℃干燥至质量恒定的无水葡萄糖10mg,定容于10mL容量瓶中,摇匀,配制成质量浓度为1g/L的储备液。从储备液中分别精密移取0.1、0.2、0.4、0.6、0.8、1.0mL置于6个10mL容量瓶中,定容,配制成10、20、40、60、80、100mg/L的葡萄糖标准系列溶液。
1.2.3.3 标准曲线的绘制
精密移取葡萄糖标准系列溶液各1.0mL,空白取1.0mL水,分别置于10mL试管中,各加5%重蒸酚1.0mL后充分振摇,在迅速加入浓硫酸5.0mL,振摇,室温放置30min后,于488nm波长处测定吸光度。以质量浓度(C)为横坐标、吸光度(A)为纵坐标,进行线性回归,得到回归方程为A=0.00787C+0.00485(R2=0.9995)。结果表明,葡萄糖在 10~100mg/L范围内与吸光度呈良好线性关系。
1.2.4 果肉不同组分糖的测定及酸水解
1.2.4.1 果肉不同组分制备
精密称取干燥果肉粉末2.00g,按1.2.3.1节的方法提取,将滤液用活性炭除色后浓缩,加乙醇,使含乙醇体积分数达80%,4℃放置24h,4800r/min、20min离心分离,得醇沉组分(粗多糖)和醇溶组分(单糖、低聚糖等),80℃真空干燥48h,计算得膏率。另取干燥果肉粉末5.00g,按上法制得果肉粗多糖,用少量蒸馏水稀释,Sevag法反复多次脱蛋白,再用氯仿、丙酮、无水乙醇依次洗涤多次,干燥,得精制多糖粉末,称量,计算得率。


1.2.4.2 对照品溶液制备
分别称取干燥至质量恒定的葡萄糖、木糖、鼠李糖、半乳糖、阿拉伯糖、乳糖、蔗糖对照品1.5、1.2、1.8、0.8、1.1、0.9、2.0mg,分别用超纯水定容于1mL容量瓶中,得糖对照品溶液。
1.2.4.3 供试品溶液制备
称取精制多糖24.20mg,醇溶组分34.20mg,置安培瓶中,分别加入2mL 2mol/L三氟乙酸溶液,封口后于110℃水解4h,冷却后,过滤除去不溶物,用N2除去多余的三氟乙酸。分别用蒸馏水定容至10mL容量瓶,备用。
1.2.4.4 薄层色谱条件
取高效硅胶G板,110℃活化30min,半自动点样仪喷雾点样,带宽6.00mm;底边高度10mm;对照品与供试品同板点样各2μL,以正丁醇-乙酸乙酯-异丙醇-醋酸-水-吡啶(7:20:12:7:6:6,V/V)为展开剂,上行展开8cm,取出,晾干。喷苯胺-二苯胺溶液显色剂,110℃烘至斑点清晰。于薄层色谱成像系统白光下拍摄。
2 结果与分析
2.1 五味子果肉和种子占果实的比率
将果实分离的果肉与种子,精密称量,计算出果肉和种子占果实的百分比,结果见表1。

表1 北五味子果实中种子和果肉含量Table 1 Percentages of seed and flesh in Schisandrae chinensis Fructus
2.2 果实、种子和果肉中木脂素类成分的比较
2.2.1 薄层色谱定性比较
按1.2.4.4节的方法进行实验,由254nm波长处拍摄的荧光薄层色谱图(图1)可以看出,样品分离良好,对照品从上至下依次为五味子乙素、五味子甲素、五味子醇甲。从相对应的色谱条带,可清晰对比出同一质量分数下种子的3种成分高于果实;果肉虽加倍点样量,也极微量。表明五味子木脂素类成分主要存在种子中。

图1 北五味子果肉、种子、果实及对照品的薄层色谱图Fig.1 HPTLC profile of mixed deoxyschizandrin, γ-schizandrin and schisandrin standards and Soxhlet extracts from fresh, seed and whole fruit of Schisandrae chinensis Fructus
2.2.2 薄层扫描含量测定
按1.2.4.4节的方法,样品与对照品同板点样、展开、扫描、测定。稳定性考查结果显示,斑点在12h内稳定,相对标准偏差为1.7%(n=5)。精密度考查对照液5个点,相对标准偏差为1.9(n=5)。采用外标两点法,得回归方程为:Y乙素=2923.660+3.101X(r=0.99970,s=1.76%);Y甲素=2313.764+4.365X(r=0.99942,s=2.65%);Y醇甲=8249.184+1940.532X(r=0.99932,s=1.47%)。乙素、甲素、醇甲分别在0.9~4.5、0.5~3.0、1.5~6.0μg范围内呈良好线性关系。五味子果实、种子和果肉薄层扫描色谱峰图(图1)和三维图(图2)可比较3者的差异,果实、种子和果肉中五味子甲素、乙素、醇甲的含量测定结果见表2。

图2 五味子果实、种子和果肉薄层扫描三维图谱Fig.2 Three-dimension (3D) TLC of Soxhlet extracts from fresh, seed and whole fruit of Schisandrae chinensis Fructus

表2 果实、种子和果肉中五味子甲素、乙素、醇甲的含量Table 2 Contents of deoxyschizandrin,γ-schizandrin and schisandrin in whole fruit, seed and flesh of Schisandrae chinensis Fructus
2.3 种子、果肉和果实中总糖含量比较
光谱扫描结果在488nm波长处有最大吸收(图3)。取果肉、种子和果实供试品溶液1mL分别定容于25mL量瓶中,精密移取1.0mL,按1.2.3.3节标准曲线的方法测定其吸光度,计算总糖含量(表3)。结果表明,果肉的总糖含量是种子的3倍。

图3 紫外-可见分光光度计光谱扫描结果Fig.3 Visible absorption spectrum of Schisandrae chinensis Fructus extract

表3 果肉、种子和果实中总糖的含量测定结果Table 3 Total sugar contents in fresh, seed and whole fruit of Schisandrae chinensis Fructus
2.4 果肉中不同组分糖含量比较
精密称定醇溶组分、醇沉组分和多糖组分各1.0mg,定容25mL量瓶中,配制成40mg/L待测溶液。照1.2.3.3节标准曲线的方法测定其吸光度,结合得膏率,计算每克果肉各组分糖的含量,结果见表4。

表4 果肉不同组分糖的含量测定结果Table 4 Polysaccharide contents in different fractions from Schisandrae chinensis Fructus flesh
2.5 果肉各组分单糖组成分析
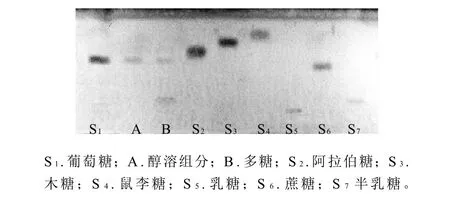
图4 五味子果肉的糖水解物及标准品的薄层色谱图Fig.4 HPTLC profile of sugar standards, hydrolyzed alcohol-soluble fraction and hydrolyzed purified polysaccharide fraction from Schisandrae chinensis Fructus flesh
将五味子果肉醇溶组分(A)、精制后多糖(B)酸水解后,与葡萄糖、木糖、鼠李糖、半乳糖、阿拉伯糖、乳糖、蔗糖对照品,同板点样,分析其单糖组成(图4)。结果表明,果肉醇溶组分主要是葡萄糖(S1),多糖组分主要是葡萄糖(S1)和半乳糖(S7)。
3 讨论与结论
本研究结果表明,北五味子木脂素类成分主要在其种子中,糖类成分主要在其果肉中。将果肉提取物分为醇沉组分(粗多糖等)、醇溶组分(单糖、低聚糖等)及精制多糖,果肉中单糖、低聚糖的含量高于多糖。采用三氟乙酸水解处理发现,果肉中醇溶组分主要是葡萄糖,果肉中多糖组成主要是葡萄糖和半乳糖。提示开发利用五味子的不同成分,选用不同的药用部位,可提高利用率,减少浪费[9]。
高效薄层色谱法能同时完成多个样品的薄层色谱图比较,尤其适用于药材、食品中复杂天然产物的组分分离及定性、定量分析[10]。通过色谱图谱可直观将各样品的相似程度和差异展示在同一张图像中,从图1、2和表2可以比较出五味子木脂素类成分主要在种子。图4的单糖组成比较,果肉醇溶组分主要是葡萄糖;多糖组分主要是葡萄糖和半乳糖。本实验选用的北五味子采用药典中的高效液相色谱法检测五味子醇甲含量为1.47%[11],因提取和检测方法不同,结果有一定差别。
本实验采用Sevag法除蛋白和2mol/L三氟乙酸水解,李巧云等[12]认为,酶法与Sevag联用法用于五味子粗多糖脱蛋白效果很好。孟宪军等[13]在五味子多糖的分离纯化中,采用酶法与三氯乙酸-正丁醇法结合脱蛋白。孙元琳等[14]报道不同程度酸水解和酶水解所得水解产物不一样。
[1] 史琳, 王志成, 冯叙桥. 五味子化学成分及药理作用的研究进展[J].药物评价研究, 2011, 34(3): 208-212.
[2] 黄晓东, 任旷. 五味子木脂素研究进展[J]. 吉林医药学院学报, 2010,31(1): 46-49.
[3] 薛梅, 周静. 五味子多糖的提取及含量测定[J]. 陕西中医, 2003, 24(3): 267-268.
[4] 国家药典委员会. 中国药典[S]. 北京: 中国中医药出版社, 2010: 61.
[5] 丛娟, 宫莉, 闫小娟. 五味子多糖的提取及分离[J]. 食品与生物技术学报, 2011, 30(1): 90-94.
[6] 曹丽萍. 五味子木脂素提取方法研究[J]. 辽宁中医药大学学报, 2011,13(1): 185-187.
[7] 马涛, 毛红燕, 石太渊, 等. 五味子多糖的微波辅助-半仿生法提取工艺优化[J]. 中国食品学报, 2011, 11(1): 98-105.
[8] 阴冠秀, 杜冰, 华洋林, 等. 超声波辅助酶解法提取五味子乙素[J].食品科学, 2011, 32(6): 115-119.
[9] 仰榴青, 陈荣华, 吴向阳, 等. 五味子醇提残渣中粗多糖的免疫活性研究[J]. 食品科学, 2008, 29(6): 392-394.
[10] GANGADEVI V, MUTHUMARY J. A simple and rapid method for the determination of taxol produced by fungal endophytes from medicinal plants using high performance thin layer chromatography[J]. Chinese Journal of Chromatography, 2008, 26(1): 50-55.
[11] 李立顺, 时维静, 王贵阳. 3种五味子药材HPTLC鉴别与HPLC含量测定[J]. 时珍国医国药, 2011, 22(7): 1698-1699.
[12] 李巧云, 居红芳, 翟春. 五味子粗多糖提取工艺的研究[J]. 食品科学,2004, 25(5): 105-109.
[13] 孟宪军, 那广宁, 高晓旭, 等. 北五味子多糖的分离纯化研究[J]. 食品科技, 2008, 33(11): 197-199.
[14] 孙元琳, 申瑞玲, 汤坚, 等. 当归多糖的水解特征及其水解产物分析[J]. 分析化学, 2008, 36(3): 348-352.
Comparative Analysis of Bioactive Component in Seeds and Flesh ofSchisandrae chinensisFructusby Thin Layer Chromatography
LI Li-shun,SHI Wei-jing*,MA Xun-bing
(School of Food and Drug, Anhui Science and Technology University, Fengyang 233100, China)
Objective: To comparatively analyze bioactive components in seeds and flesh ofSchisandrae chinensisFructus.Methods: The contents of lignan in seeds, flesh and whole fruit ofSchisandrae chinensis Fructuswere determined by high performance thin layer chromatography (HPTLC). Sulfuric acid-phenol method was used to quantify sugar. After trifluoroacetic acid hydrolysis, the monosaccharide composition of the flesh was analyzed by HPTLC. Results: Lignans inSchisandrae chinensis Fructuswere mainly present in the seeds, and total sugar content was 169.34 mg/g in the flesh and 5.366 mg/g in the seeds. The alcoholsoluble, alcohol-insoluble and polysaccharide components were 117.06, 75.67 mg/g and 12.37 mg/g in the fresh, respectively. The alcohol-soluble fraction was mainly composed of glucose. The polysaccharide fraction was mainly composed of glucose and galactose.Conclusion: Bioactive components reveal a significant difference between seeds and flesh ofSchisandrae chinensis Fructus.
Schisandrae chinensisFructus;seeds;flesh;lignanoid;polysaccharides
R284.2;R931.6
A
1002-6630(2012)16-0175-04
2011-07-28
安徽省科技厅科技攻关重点项目(07010300153);安徽省中药材产业技术研发中心基金项目(ZYC20101503);安徽科技学院自然科学研究计划项目(ZRC2011294)
李立顺(1957—),男,副教授,主要从事中药活性成分及复方应用研究。E-mail:lls3212@163.com
*通信作者:时维静(1957—),女,教授,主要从事中药活性成分分离与检测研究。E-mail:shiwj80@yahoo.com.cn
