Fe3O4@Si-C8/C18复合磁性纳米材料的制备及其在兽药净化中的应用
2012-10-27阳承利吕敬章汤慕瑾刘启颂万志刚谢丽琪岳振峰李丽苏
张 恒,阳承利,吕敬章,汤慕瑾,刘启颂,万志刚,谢丽琪,岳振峰,李丽苏
(1.深圳出入境检验检疫局,广东 深圳 518045;2.北京大学深圳研究生院,广东 深圳 518055)
Fe3O4@Si-C8/C18复合磁性纳米材料的制备及其在兽药净化中的应用
张 恒1,阳承利2,吕敬章1,汤慕瑾1,刘启颂2,万志刚1,谢丽琪1,岳振峰1,李丽苏1
(1.深圳出入境检验检疫局,广东 深圳 518045;2.北京大学深圳研究生院,广东 深圳 518055)
将Fe3O4@Si-C8/C18复合磁性纳米材料应用于食品安全中的兽药净化领域,采用共沉淀法制备磁性纳米前躯体,并在乙醇相中进行表面硅化处理及(辛基三甲氧基硅烷)C8/(十八烷基三甲氧基硅烷)C18表面修饰,经透射电镜、X射线、磁性能分析、红外光谱等手段对所制备的复合磁性纳米进行表征,所制备的磁性纳米大小均匀,粒径在100~1000nm范围内可调,经多重修饰后的Fe3O4@Si-C8/C18复合磁性纳米材料其磁性强度没有明显降低,并具有表面富集功能。为考察这种磁性纳米材料在兽药提取中的应用,选取豆芽中氯霉素残留的净化来进行初步研究,结果表明所制备的复合型磁性纳米材料在小分子净化富集中展现出广阔的应用价值,尤其在食品安全领域。
复合磁性纳米;C8/C18;兽药净化
在对小分子提取净化中,普遍采用传统方法,如液液萃取等,它们存在自动化程度低、净化效率低、选择性差、成本高、劳动强度大、环境污染严重逐渐不能满足当前仪器分析方法的发展要求。一些新的样品处理技术被应用到这个领域,如固相萃取(solid-phase extraction,SPE)[1-6]、基质固相分散技术(matrix solidphase dispersion,MSPD)[7-9]、超临界流体萃取(supercritical fluid extraction,SFE)[10-11]、免疫亲和色谱(immunoaffinity chromatography ,IAC)[12-14]等。这些技术的出现,是对传统经典方法的补充,使前处理技术简便高效,选择性高,样品用量少,溶剂消耗量少等优势得到发挥。但纵观这些技术,并没有摆脱人工操作的方式,建立在一些硅胶微球,填料、装柱、洗柱等流程上,这又大大的限制了样品处理的高通量,无法真正地实现自动化处理,不能使实验者从大量繁琐的前处理工作量中上解放出来。
固相萃取的应用最为普遍成熟,SPE柱已是商品化产品,可选择的品种多,一次性使用,是目前药物残留分析前处理的主流技术,基质固相分散技术对生物组织样品的处理较有效,但研磨的粒度大小和添装技术的差别可能使淋洗曲线有所差异,方法不易标准化。
针对上述小分子类检测样品前处理中的不足,难以实现自动化、操作繁琐等,本实验室开发一种制备简易方法用于制备Fe3O4@Si-C8/C18复合磁性纳米材料,为考证这种磁性纳米在小分子提取中的应用,选用豆芽中氯霉素的残留进行富集纯化作为模型进行磁性纳米材料的提纯应用实验。
1 材料与方法
1.1 材料、试剂与仪器
氯化亚铁(FeCl2·4H2O)、三氯化铁(FeC13·6H2O)、氨水(25~28g/100mL),均为国产分析纯 国药化学试剂公司;辛基三甲氧基硅烷(C8)、十八烷基三甲氧基硅烷(C18)、正硅酸乙酯 美国Sigma-Aldrich公司。
JEM-2100透射电镜(100kV) 日本Jeol公司;PC2500粉末X射线衍射 日本Rigaku Corporation公司;Model-155振动样品磁强计 美国Digital Measurement System公司;IRPrestige-21傅里叶变换红外光谱仪 日本Shimadzu公司;API 3000TM液相色谱-串联质谱仪 美国Applied Biosystems公司。
1.2 磁性二氧化硅纳米微球的制备[15-16]
在盛有800mL去离子水的2L搅拌式反应器中加入0.129mol氯化亚铁(FeCl2·4H2O)和0.26mol三氯化铁(FeC13·6H2O),加入40mL氨水,在氮气保护下,85℃反应1h,得到磁性Fe3O4纳米前躯体。
称取0.5g磁性Fe3O4纳米前躯体加入到由20mL去离子水、80mL异丙醇、0.75mL浓氨水和适量的正硅酸乙酯的混合溶液中,均匀分散,室温条件下反应24h。用乙醇洗涤数次,得到磁性二氧化硅纳米微球。
1.3 C18/C8在磁性二氧化硅纳米微球的偶联
取上述预修饰的纳米微球0.5g,加入到400mL无水乙醇中,补加1~4mL去离子水,加入一定体积的辛基三甲氧基硅烷(C8)/十八烷基三甲氧基硅烷(C18)混合液,反应12~24h后,加入一定体积的氨水,反应1~3h,整个反应过程,控制搅拌速度在一定范围内。反应结束后,用乙醇洗涤多次,真空干燥箱中进行干燥处理。
1.4 样品表征
磁性纳米微球的形貌采用透射电镜表征;磁性纳米微球的粉末X射线衍射分析在D/max衍射仪上进行,Cu靶Kα射线,波长λ=1.54,扫描范围10°~70°;磁性纳米微球的磁性能采用振动样品磁强计在室温条件下测量,测量场强范围0~8kOe;C18/C8偶联的磁性纳米微球采用傅里叶变换红外光谱仪分析。
1.5 Fe3O4@Si-C8/C18纳米材料用于分离和富集豆芽中的氯霉素
取上述修饰后的Fe3O4@Si-C8/C18磁性纳米材料10.0mg,经无水甲醇、氯仿、超纯水清洗后备用。取绿豆芽3.0g,加入氯霉素标准品终质量浓度为0.1μg/kg,搅碎的豆芽制品,加入6 mL乙酸乙酯进行混合振荡1min;2000×g离心10min;对于黄豆芽,取4mL上层乙酸乙酯转移到15mL离心管中,50℃温和氮流蒸发乙酸乙酯,然后加入1mL超纯水混匀后加入到上述磁性纳米中,涡旋混合均匀,室温静置1~2min,放置到磁力架上进行分离,吸取上清液后,加入500μL超纯水进行清洗数次,之后加入一定体积的乙腈进行洗脱,吸取上清乙腈溶液进行高效液相色谱-串联质谱法(high performance liquid chromatography-mass spectrometry/ mass spectrometry,HPLC-MS/MS)检测。
1.6 仪器条件
色谱条件:色谱柱:BDS-C18(2.1mm×150mm,3.5μm);柱温:30℃;流速300μL/min;流动相为水和乙腈混合溶液,梯度洗脱条件见表1。

表1 流动相梯度洗脱条件Table 1 Mobile phase composition for gradient elution
质谱条件:电喷雾电离(electrospray ionization,ESI)离子模式;离子化温度:450℃;雾化气(NEB):8L/min;气帘气(CUR):10L/min;碰撞气(CAD):5L/min;喷雾电压(IS):-3900V。
2 结果与分析
2.1 磁性纳米的制备与形貌表征
磁性纳米的制备主要分为前驱体的制备及其在前驱体基础上进行的硅层修饰,通过调整前驱体与反应体系的比例关系,可以控制所制备二氧化硅纳米的大小,粒径在100~1000nm范围内可调。如在提取的后续实验,所用到的其中一种纳米材料如图1所示,显示了C8/C18偶联的磁性二氧化硅纳米的扫描电镜照片,可以明显看出,颗粒成球形,且大小分布非常均匀,其平均粒径为200nm。

图1 磁性纳米Fe3O4@Si-C8/C18投射电镜图Fig.1 TEM of magnetic nanoparticle Fe3O4@Si-C8/C18
2.2 粉末X射线衍射
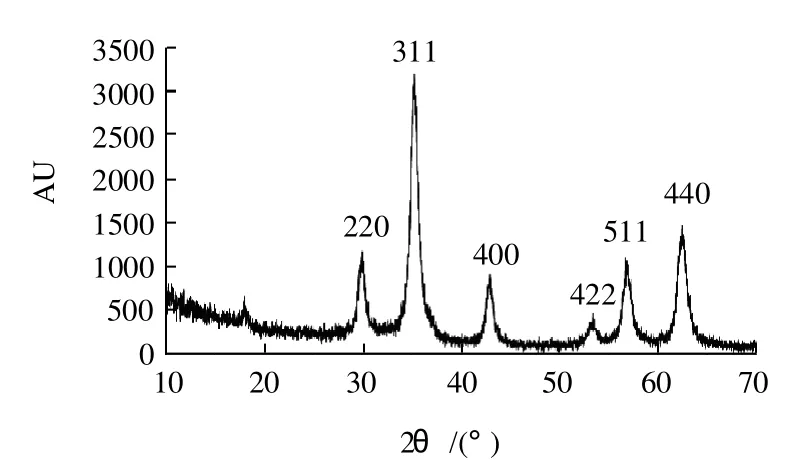
图2 磁性纳米Fe3O4@Si-C8/C18粉末X射线衍射谱图Fig.2 XRD of magnetic nanoparticle Fe3O4@Si-C8/C18
图2显示了C8/C18偶联的磁性二氧化硅微球的粉末X射线衍射谱图,从图2可以看出,立方晶系尖晶石结构的标准Fe3O4晶体主要有6个对应于{220}、{311}、{400}、{422}、{511}和{440}面网的衍射峰,与磁性微球样品的6个主要衍射峰对比,它们的峰位置(2θ)和相对强度完全一致,说明磁性微球中所含氧化铁主要是尖晶石结构的磁性Fe3O4。此外,在15~20°的范围内有一个峰包出现,表明在磁性微球中有无定形的二氧化硅存在。
2.3 红外光谱图
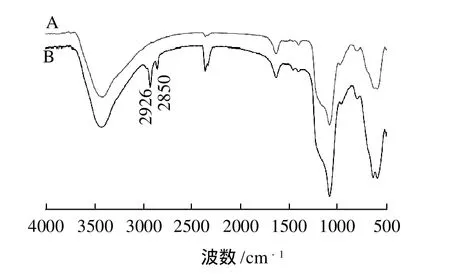
图3 磁性纳米Fe3O4@Si-C8/C18红外光谱图Fig.3 FT-IR spectra of magnetic nanoparticles before and after C8/C18 modification
图3显示了C8/C18偶联前后的磁性二氧化硅微球的红外光谱图,从C8/C18偶联的磁性二氧化硅微球的谱图可以看出,在2926cm-1和2850cm-1处有两个明显的甲基和亚甲基的收缩振动峰,由此可以证明C8/C18分子偶联在微球的表面成功。
2.4 磁性能分析
振动样品磁强计在室温条件下测定的磁性二氧化硅微球和C8/C18偶联的磁性二氧化硅微球的磁滞曲线见图4。由图4可知,磁性二氧化硅微球和C8/C18偶联的磁性二氧化硅微球的磁滞曲线均无明显磁滞现象,在外加磁场等于0时,剩余磁化强度和矫顽力均为0。因此,制备的磁性二氧化硅微球和C8/C18偶联的磁性二氧化硅微球都表现出超顺磁性。C8/C18偶联的磁性二氧化硅微球的比饱和磁化强度为37.8emu/g,比磁性二氧化硅微球的比饱和磁化强度(40.2emu/g)略低一点,这是因为大量的C8/C18分子偶联在微球的表面。这也进一步证明了C8/C18分子偶联在微球的表面是成功的。
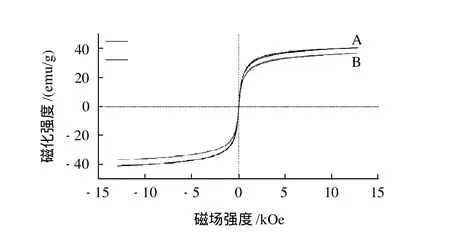
图4 磁性纳米Fe3O4@Si-C8/C18磁滞曲线Fig.4 Hysteresis curves of magnetic nanoparticles and C8/C18 modified magnetic nanoparticles
2.5 磁性纳米提取豆芽中氯霉素的研究
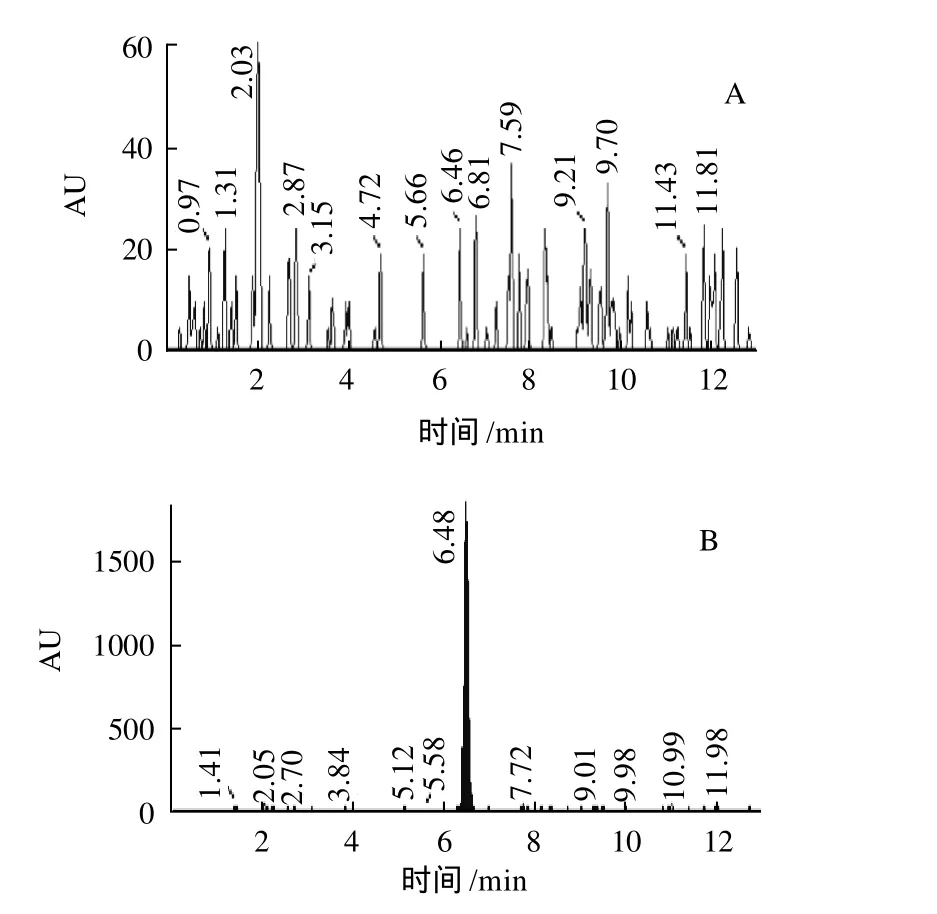
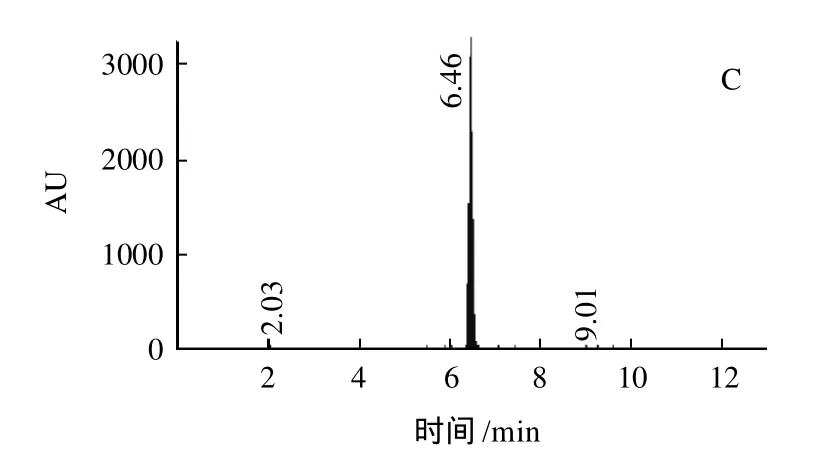
图5 基于磁性纳米Fe3O4@Si-C8/C18提取豆芽中氯霉素谱图Fig.5 Ion current chromatograms of chloramphenicol residues in bean sprout purified with magnetic nanoparticles or C8/C18 modified magnetic nanoparticles
所制备的磁性纳米经无水甲醇、氯仿、超纯水清洗后,对水体系中存在的氯霉素溶液进行富集,洗脱液采用API3000串联质谱仪,配ESI-离子源对提取结果进行测定。如图5所示,未经C18/C8修饰的磁性纳米不能从溶液中提取出氯霉素,而经C18/C8修饰后,能够很好的从溶液溶液中提取出氯霉素分子,从图5B可以看到有单一的氯霉素峰谱,与单纯的氯霉素溶液对照组(图5C)的出峰位置是一致的,可见经C18/C8修饰的磁性纳米能够用于豆芽中氯霉素的纯化,没有带入过多的其余杂质物质,回收率在90%~105%之间。
3 讨 论
磁性纳米材料由于具有的小粒径、超顺磁性、毒副作用小、易于表面修饰等得以广泛的应用于生物的各种成分如生物细胞、细胞器、病毒、细菌、抗体、DNA、RNA等分离或纯化或免疫分析[17-20]。尤其磁性纳米粒子在核酸纯化方面得到了充分的发挥,已有大量的商品化试剂盒供应被应用于多种体系中DNA的提取和净化,而未见有报道磁性纳米用于环境、食品等中兽药小分子的净化。在进行不同体系的检测中,前处理步骤仍然成为整个检测的瓶颈,为了使其前处理步骤能够进行自动化,降低前处理中繁琐的流程,提出了采用经不同基团对磁性纳米材料进行修饰,从而能够从环境、食品中提取相对应的目标分子。本实验主要研究在制备Fe3O4@Si-C8/C18复合磁性纳米材料的基础上,选取简单的水环境体系进行初步验证,通过以上结果可以看到取得了预期的效果,采用这种磁性纳米能够很好对水样中的氯霉素进行富集。通过比较单独的修饰C8或C18磁性纳米材料,其提取效果并没有同时修饰C8/C18复合磁性纳米材料的效果更理想。可能因为C8修饰型材料适合分析弱极性物质里极性稍强的一类物质,C18修饰型材料适合分析弱极性物质里极性更弱的物质,所以将两种类型的分子按照一定的比例同时修饰磁性纳米上,可以对宽范围弱极性小分子起到很好的富集和分离。再考虑到C18分子比C8有更长的碳链以及存在的空间位阻效应,C8分子能弥补C18“庞大”而造成的遗留空间,二者的结合达到了较为理想的提取效果。
通过对豆芽中氯霉素的提取进行初步的研究,显示出基于磁性纳米材料的表面修饰C8/C18在兽药小分子提取中具有重要的应用潜力,本研究将Fe3O4@Si-C8/C18复合磁性纳米材料应用于兽药小分子的提取,与合适的自动化提取仪器配合,具有潜在的自动化提取能力。同时该磁性纳米材料与传统SPE柱相比,简化实验流程,弥补商品化的萃取柱的操作繁琐,大大的节省样品前处理的时间,简化前处理步骤,有望成为食品安全领域兽药检测分析中重要的前处理方法。
[1] CHEN Yong, PAWLISZYN J. Solid-phase microextraction field sampler [J]. Analytical Chemistry, 2004, 76(22): 6823-6828.
[2] CHEN Ligang, WANG Hui, ZENG Qinglei, et al. On-line coupling of solid-phase extraction to liquid chromatography: a review[J]. J Chromatogr Sci, 2009, 47(8): 614-623.
[3] HASEGAWA C, KUMAZAWA T, LEE X P, et al. Pipette tip solidphase extraction and gas chromatography-mass spectrometry for the determination of methamphetamine and amphetamine in human whole blood[J]. Anal Bioanal Chem, 2007, 389(2): 563-570.
[4] JUHASCIK M P, JEKINS A J. Comparison of liquid/liquid and solidphase extraction for alkaline drugs[J]. J Chromatogr Sci, 2009, 47(7): 553-557.
[5] 傅若农. 固相微萃取(SPME)的演变和现状[J]. 化学试剂, 2008, 30 (1): 13-22.
[6] 祝伟霞, 杨冀州, 梁炜, 等. 固相萃取技术在兽药残留分析中的应用[J]. 动物医学进展, 2007, 28(8): 99-101.
[7] 余辉菊, 杨晓松, 杨胜利. 基质固相分散-高效液相色谱法测定蜂蜜中10种磺胺类药物[J]. 中国食品卫生杂志, 2011, 23(2): 147-150.
[8] BOULAIRE S L, BAUDURET J C, ANGRE F. Veterinary drug residues survey in meat: an HPLC method with a matrix solid phase dispersion extraction[J]. Journal of Agricultural and Food Chemistry, 1997, 45(6): 2134-2142.
[9] CRESCENZI C, BAYOUDH S, CORMACK P A, et al. Determination of clenbuterol in bovine liver by combining matrix solid-phase dispersion and molecular imprinted solid-phase extraction followed by liquid chromatography/electrospray ion trap multiple-stage mass spectrometry [J]. Anal Chem, 2001, 73(10): 2171-2177.
[10] ONG C P, LEE H K, LI S F. Supercritical fluid extraction and chromatography of cholesterol in food samples[J]. J Chromatogr, 1990, 515: 509-513.
[11] ANKLAM E, BERG H, MATHIASSON L, et al. Supercritical fluid extraction (SFE) in food analysis: a review[J]. Food Addit Contam, 1998, 15(6):729-750.
[12] AXEN R, PORATH J, ERNBACK S. Chemical coupling of peptides and proteins to polysaccharides by means of cyanogen halides[J]. Nature, 1967, 214: 1302-1304.
[13] 王建平, 沈建忠. 免疫亲和色谱-GC/MS法检测猪尿中的沙丁胺醇与克伦特罗[J]. 中国兽医杂志, 2007, 43(4): 61-62.
[14] 赵思俊, 郑增忍, 曲志娜, 等. 免疫亲和色谱-HPLC-FLD法测定动物肝脏中10种喹诺酮类药物残留[J]. 分析化学, 2009, 37(3): 335-340.
[15] 苟马玲. 采用化学共沉淀法制备纳米磁流体[J]. 华西医学, 2007, 22 (2): 343-344.
[16] TARTAJ P, SERNA C J. Synthesis of monodisperse superparamagnetic Fe/silica nanospherical composites[J]. J Am Chem Soc, 2003, 125(51): 15754-15755.
[17] RUDI K, KROKEN M, DAHLBERG O J, et al. Rapid, universal method to isolate PCR-ready DNA using magnetic beads[J]. Biotechniques, 1997, 22(3): 506-511.
[18] 谢欣. 基于多功能纳米磁珠的DNA制备与基因分型[J]. 科学通报, 2004, 49(6): 541-543.
[19] GU Hongwei, XU Keming, XU Chenjie, et al. Biofunctional magnetic nanoparticles for protein separation and pathogen detection[J]. Chem Commun (Camb), 2006(9): 941-949.
[20] MATSUNAGA T, KAWASAKI M, YU Xie, et al. Chemiluminescence enzyme immunoassay using bacterial magnetic particles[J]. Analytical Chemistry, 1996, 68(20): 3551-3554.
Preparation of Compound Magnetic Nanoparticle Fe3O4@Si-C8/C18 and Its Application in Purification of Veterinary Drugs
ZHANG Heng1,YANG Cheng-li2,LU Jing-zhang1,TANG Mu-jin1,LIU Qi-song2,WAN Zhi-gang1,XIE Li-qi1,YUE Zhen-feng1,LI Li-su1
(1. Shenzhen Entry-Exit Inspection and Quarantine Bureau, Shenzhen 518045, China;2. Shenzhen Graduate School, Peking University, Shenzhen 518055, China)
In this paper, we first applied compound magnetic nanoparticle Fe3O4@Si-C8/C18 to purify veterinary drugs, and co-precipitation method was employed to synthesize the precursor of magnetic nanoparticles. The surface of nanoparticle precursor was silicified in ethanol and modified with C8 (octyltrimethoxysilane)/C18 (octadecyltrimethoxysilane) to prepare composite magnetic nanoparticle Fe3O4@Si-C8/C18. The compound magnetic nanoparticles were characterized by TEM, X-ray, magnetic performance analysis, and infrared spectroscopy. These compound magnetic nanoparrticles revealed high uniformity with adjustable particle diameters of 100-1000 nm. Therefore, after several layer-by-layer modifications, the compound magnetic nanoparticle revealed the same magnetic intensity as its original precursor. In order to validate their application possibility in the purification of veterinary drugs, purification of chloramphenicol residues in bean sprout was conducted using these magnetic nanoparticles. The results demonstrated that these compound magnetic nanoparticles had extensive application value for the purification and enrichment of micromolecules, especially in the field of food safety.
compound magnetic nanoparticle;C8/C18;purification of veterinary drug
O652.6
A
1002-6630(2012)18-0108-05
2011-07-12
国家质检总局科技计划项目(2009IK154)
张恒(1982—),男,工程师,硕士,研究方向为食品安全快速检测筛选技术。E-mail:yzhangheng@163.com
