固相萃取-高效液相色谱法测定水产品中的苯巴比妥
2012-10-27戴晓欣朱新平吴仕辉马丽莎陈昆慈郑光明潘德博
戴晓欣,朱新平*,吴仕辉,尹 怡,马丽莎,陈昆慈,郑光明,潘德博
(中国水产科学研究院珠江水产研究所,广东 广州 510380)
固相萃取-高效液相色谱法测定水产品中的苯巴比妥
戴晓欣,朱新平*,吴仕辉,尹 怡,马丽莎,陈昆慈,郑光明,潘德博
(中国水产科学研究院珠江水产研究所,广东 广州 510380)
建立水产品中苯巴比妥残留量测定的固相萃取-高效液相色谱方法。样品经乙酸乙酯提取,正己烷脱脂,通过C18固相萃取小柱富集和净化,高效液相色谱仪进行检测。苯巴比妥在0.05~4.0μg/mL内线性范围良好,相关系数为0.9999。当添加量在30~200μg/kg时,加标回收率在80.49%~102.42%,相对标准偏差为1.52%~10.15%,方法检出限10μg/kg,定量限30μg/kg。研究结果表明本方法操作简单、准确度高,能满足水产品中苯巴比妥残留量的测定及确证工作的需要。
固相萃取;高效液相色谱;水产品;苯巴比妥;C18柱
苯巴比妥(phenobarbital),化学名称:5-乙基-5-苯基-2,4,6,(1H,3H,5H)-嘧啶三酮,属于巴比妥类安眠镇静药物,对中枢神经系统的、心血管系统和呼吸系统有明显的抑制作用,过量可麻痹延髓呼吸中枢致死和导致人体出现过敏性反应[1-2]。有研究认为苯巴比妥存在致畸、致癌的毒副作用,现今世界各国均严禁用于食品动物[3-5]。在我国苯巴比妥被用于水产品运输中,被用作促生长饲料添加剂和屠宰时的化学保定剂,兽药临床用作镇静剂,可减少动物营养消耗,有益于增重[6-8]。我国农业部176号公告已经禁止在饲料和动物饮用水中使用。然而,仍有非法使用的情况。巴比妥类药物长期使用具有累积作用,使用不当会使动物体内药物蓄积浓度过高而影响食用者的安全,所以对其残留量进行检测是必要的。
目前对苯巴比妥在药物和血清中的浓度检测的研究较多[9-14],可食性动物组织中苯巴比妥的残留检测方法报道较少,常用的检测方法包括高效毛细管电泳法、气相色谱法、气相色谱-质谱法、高效液相色谱法和酶联免疫吸附测定法[7,9-16]。赵海香等[17]用气相-质谱仪对苯巴比妥在猪肉中的残留进行过检测,而水产品中苯巴比妥残留量的检测未见有报道。在这些方法当中从分析的准确性和操作的普及性来看的话,气相色谱法和液相色谱法是比较适合的;和液相色谱法比较,气相色谱法要对苯巴比妥进行衍生化后才可以上机进行分析,衍生化过程受温度、反应时间等实验条件影响较大,操作较复杂,实验成本较高。
本实验应用固相萃取技术进行前处理的优化,通过高效液相色谱进行检测,拟建立适用于水产品中苯巴比妥残留量的测定方法。
1 材料与方法
1.1 材料与试剂
草鱼、南美白对虾、甲鱼和鳗鲡 广州市购。
苯巴比妥对照品 中国药品生物制品检定所;乙酸乙酯和正己烷均为分析纯试剂;乙腈(色谱纯) 美国Sigma公司;C18固相萃取柱(500mg/3mL) 美国Supelco公司;实验用水为去离子水。
1.2 仪器与设备
1200型高效液相色谱仪(配紫外检测器) 美国Agilent公司;均质机 德国IKA公司;TGL-10B型离心机 上海安亭科技仪器厂;XW-80A型旋涡混合器 海门市麒麟医用仪器厂;RE201D型旋转蒸发仪 郑州合众仪器有限公司;AL204型分析天平 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 色谱条件
色谱柱:Kromasil C18柱(250mm×4.6mm,5μm);流动相:乙腈-水(40:60,V/V);流速:0.9mL/min;柱温:30℃;检测波长:220nm;进样量:20μL。
1.3.2 提取
准确称取5.00g匀浆处理好的肉糜样品于50mL具塞塑料离心管中,加入5mL水,旋涡振荡5min,加入15mL乙酸乙酯,旋涡振荡提取10min,4500r/min离心5min,取上清液于100mL鸡心瓶中。重复再用15mL乙酸乙酯振荡提取一次,4500r/min离心5min,合并上清液到鸡心瓶中。在40℃水浴旋转蒸发至干。
1.3.3 净化
加5.0mL体积分数为10%的乙腈溶液溶解1.3.2节样品,再加入10mL正己烷,旋涡混合1min,静置10min,弃去正己烷层,再加入5mL正己烷重复上述操作一次,乙腈溶液留待过柱备用。
C18柱依次用3mL二氯甲烷、6mL甲醇和6mL水淋洗活化C18柱。转移5mL备用液到柱上,依次用6mL水和6mL体积分数为10%的乙腈溶液淋洗C18小柱,C18小柱用氮气吹干。在不抽真空的情况下用8mL二氯甲烷洗脱,收集洗脱液,于40℃水浴旋转蒸发至近干。
1.3.4 样品测定
将1.3.3节所得样品用流动相定容至1.0mL,经0.45μm有机微孔滤膜过滤后供液相色谱分析,将20μL苯巴比妥系列标准工作液及样品液分别注入于液相色谱仪中,按上述色谱条件进行色谱分析,记录峰面积,响应值均应在仪器检测的线性范围之内。根据标准样品的保留时间定性,外标法定量。
实验设空白对照:除不加试样外,均按上述测定步骤进行。
2 结果与分析
2.1 波长和流动相的确定
利用液相色谱的停泵扫描功能在200~400nm段进行紫外扫描,最大吸收点在220nm附近,因此选定220nm为检测波长。
分别以甲醇-乙腈-水(13:25:62,V/V)和乙腈-水(40:60,V/V)作流动相进行检测;比较两个实验结果,发现用乙腈溶解标准品及用乙腈作流动相进行检测时,峰形好,响应值较高,而且在这个条件下也能够得到良好的分离。故本实验采用乙腈溶解标准品并用乙腈-水(40:60,V/V)做流动相,在选定色谱条件下苯巴比妥的保留时间为6.0min左右。
2.2 提取剂的选择
选用乙酸乙酯、乙腈和甲醇提取样品中的苯巴比妥,对效果进行比较,结果见表1。由于鱼肉的含水量较高,用乙腈和甲醇提取时,会将大量的水和水溶性杂质提取出来,后面旋转蒸发时间长,测定时有干扰,而用乙酸乙酯作提取溶剂,旋转蒸发时间减少近一半,经过比较,乙酸乙酯更适合作为提取剂。

表1 提取溶剂对草鱼中添加苯巴比妥标准液回收的影响Table 1 Effect of solvent type on recovery rate of phenobarbital
2.3 净化条件的确立
文献中一般采取有机溶剂净化[11-13]和固相萃取[17-18]净化,本实验采用两者结合的净化方法。由于水产品中含有较高的脂肪,不把脂肪等杂质去掉,会影响后续分析和净化效果。实验用正己烷进行脱脂净化。为了避免脱脂时有可能出现的乳化现象而影响到回收,通过比较,正己烷的第一次的量为10mL,第二次的量为5mL可以达到实验所需要的净化效果。
由于巴比妥类药物极性较弱,这里使用C18固相萃取小柱。根据苯巴比妥的性质,分别选取体积分数为30%,20%和10%的乙腈溶液作为上样液。以标准溶液进行实验,结果表明当乙腈体积分数为30%和20%的时候,苯巴比妥无法完全被保留在C18萃取柱上,结果表明,10%的乙腈溶液能充分溶解蒸干后的样品,而且目标物可以被保留在C18萃取柱子上。
加标的样品经过提取过柱净化后,实验选用乙腈、甲醇、乙酸乙酯、正己烷:乙酸乙酯(7:3)混合液、叔丁基甲基醚和二氯甲烷作为洗脱剂并进行比较,结果表明,而用二氯甲烷作为洗脱剂,苯巴比妥的色谱峰形尖锐性好,可以达到基质干扰物分离的目的,而其他几种的洗脱剂在把目标物洗脱下来的同时,把杂质也洗下来了,有明显的干扰。乙酸乙酯、叔丁基甲基醚和二氯甲烷做洗脱剂时得到的结果的色谱图见图1。
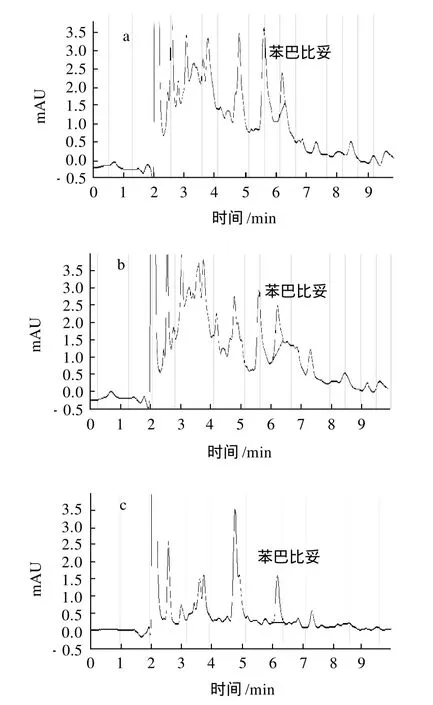
图1 3种不同洗脱剂的加标样品液相色谱图Fig.1 Chromatograms of spiked samples eluted with ethyl acetate, methyl tert-butyl ether or dichlormethane
质量浓度0.50μg/mL苯巴比妥的标准、草鱼样品(阴性样品)和草鱼样品中添加100μg/kg苯巴比妥加标样品的色谱图见图2,与标准图谱比较可以看出样品经过处理后,净化效果理想,目标物和基质干扰物达到了良好的分离而没有影响分析。
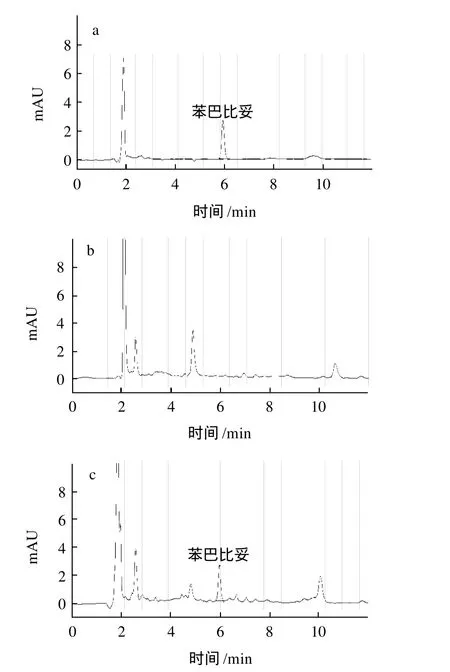
图2 苯巴比妥标准溶液(0.50μg/mL)(a)、阴性样品(b)和加标样品(100μg/kg)(c)色谱图Fig.2 Chromatograms of standard sample (a), blank sample (b) and spiked sample (c)
2.4 线性范围
准确称取经105℃干燥2h至质量恒定的苯巴比妥用乙腈溶解并定容,保存于2~8℃冰箱中。准确量取分别以0.05、0.10、0.20、0.60、1.00、2.00、4.00μg/mL苯巴比妥标准溶液进样,再用流动相稀释成一系列浓度的工作液,以HPLC测得的峰面积为纵坐标,相应质量浓度为横坐标,经过拟合,得出线性方程:y=42.76x+0.9038,R2=0.9999,结果表明在0.05~4.0μg/mL范围内均呈良好的线性关系。
2.5 回收率、精密度和检测限
在草鱼、南美白对虾、甲鱼和鳗鲡阴性肌肉组织样品中分别添加3个添加量水平的苯巴比妥标准溶液,分别为30、100μg/kg和200μg/kg,每个添加量做6个平行,每个平行设一个空白对照,按样品前处理过程处理后测定回收率。另取草鱼肌肉样品,分别添加3个水平的苯巴比妥标准溶液:30、100μg/kg和200μg/kg,每个浓度分别在1d内平行测定5次,1周内平行测定5次,计算日内及日间精密度。测定结果见表2。由表2可以看出,苯巴比妥加标浓度在30~200μg/kg内,回收率为80.49%~102.42%。
实测日内及日间精密度见表3,为3.26%~10.15%,方法的准确度和精密度均符合残留分析要求。
以信噪比RSN=3计算,该方法对水产品中苯巴比妥的检出限为10μg/kg。以3倍检出限确定定量限,为30μg/kg。

表2 样品加标回收率及RSD(n=6)Table 2 Recovery rates and RSDs for phenobarbital determination in spiked samples (n=6)
表3 日内与日间精密度 (±s,n=5)Table 3 Intra-day and inter-day precision for phenobarbital determination in spiked samples (±s,n=5)
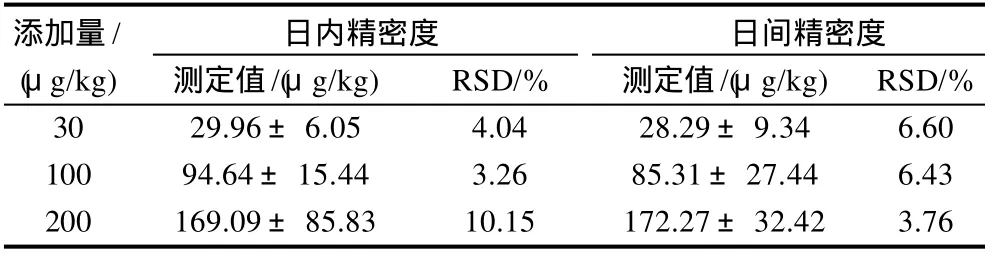
表3 日内与日间精密度 (±s,n=5)Table 3 Intra-day and inter-day precision for phenobarbital determination in spiked samples (±s,n=5)
添加量/ 日内精密度 日间精密度(μg/kg) 测定值/(μg/kg) RSD/% 测定值/(μg/kg) RSD/% 30 29.96±6.05 4.04 28.29±9.34 6.60 100 94.64±15.44 3.26 85.31±27.44 6.43 200 169.09±85.83 10.15 172.27±32.42 3.76
2.6 实际样品测定
利用上述方法对从广州市场购买的草鱼、对虾、甲鱼和鳗鱼样品进行提取和净化,高效液相色谱定量分析,均未发现呈阳性。
3 结 论
本实验建立的分析方法可以测定水产品中苯巴比妥的残留量,操作简便,结果准确,可用于大部分的水产品的检测,适用范围较广。当前水产品质量形势日渐严峻,本方法可以为水产品质量安全的研究提供参考。
[1] 巩玉梅, 徐存军. 苯巴比妥钠致过敏性休克1例[J]. 医药导报, 2006, 25(8): 802.
[2] 林秀萍, 陈彩华, 刘郡凌. 苯巴比妥钠过敏致全身剥脱性皮疹1例[J].中国误诊学杂志, 2006, 6(1): 192-193.
[3] SINGH G, DRIEVE P R, SANDER J W. Cancer risk in people with epilepsy: the role of antiepileptic drugs[J]. Brain, 2005, 128(1): 7-17.
[4] PATRICK K, BRODIE M J. Phenobarbital for the treatment of epilepsy in the 21st century: a critical review[J]. Epilepsia, 2004, 45(9): 1141-1149.
[5] HOLMES L B, HARVEY E A, COULL B A, et al. The teratogenicity of anti-convulsant drugs[J]. N Engl J Med, 2001, 344(15): 1132-1138.
[6] 张海棠, 王自良, 王艳荣. 苯巴比妥在动物生产中的非法使用及毒性作用[J]. 山西农业科学, 2008, 36(4): 29-31.
[7] 张海棠, 王艳荣, 崔艳红, 等. 苯巴比妥的毒副作用及其残留检测[J].中国饲料, 2006(9): 36-38.
[8] 陈鹏. 苯巴比妥对草鱼、鲢鱼苗运输成活率的影响[J]. 渔业致富指南, 2008(3): 55-57.
[9] 林伟萍, 丁汀, 周慧萍, 等. 反相高效液相色谱法同时测定人血清苯巴比妥与卡马西平浓度[J]. 医药导报, 2007, 26(5): 489-490.
[10] 陈蓉. HPLC法测定痫速停胶囊中苯妥英钠和苯巴比妥含量[J]. 中国药师, 2004, 7(8): 617-618.
[11] 陈方亮, 程亚军. 丁丁. 反相高效液相色谱外标法测定苯巴比妥与卡马西平的血药浓度[J]. 中国药业, 2006, 15(1): 65-66.
[12] 叶可人. 高效液相色谱法测定血清中卡马西平、苯妥英钠、苯巴比妥血药浓度[J]. 海南医学, 2004, 15(12): 125.
[13] 杨洁, 焦正, 施孝金. 高效液相色谱法同时测定人血浆中6种抗癫痫药物及两种活性代谢物的浓度[J]. 中国药学杂志, 2006, 41(24): 1899-1902.
[14] 丁玉峰, 万波, 贺国芳, 等. 高效液相色谱法测定勃氏合剂中苯巴比妥钠和咖啡因含量[J]. 中国医院药学杂志, 2005, 25(7): 676-677.
[15] 王自良, 王建华, 杨艳艳, 等. 苯巴比妥残留快速检测阻断ELISA试剂盒的研制及性能测定[J]. 中国兽医杂志, 2006, 42(4): 62-64.
[16] 李桂平, 张海棠, 王自良. 动物性食品中苯巴比妥残留检测研究进展[J]. 山西农业科学, 2007, 35(12): 3-6.
[17] 赵海香, 邱月明, 汪丽萍, 等. 气相色谱-质谱同时测定猪肉中3种巴比妥药物残留[J]. 分析化学研究报告, 2005, 33(6): 777-780.
[18] 沈晓洁, 戴月华. SPE-HPLC法测定血清中苯巴比妥苯妥英钠和卡马西平浓度[J]. 江苏药学与临床研究, 2005, 13(1): 23-24.
Determination of Phenobarbital Residues in Fishery Products by SPE-HPLC
DAI Xiao-xin,ZHU Xin-ping*,WU Shi-hui,YIN Yi,MA Li-sha,CHEN Kun-ci,ZHENG Guang-ming,PAN De-bo
(Pearl River Fishery Research Institute, Chiese Academic of Fishery Sciences, Guangzhou 510380, China)
A solid phase extraction (SPE) coupled with high performance liquid chromatography (HPLC) method has been developed for the determination of phenobarbital residues in fishery products. Samples were extracted with ethyl acetate, defatted withn-hexane, and cleaned up on a C18 solid phase extraction cartridge before HPLC analysis. Over the concentration range of 0.05-4.0 μ g/mL, a good linear response was observed for the fitted calibration curve of phenobarbital, with a coefficient of correlation of 0.9999. The average recovery rate of phenobarbital in four types of aquatic products varied from 80.49%-102.42% with relative standard deviation (RSD) of 1.52%-10.15%. The detection limit and quantification limit of this method was 10 μg/kg and 30 μ g/kg, respectively. This method was simple and accurate and could meet the requirements for the determination and confirmation of phenobarbital residues in fishery products.
solid phase extraction;high performance liquid chromatography;fishery productsl;phenobarbital;C18 column
TS207.3
A
1002-6630(2012)18-0232-04
2011-07-12
2008渔业应急项目
戴晓欣(1982—),女,研究实习员,学士,主要从事水产品质量安全研究。E-mail:wulihapa@163.com
*通信作者:朱新平(1964—),男,研究员,博士,主要从事水产种质资源与遗传育种研究。E-mail:zhuxinping_1964@yahoo.com.cn
