3种乳源酪蛋白粒径及胶束结构的差异性
2012-10-25李子超王丽娜李昀锴徐明芳
李子超,王丽娜,李昀锴,徐明芳*
(暨南大学生命科学技术学院,广东 广州 510632)
3种乳源酪蛋白粒径及胶束结构的差异性
李子超,王丽娜,李昀锴,徐明芳*
(暨南大学生命科学技术学院,广东 广州 510632)
通过纳米粒度分析仪和扫描电子显微镜,分别对水牛乳、牛乳及羊乳中的酪蛋白颗粒直径大小分布情况及酪蛋白胶束结构进行研究。结果表明:水牛乳、牛乳及羊乳中酪蛋白的粒径分布及胶束结构方面存在明显的差异。水牛乳酪蛋白平均颗粒直径为182.3nm,酪蛋白颗粒互相连接成较细长的胶束,胶束之间交联成网络状;牛乳酪蛋白平均颗粒直径为207.4nm,酪蛋白颗粒聚集成直径较大的胶束;羊乳酪蛋白平均颗粒直径为173.8nm,酪蛋白颗粒仅能够形成较短的胶束,也不能交联成网络状。
纳米粒度分析仪;扫描电子显微镜;酪蛋白;粒径;胶束结构
乳品中的蛋白主要包括酪蛋白和乳清蛋白两大类,酪蛋白是乳品中特有的一组含有大量磷和钙的蛋白,不溶于水,通常以聚集体的形式存在,约占乳品总蛋白含量的80%,是乳品中重要的蛋白组分,主要由αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白4种蛋白组成[1-2]。乳清蛋白易溶于水,含量约占乳品总蛋白含量的20%,主要包括α-乳清蛋白、β-乳球蛋白、牛血清蛋白、免疫球蛋白。
乳源酪蛋白具有表面活性,但不同于其他小分子表面活性剂具有极性头部和非极性尾部,它由不同的疏水性氨基酸为主的不带电区域及亲水性氨基酸主导的带电区域组成。与其他表面活性分子一样,在浓度高于其临界浓度条件时,酪蛋白自发聚集成以疏水区域为核心,亲水部分及其他亲水性乳清蛋白包裹在表面的颗粒[2]。
乳品中的酪蛋白自发聚集成更大的胶体凝聚状态,称为酪蛋白聚集体。在高尔基体中,单体的酪蛋白通过与磷和钙的结合,屏蔽酪蛋白本身所具有的电荷并使之聚集成为更大颗粒状态[3-5]。有研究表明,牛乳中的酪蛋白颗粒大小不一,其直径的分布范围约为80~500nm,平均大小约为200nm[6]。酪蛋白中磷酸化的丝氨酸残基能够结合磷酸钙,在酪蛋白聚集体内部形成不同大小的聚集区[7-8]。X射线和中子散射证明,酪蛋白聚集体内部的磷酸钙聚集导致酪蛋白聚集体散射不均一[9-10]。酪蛋白颗粒之间可以互相连接,成为胶束。国外最新研究报道,用透射电子显微镜发现了牛乳中的酪蛋白胶束[11-12]。酪蛋白胶束稳定性很高,即使在煮沸的条件下仍能够保持胶束状态。
乳品业作为朝阳产业,是国家重点扶持产业,国家在政策、资金等方面给予有力支持。农业部明确提出“要突出发展乳品生产”。国家农业部制定的《全国奶业“十一五”战略发展规划和2020年远景目标规划》等一系列重大政策的出台都为乳品的开发创造了有利的宏观环境[13]。
2007年,我国人均乳品消费量为28kg,与发达国家和世界平均水平相比,消费水平依然很低[14]。随着人们收入水平的提高及健康意识的增强,我国乳品消费量出现大幅度的增长。但长期以来,我国对乳品的基础研究不足,尤其对水牛乳、羊乳等新兴乳品研究更加匮乏。酪蛋白作为乳品中的主要蛋白成分,也是食品加工中最主要的原料成分。对酪蛋白的研究,不仅是指定乳品加工工艺参数的基础,而且也是畜牧业中和评定乳品营养价值的必要指标,因此对酪蛋白的研究具有很高的研究和应用价值。
在生物样品的超微结构的观测方面,扫描电子显微镜等电子显微镜技术,具有其他物理、化学方法不可比拟的结果直观性好的巨大优势,甚至可以用来观测蛋白质等生物大分子的二维排列,解释纳米尺度的结构细节[15]。本研究的主要目的就是分别通过纳米粒度分析仪和扫描电子显微镜成像技术分别对水牛乳、牛乳及羊乳中酪蛋白的颗粒直径分布情况及胶束结构形态进行研究,解释种属差异对乳源蛋白的聚集及酪蛋白胶束结构的影响,为乳制品的研制开发提供实验依据。
1 材料与方法
1.1 材料与仪器
水牛乳 广州百富露公司;牛乳 广州燕塘公司;羊乳 香港味羊公司;醋酸异戊酯 暨南大学分析测试中心。
CP224C电子天平 奥豪斯仪器有限公司;TDL-5-A台式离心机 上海安亭科学仪器厂;PHS-3C pH计 上海雷磁仪器厂;Zetasizer Nano ZS纳米粒度分析仪 英国Malvern公司;XL-30扫描电子显微镜 荷兰Philips公司。
1.2 方法
1.2.1 酪蛋白溶液的制备
取100mL乳品在4℃、4000r/min条件下离心30min,脱脂处理。弃上层脂肪,取下层蛋白溶液,稀释至质量浓度为80μg/mL的稀释液。作为粒径分析样品或进一步进行扫描电子显微镜样品处理,进行扫描电子显微镜观察。
1.2.2 纳米粒度仪分析的方法
将样品用0.02mol/L 磷酸钠盐缓冲溶液(pH6.8)溶解。溶液配制完成后,离心取上清液,用纳米粒度仪测定溶液的粒径分布。测定前先将样品摇匀。样品重复测量3次,最后取平均值。
1.2.3 扫描电子显微镜样品处理方法
取5μL酪蛋白样品,滴在洁净的盖玻片上,于自然条件下干燥;自然干燥后,在盖玻片样品上滴加50μL戊二醛,在4℃条件下固定3h;用浓度为0.1mol/L的磷酸缓冲液清洗3次,每次5min,分别用体积分数50%、70%、90%和100%的乙醇进行脱水,每次5min;用醋酸异戊酯对乙醇进行置换,每次5min,共3次;CO2临界点干燥后进行电镜观察。
2 结果与分析
2.1 水牛乳酪蛋白的纳米粒径分布及胶束结构
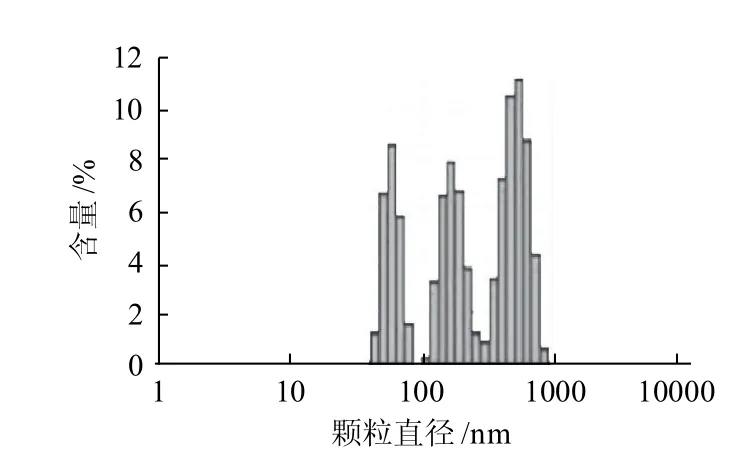
图1 水牛乳酪蛋白纳米粒径分布图Fig.1 Size distribution of casein from buffalo milk
由图1可知,水牛乳酪蛋白直径大小分布于43.8~825.0nm之间,主要包括43.8~78.8nm、105.7~255.0nm、342.0~825.0nm 3种不同颗粒直径的组分,平均颗粒直径为182.3nm。其中,以458.7~531.2nm之间的酪蛋白颗粒含量最多,占水牛乳酪蛋白总量的21.7%,而最大的酪蛋白颗粒直径为825.0nm,含量占水牛乳酪蛋白的0.6%。

图2 水牛乳酪蛋白胶束结构扫描电子显微镜图像(×40000)Fig.2 SEM image of the structure of casein micelle from buffalo milk (×40000)
由图2可知,水牛乳中的酪蛋白颗粒互相连接成直径较小的胶束状,这些胶束多由单个的酪蛋白颗粒连接而成,直径与单个酪蛋白的颗粒相差不大,约为180nm左右,而且这些胶束之间互相连接,形成较为致密的网络状结构。
2.2 牛乳酪蛋白的纳米粒径分布及胶束结构

图3 牛乳酪蛋白纳米粒径分布图Fig.3 Size distribution of casein from milk
由图3可知,牛乳酪蛋白直径大小分布于43.8~615.1nm之间,主要包括43.8~190.1nm、295.3~615.1nm两种不同颗粒直径的组分,平均颗粒直径达到207.4nm,大于水牛乳酪蛋白的平均颗粒直径。其中,以396.1~531.2nm之间的酪蛋白颗粒最多,占牛乳酪蛋白总量的33.8%。最小的酪蛋白颗粒,直径与牛乳的相同,均为43.8nm;而最大的酪蛋白颗粒直径为615.1nm,明显小于水牛乳酪蛋白的最大颗粒直径,含量占牛乳酪蛋白的3.6%。

图4 牛乳酪蛋白胶束结构扫描电子显微镜图像(×40000)Fig.4 SEM image of the structure of casein micelle from milk (×40000)
由图4可知,牛乳中的酪蛋白颗粒聚集程度较高,大量的酪蛋白颗粒聚集成的酪蛋白胶束结构比水牛乳中的酪蛋白胶束结构更粗大,其直径大小不均匀,约在300~600nm之间。而且这些酪蛋白之间交联程度很低,无法形成较为致密的网络状结构。
2.3 羊乳酪蛋白的纳米粒径分布及胶束结构

图5 羊乳酪蛋白纳米粒径分布图Fig.5 Size distribution of casein from goat milk
由图5可知,羊乳酪蛋白直径大小分布于91.3~1381.0nm之间,主要包括91.3~255.0nm、458.7~1381.0nm两种不同颗粒直径的组分,平均颗粒直径为173.8nm,要小于水牛乳和牛乳的酪蛋白平均颗粒直径。其中,以122.4~190.1nm之间的酪蛋白颗粒最多,占羊乳酪蛋白总量的59.0%。最小的酪蛋白颗粒直径为91.3nm,明显大于水牛乳和牛乳中的最小酪蛋白颗粒,其含量占羊乳酪蛋白的0.5%;最大的酪蛋白颗粒直径为1381.0nm,也要明显大于水牛乳和牛乳中的最大酪蛋白颗粒,其含量占羊乳酪蛋白的0.1%。

图6 羊乳酪蛋白胶束结构扫描电子显微镜图像(×40000)Fig.6 SEM image of the structure of casein micelle from goat milk (×40000)
由图6可知,大量表面光滑的酪蛋白颗粒,这些酪蛋白颗粒聚集程度远低于水牛乳和牛乳,仅能由数个酪蛋白颗粒连接形成较短的酪蛋白胶束结构,其直径也约为一个酪蛋白颗粒的直径。由于这些酪蛋白胶束非常短,所以无法交联成网络状结构。
3 结 论
通过纳米粒度分析仪和扫描电子显微镜,对水牛乳、牛乳及羊乳中的酪蛋白颗粒直径分布情况及其所形成的胶束结构状态进行了比较全面、直观的研究。首先对水牛乳、羊乳中酪蛋白颗粒直径分布情况及其所形成的胶束结构进行研究,并发现了其与普通牛乳之间的差异性。研究表明,水牛乳、牛乳及羊乳中酪蛋白的粒径分布及胶束结构方面存在明显的差异:在酪蛋白颗粒直径方面,羊乳(173.8nm)<水牛乳(182.3nm) <牛乳(207.4nm);在胶束结构方面,水牛乳酪蛋白颗粒互相连接成较细长的胶束,胶束之间能交联成网络状结构,牛乳酪蛋白颗粒聚集程度最高,能行成直径较大的胶束,但是无法交联成网络状结构;羊乳酪蛋白颗粒聚集程度最低,仅能够形成较短的胶束,也不能交联成网络。
水牛乳、牛乳及羊乳的酪蛋白在粒径大小及胶束致密程度方面的差异,反映了他们聚集程度的差异性,聚集程度的差异在宏观上就表现为乳凝块的大小,而乳凝块大小直接影响到它们在人体的消化吸收。有研究表明,相对于市场中较多的牛乳,羊乳在胃中所形成的乳凝块较细,更容易消化吸收[16],这与本研究的结果一致。本研究得到的关于水牛乳、牛乳及羊乳的粒径大小及胶束致密程度的差异,反映了它们聚集程度的高低,可以直观性地解释不同乳品之间形成的乳凝块大小及其对消化吸收的差异。
[1] FARRELL H M, JIMENEZ F. Nomenclature of the proteins of cow,s milk: sixth revision[J]. Journal of Dairy Science, 2004, 87: 1641-1674.
[2] MOITZI C, PORTNAYA I, GLATTER O, et al. Effect of temperature on self-assembly of bovineβ-casein above and below isoelectric pH. Structural analysis by cryogenic-transmission electron microscopy and small-angle X-ray scattering[J]. Langmuir, 2008, 24: 3020-3029.
[3] HUPPERTZ T, FOX P F, DEKRUIF K G, et al. High pressure-induced changes in bovine milk proteins: a review[J]. Biochimica Biophysica Acta, Proteins Proteomics, 2006, 3: 593-598.
[4] FARRELL H M J, MALIN E L. Casein micelle structure: what can be learned from milk synthesis and structural biology?[J]. Current Opinion in Colloid and Interface Science, 2006, 11(2/3): 135-147.
[5] HORNE D S. Casein micelle structure: models and muddles[J]. Current Opinion in Colloid and Interface Science, 2006, 11(2/3): 148-153.
[6] de KRUIF C G. Supra-aggregates of casein micelles as a prelude to coagulation[J]. Journal of Dairy Science, 1998, 81: 3019-3028.
[7] HOLT C. An equilibrium thermodynamic model of the sequestration of calcium phosphate by casein micelles and its application to the calculation of the partition of salts in milk[J]. European Biophysics Journal, 2004, 33: 421-434.
[8] HOLT C, TIMMINS P A, ERRINGTON N, et al. A core-shell model of calcium phosphate nanoclusters stabilized byβ-casein phosphopeptides, derived from sedimentation equilibrium and small-angle X-ray and neutronscattering measurements[J]. European Journal of Biochemistry, 1998, 252: 73-78.
[9] HOLT C, de KRUIF C G, TUINIER R, et al. Substructure of bovine casein micelles by small-angle X-ray and neutron scattering[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2003, 213: 275-284.
[10] MARCHIN S, PUTAUX J L, PIGNON F, et al. Effects of the environmental factors on the casein micelle structure studied by cryo-transmission electron microscopy and small-angle X-ray scattering/ultrasmallangle X-ray scattering[J]. Journal of Chemical Physics, 2007, 126, 045101: 10pages.
[11] MARCHIN G J O, WILIAMS R P W. Comparison of casein micelles in raw and reconstituted skim milk[J]. Journal of Dairy Science, 2007, 90: 4543-4551.
[12] MCMAHON D J, OOMMEN B S. Supra molecular structure of the casein micelle[J]. Journal of Dairy Science, 2008, 91: 1709-1721.
[13] 徐定人. 大力发展水牛奶加速我国奶业发展[J]. 中国乳业, 2002(1): 6-8.
[14] 王雷, 丁春华, 栾爽艳. 我国水牛奶的发展现状与开发前景[J]. 发展论坛, 2008(4): 8-11.
[15] BINNING G, QUATE C F, GERBER C. Atomic force microscope[J]. Phys Rev Lett, 1986, 56(4): 930-933.
[16] 邵国锋, 兰毅楠, 曲晟, 等. 羊奶与牛奶比较有何优缺点[J]. 农家之友, 2009(6): 75.
Differences in Particle Size and Structure of Casein Micelle from Different Milk Sources
LI Zi-chao,WANG Li-na,LI Yun-kai,XU Ming-fang*
(College of Life Science and Technology, Jinan University, Guangzhou 510632, China)
The particle distribution of casein and the structure of casein micelle from milk, buffalo milk and goat milk were studied by nanoparticle size analyzer and scanning electron microscopy, respectively. The results suggested that the size distribution of casein and the structure of casein micelle from milk, buffalo milk and goat milk were significantly different. The average casein particle diameter from buffalo milk was 182.3 nm. The connected casein particles formed slender micelles, and the micelles crosslinked into a network structure. The average casein particle diameter from milk was 207.4 nm, and the connected casein particles formed thick micelles. The average casein particle diameter from goat milk was 173.8 nm, and the connected casein particles formed short casein micelles but the micelles can not be cross-linked into a network structure.
nanoparticle size analyzer;scanning electron microscopy;casein;size;micelle structure
TS252.1
A
1002-6630(2012)05-0058-04
2011-02-23
广东省科技计划项目(2009B011300003)
李子超(1985—),男,硕士研究生,主要从事应用微生物及微生物工程研究。E-mail:juvne@163.com
*通信作者:徐明芳(1962—),女,教授,博士,主要从事南方水牛乳的开发及应用研究。E-mail:txmfxmf2006@126.com
