高效液相色谱串联质谱法测定蔬果中啶酰菌胺和环酰菌胺残留
2012-10-25郭庆龙崔淑华林黎明钱家亮许美玲吴淑秀
郭庆龙,崔淑华*,段 浩,林黎明,钱家亮,许美玲,吴淑秀
(1.黄岛出入境检验检疫局,山东 青岛 266555;2.临沂出入境检验检疫局检验检疫技术中心,山东 临沂 276034;3.山东省检验检疫科学技术研究院,山东 青岛 266002)
高效液相色谱串联质谱法测定蔬果中啶酰菌胺和环酰菌胺残留
郭庆龙1,崔淑华2,*,段 浩2,林黎明3,钱家亮2,许美玲2,吴淑秀2
(1.黄岛出入境检验检疫局,山东 青岛 266555;2.临沂出入境检验检疫局检验检疫技术中心,山东 临沂 276034;3.山东省检验检疫科学技术研究院,山东 青岛 266002)
建立蔬菜和水果中啶酰菌胺和环酰菌胺的高效液相色谱串联质谱检测方法。将试样中残留的啶酰菌胺和环酰菌胺用含1%乙酸的乙腈溶液均质提取,提取液混合使用乙二胺-N-丙基硅烷和十八烷基硅烷键合相基质分散净化,用高效液相色谱串联质谱检测和确证,外标法定量;方法通过空白基质溶液稀释标准建立校正的标准曲线,以消除基质效应。结果表明:啶酰菌胺和环酰菌胺在1~100μg/L范围内具有良好的线性关系,相关系数分别为0.9996和0.9997;在5~50μg/kg范围内,平均添加回收率在77.7%~93.8%之间,相对标准偏差在2.1%~6.3%之间。啶酰菌胺和环酰菌胺方法定量限分别为1.32μg/kg和1.20μg/kg,检出限分别为0.395μg/kg和0.361μg/kg。
液相色谱串联质谱;啶酰菌胺;环酰菌胺;蔬菜;水果
啶酰菌胺(boscalid)和环酰菌胺(fenhexamid)是新型酰胺类内吸性杀菌剂,这两种杀菌剂对防治灰霉病、菌核病和各种腐烂病等病害非常有效,并且对其他药剂的抗性菌亦有效,主要用于包括蔬菜、果树和大田作物等病害的防治。由于其特有的作用机理不易产生交互抗性,加之对作物安全、与环境相容性良好,是应用前景很好的两种新型酰胺类杀菌剂[1-6]。基于安全考虑,CAC、欧盟和日本等国家规定规定啶酰菌胺和环酰菌胺在各类食品中最高残留限量在ND~40mg/kg和0.02~30mg/kg之间[7-9]。国内外对该化合物残留检测方法的报道较少[10-18],而且国内残留分析前处理方法较繁琐。因此,研究食品中啶酰菌胺和环酰菌胺快速准确的分析方法极为迫切和必要。本研究参照QuEChERS前处理技术的分散固相萃取技术[19-20],采用混合吸附剂净化,拟建立高效液相色谱串联质谱(high-performance liquid chromatography-mass spectrometry/mass spectrometry,HPLC-MS/MS)测定蔬菜和水果中啶酰菌胺和环酰菌胺的检测方法。
1 材料与方法
1.1 材料与试剂
4种基质(草莓、葡萄、黄瓜、大葱) 市售。
乙腈、甲醇、乙酸(均为色谱纯) 德国Merke公司;氯化钠、无水硫酸镁(分析纯,用前在450℃烘5h,200℃时取出至于干燥器内备用) 国药集团化学试剂有限公司;Cleanert PSA净化剂(40~60μm)、Cleanert ODS C18-N(未封端)净化剂(40~60μm)、Cleanert Pesti Carb 净化剂(120~400μm) 天津博纳艾杰尔科技有限公司;啶酰菌胺(纯度≥99.5%)、环酰菌胺标准品(纯度≥99.5%)德国Dr Ehrenstorfer GmbH公司。
1.2 仪器与设备
1200快速液相色谱仪-6410Triple Quad质谱/质谱联用仪 美国Agilent公司;5810R型离心机德国Eppendorf公司;ULTRA-TURRAX T-18 basic型均质器、MS3基本型旋涡混合器 德国IKA公司;MilliQ超纯水器 美国Millipore公司。
1.3 方法
1.3.1 标准溶液配制
标准储备溶液:分别准确称取啶酰菌胺和环酰菌胺标准品12.56mg置于50mL小烧杯中,用乙腈溶解后转移至25mL容量瓶中,然后多次洗涤小烧杯并将其转移至容量瓶中,最后用乙腈定容至刻度,分别配成500μg/mL标准储备溶液。
标准中间溶液:准确吸取啶酰菌胺和环酰菌胺标准储备溶液1mL于50mL棕色容量瓶中,用含1%乙酸的乙腈溶液定容至刻度,配成10μg/mL啶酰菌胺和环酰菌胺混合标准中间液。然后准确吸取1mL 10μg/mL标准中间溶液于10mL容量瓶中,用含1%乙酸的乙腈溶液定容,配成1.0μg/mL标准中间溶液。
标准工作溶液:根据需要使用前用空白样品基质溶液稀释标准中间溶液,配制成适当质量浓度的标准工作溶液。
1.3.2 测定条件
1.3.2.1 色谱条件
色谱柱:ZORBAX SB-C18(2.1mm×100mm,1.8μm);流动相:甲醇-5mmol乙酸铵溶液(pH3.5)(75:25,V/V);流速:0.2mL/min;进样体积:5μL;柱温:30℃。
1.3.2.2 质谱条件
离子源:电喷雾离子源(electrospray ionization,ESI);扫描方式:正离子扫描;检测方式:多反应监测(multi-reaction monitoring,MRM);雾化器压力:40psi;干燥气温度:350℃;干燥气流速:9.0mL/min;毛细管电压:3500V;监测离子对、毛细管出口电压/碎裂电压和碰撞能量等质谱采集参数见表1。
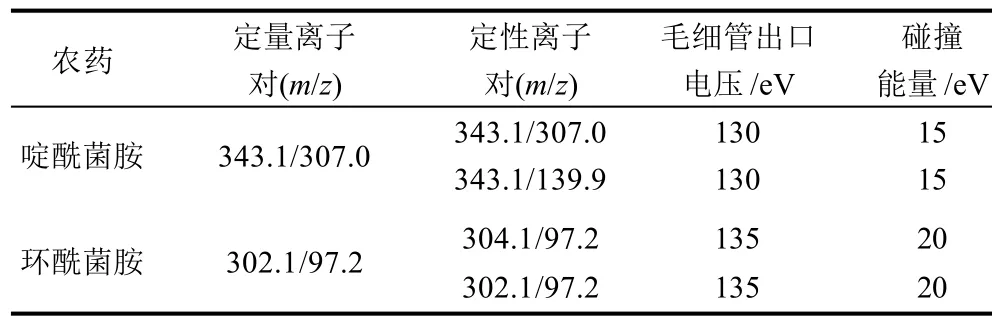
表1 啶酰菌胺和环酰菌胺质谱采集参数Table 1 Instrumental parameter setting for MS-MS detection of boscalid and fenhexamid
1.3.3 样品前处理
称取5g(精确至0.01g)均匀样品置于50mL离心管中,准确加入10mL含1%乙酸的乙腈溶液,2.0g无水硫酸镁,1.0g氯化钠,均质提取。以5000r/min离心5min。吸取2.0mL上层有机相转移至装有100mg Cleanert ODS C18-N、50mg Cleanert PSA粉末的离心管中,涡旋2min,5000r/min离心5min。取上清液过0.22μm滤膜后,供液相色谱-质谱/质谱仪测定。
2 结果与分析
2.1 流动相的选择
以乙腈-0.1%甲酸溶液和乙腈-5mmol乙酸铵溶液作为流动相时,调整流动相比例均不能将啶酰菌胺和环酰菌胺进行分离。以甲醇-5mmol乙酸铵(75:25,V/V)做流动相等度洗脱即可实现这两种化合物的有效分离,色谱峰对称尖锐,峰形良好。
2.2 质谱条件优化
采用1mg/L的待测化合物的标准溶液以流动注射的方式分别用ESI正离子和负离子模式进行全扫描,发现这两种农药在ESI+模式下的响应值均大大高于在ESI-模式下的响应值,因此选择采用ESI+电离模式。本研究正离子模式全扫描发现啶酰菌胺(分子式为C18H12Cl2N2O)和环酰菌胺(分子式为C14H17Cl2NO2)存在很明显的同位素分子离子峰,分别为343.1、345.1和302.1和304.1。采用0.1mg/L啶酰菌胺和环酰菌胺的标准溶液分别对毛细管出口电压进行优化,从中选出丰度最高的毛细管出口电压作为最佳毛细管出口电压。然后分别对不同母离子产生的子离子及碰撞能力进行优化,从中选出丰度最高的碰撞能量作为最佳碰撞能力,选择两个丰度比较高的子离子作为定性和定量离子,建立多离子反应监测模式,啶酰菌胺和环酰菌胺的质谱采集参数见表1,啶酰菌胺和环酰菌胺标准品多反应监测色谱图见图1。
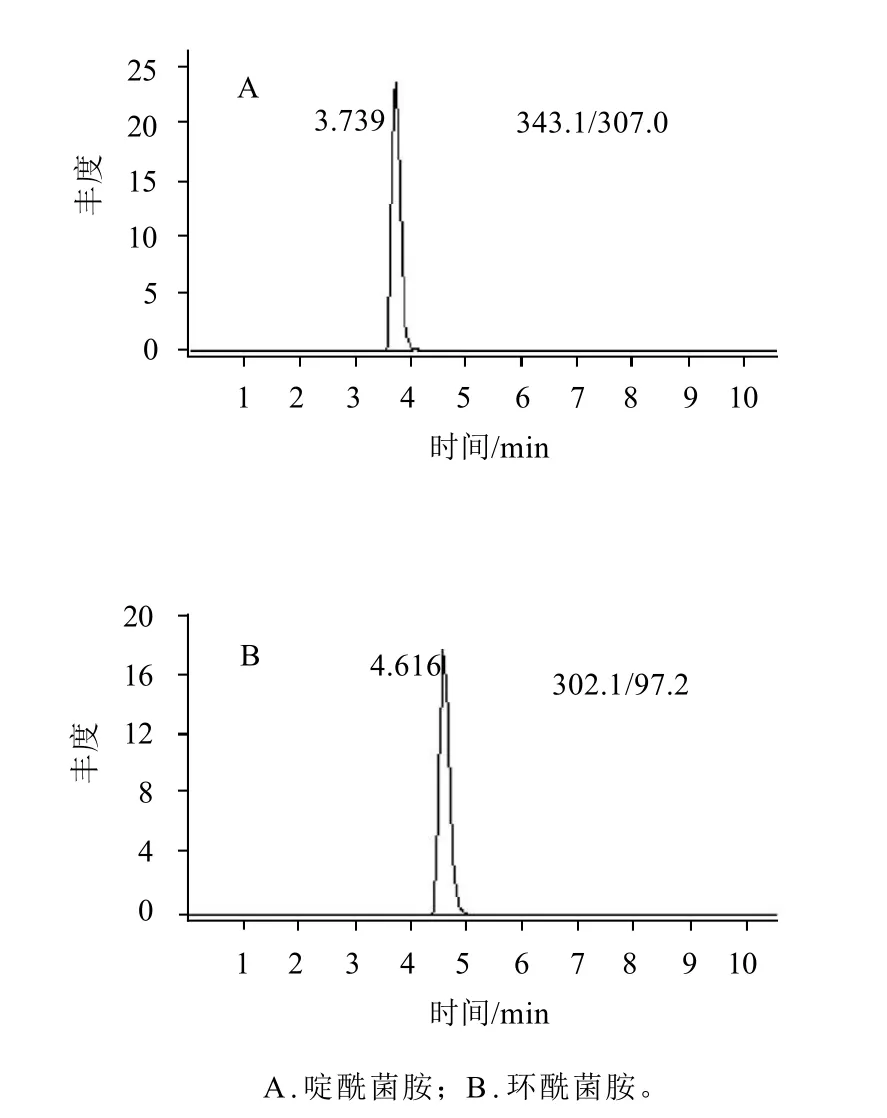
图1 0.01μg/mL标准溶液M R M色谱图Fig.1 HPLC chromatograms of 0.01μg/mL boscalid and fenhexamid standard
2.3 样品基质效应的消除
电喷雾离子源容易受样品基质的影响。样品基质对离子化有抑制作用,草莓、葡萄对农药离子化影响较弱,黄瓜、大葱对农药离子化影响较强。为消除样品基质效应,应以空白样品提取液作为标准溶液的稀释溶液,这样可使标样和样品溶液具有同样的离子化条件,从而消除样品基质效应。
2.4 提取条件的选择
比较乙腈和乙酸乙酯的提取效果,发现采用乙酸乙酯作为提取液时,会提取出更多的色素,对化合物离子化抑制更强。同时,采用乙腈提取时,具有可利用盐析效应去除水分,提取样品时不需加入大量无水硫酸钠或无水硫酸镁等优势。另外发现,对乙腈提取液使用Cleanert PSA净化剂基质固相分散净化时,其对环酰菌胺产生强吸附作用,将含1%乙酸的乙腈溶液作为提取液则吸附作用消失,因此,选择使用含1%乙酸的乙腈溶液作为提取溶剂。
2.5 净化条件的选择
基质分散净化常用的净化剂有乙二胺-N-丙基硅烷(primary secondary amine,PSA)、十八烷基硅烷键合相(C18)、石墨化炭(Pesti Carb)和氨基(NH2)。PSA去除脂肪酸效果较好,在去除色素、甾醇和维生素方面效果一般,而C18和Pesti Carb去除维生素、色素、甾醇的能力较好,NH2与PSA净化范围一致,但离子交换能力较PSA弱。净化剂在去除杂质的同时也可能对目标化合物产生吸附,将2mL 0.01μg/mL啶酰菌胺和环酰菌胺混合标液分别经不同质量的Cleanert ODS C18-N(未封端)、Cleanert PSA和Cleanert Pesti Carb涡旋净化,处理后的回收率数据见表2。
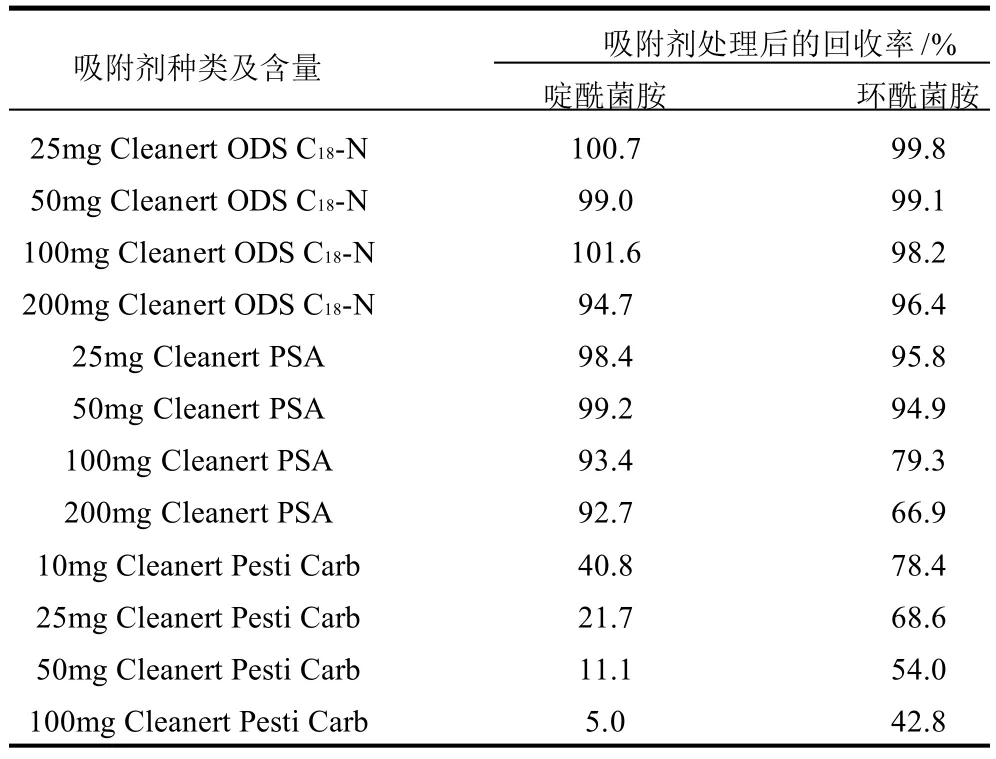
表2 啶酰菌胺和环酰菌胺混合标准溶液经吸附剂处理后的回收率Table 2 Recoveries of boscalid and fenhexamid residues after adsorbed by C18, PSA, Pesti Carb respectively
从表2可看出,Cleanert ODS C18-N对啶酰菌胺和环酰菌胺吸附很小,但当Cleanert ODS C18-N用量增加至200mg时,其对两种农药都产生一定程度的吸附。25mg和50mg Cleanert PSA对这两种农药吸附较弱,但随其用量的增加,Cleanert PSA对啶酰菌胺和环酰菌胺吸附作用增强,尤其对环酰菌胺吸附更强,10 0 mg Cleanert PSA净化处理环酰菌胺后的回收率为79.3%。Cleanert Pesti Carb对2种农药均有一定程度的吸附作用,10mg Cleanert Pesti Carb对啶酰菌胺和环酰菌胺吸附回收率分别为40.8%和78.4%,并且随Cleanert Pesti Carb用量增加吸附更强。本研究结合净化剂去杂特性和对目标化合物的吸附情况,选择100mg Cleanert ODS C18-N和50mg Cleanert PSA对蔬菜和水果中基质干扰物进行净化。实际试验发现,由于1mL提取液中仅含有0.5g样品基质,采用100mg Cleanert ODS C18-N和50mg Cleanert PSA对色素等杂质去除效果良好。采用上述方法净化处理后,对比图2、3可看出净化后目标物周围无杂质峰干扰,满足检测要求。
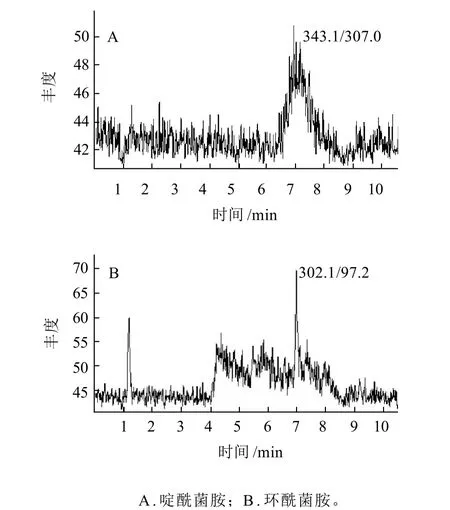
图2 大葱空白样品中啶酰菌胺和环酰菌胺的MRM色谱图Fig.2 HPLC chromatograms of boscalid and fenhexamid in a blank welsh onion sample

图3 大葱加标样品中啶酰菌胺和环酰菌胺的MRM色谱图Fig.3 HPLC chromatograms of a welsh onion sample spiked with boscalid and fenhexamid
2.6 方法的线性范围
将空白样品按上述提取和净化过程进行处理,得到空白基质提取净化液。用该基质溶液将标准液稀释成浓度为1、2、5、10、20、50、100μg/L标准工作液,HPLC-MS/MS进样分析后,以峰面积(Y)对化合物质量浓度(X)作线性回归,绘制的啶酰菌胺和环酰菌胺标准曲线和线性相关系数分别为Y=814.87X-398.77,r=0.9996和Y=854.82X-277.97,r=0.9997,表明在1~100μg/L范围内线性良好。
2.7 方法的检出限和定量限
方法检出限以空白样品基质稀释标准曲线上的最低浓度出峰时,取信噪比RSN=3和样品处理过程的稀释倍数(本方法稀释倍数为0.5倍)计算得出。定量限是以空白样品基质稀释标准曲线上的最低浓度出峰时,取信噪比RSN为10和样品处理过程的稀释倍数(本方法稀释倍数为0.5倍)计算得出。啶酰菌胺在黄瓜基质中的方法检出限和定量限分别为0.395μg/kg和1.32μg/kg。环酰菌胺在黄瓜基质中的方法检出限和定量限分别为0.361μg/kg和1.20μg/kg。
2.8 方法的回收率和精密度
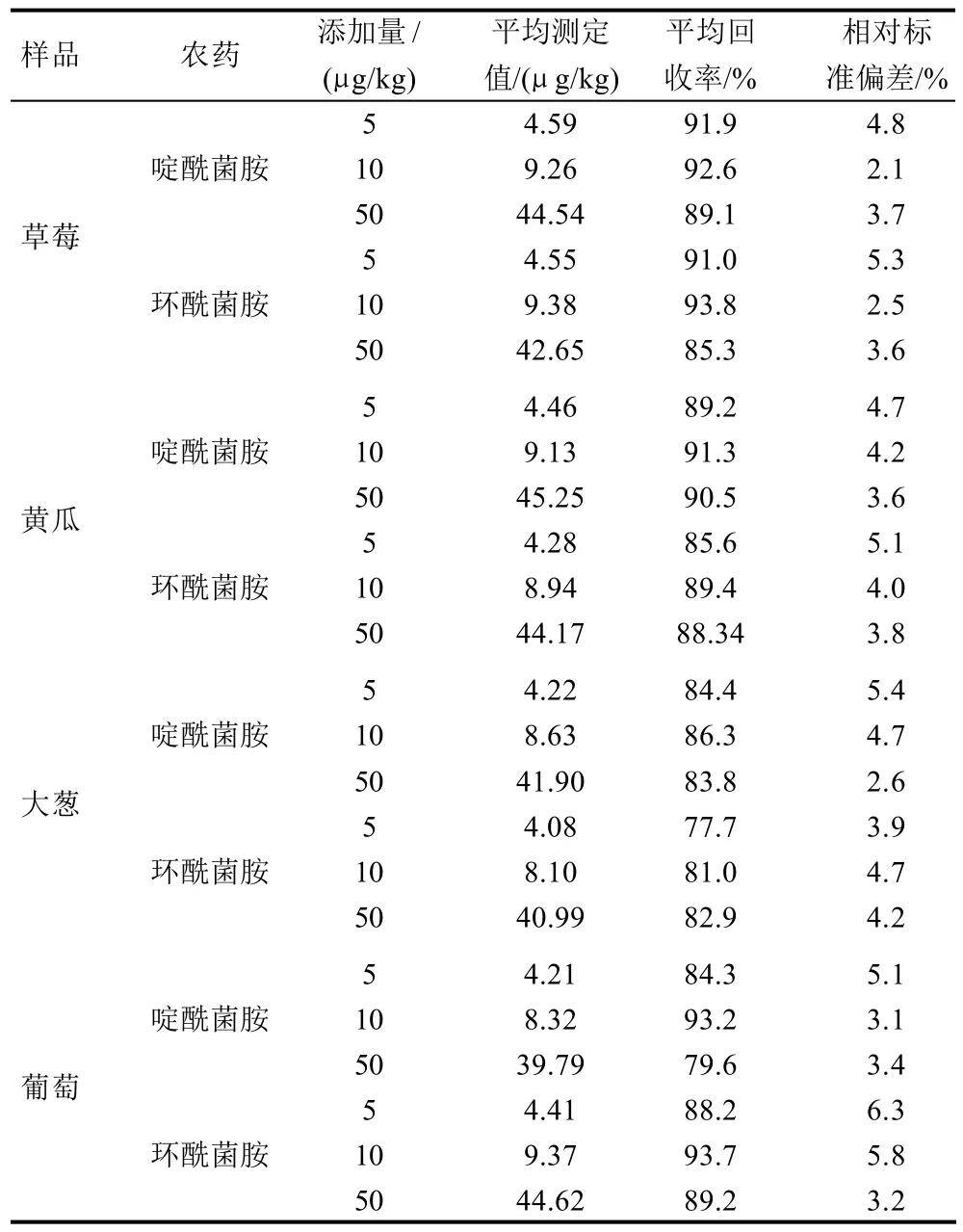
表3 样品中啶酰菌胺和环酰菌胺的回收率和精密度(n=6)Table 3 Mean recoveries and precisions of boscalid and fenhexamid in sample (n=6)
在阴性草莓、黄瓜、大葱和葡萄样品中添加3个浓度水平的混合标准液,按上述前处理方法进行处理,做回收率实验,每个水平重复6次,测精密度,结果见表3。由表3可见,不同添加浓度的平均回收率测定范围在77.7%~93.8%之间,相对标准偏差在2.1%~6.3%之间,其结果表明方法的准确度及精密度均可达到定量分析的要求。
3 结 论
本实验参照QuEChERS前处理技术的分散固相萃取技术,建立蔬菜和水果中啶酰菌胺和环酰菌胺残留的液相色谱串联质谱检测方法。该方法用含1%乙酸的乙腈溶液提取样品中的啶酰菌胺和环酰菌胺残留,同时采用乙二胺-N-丙基硅烷和十八烷基硅烷键合相混合吸附剂对样品提取液进行净化,十八烷基硅烷键合相弥补了乙二胺-N-丙基硅烷不吸附油脂、色素等弱极性杂质的缺点,使净化更为充分。将此前处理方法结合HPLC-MS/MS应用于蔬菜和水果中啶酰菌胺和环酰菌胺的同时定性确证和定量检测,取得了满意的结果。该方法具有简单快速、灵敏、准确等特点,能满足国外最高残留限量要求。
[1] 亦冰. 新颖杀菌剂-啶酰菌胺[J]. 世界农药, 2006, 28(5): 51-53.
[2] 刘长令. 世界农药大全: 杀菌剂卷[M]. 北京: 化学工业出版社, 2006:99-100; 234-235.
[3] 颜范勇, 刘冬青, 司马利锋, 等. 新型烟酰胺类杀菌剂-啶酰菌胺[J].农药, 2008, 47(2): 132-135.
[4] 凌岗, 刘晓智. 环酰菌胺的合成[J]. 农药, 2009, 48(5): 333-334.
[5] 于乐祥, 张秀珍. 新型烟酰胺类杀菌剂啶酰菌胺的研究进展[J]. 山东农药信息, 2009, 12(11): 29-30.
[6] 熊晓妹. 杀菌剂新品种-啶酰菌胺制剂的特性研究[J]. 农药研究与应用, 2006, 10(4): 25-27.
[7] 庄无忌. 国际食品饲料中农药残留限量法规(第二卷)[M]. 北京: 化学工业出版社, 2010: 108.
[8] 庄无忌. 国际食品饲料中农药残留限量法规(第一卷)[M]. 北京: 化学工业出版社, 2010: 148-149.
[9] 庄无忌. 国际食品饲料中农药残留限量法规(第三卷)[M]. 北京: 化学工业出版社, 2010: 425-427.
[10] 唐俊, 汤锋, 操海群, 等. 啶酰菌胺在黄瓜和土壤中残留分析方法研究[J]. 安徽农业大学学报, 2008, 35(4): 550-554.
[11] 陈莉, 贾春虹, 贺敏, 等. 草莓和土壤中啶酰菌胺残留量的高效液相色谱分析[J]. 农药, 2009, 48(5): 361-364.
[12] 张玉婷, 郭永泽, 刘磊, 等. 啶酰菌胺在葡萄及土壤中的残留动态[J].农药, 2011, 50(1): 51-52.
[13] 王云凤, 王伟, 秦洪健, 等. 液相色谱-质谱法测定果蔬中10种酰胺类杀菌剂残留量[J].食品研究与开发, 2010, 31(1): 113-116.
[14] LIU Xinggang, DONG Fengshou, QIN Dongmei, et al. Residue analysis of kresoxim-methyl and boscalid in fruits, vegetables and soil using liquid-liquid extraction and gas chromatography-mass spectrometry[J].Biomedical Chromatography, 2010, 24(4): 367-373.
[15] STANISLAW W, BOGUSLAW G. Development and validation of a multi-residue method for the determination of pesticides in honeybees using acetonitrile-based extraction and gas chromatography-tandem quadrupole mass spectrometry[J]. J Chromatogr A, 2009, 1216(37): 6522-6531.
[16] ROSA M, GONZALEZ R, BEATRIZ C G, et al. Multiresidue determination of 11 new fungicides in grapes and wines by liquid-liquid extraction/clean-up and programmable temperature vaporization injection with analyte protectants/gas chromatography/ion trap mass spectrometry[J]. J Chromatogr A, 2009, 1216(32): 6033-6042.
[17] ELPINIKI G A, NIKOLAOS G T. Chemometric study and optimization of extraction parameters in single-drop microextraction for the determination of multiclass pesticide residues in grapes and apples by gas chromatography mass spectrometry[J]. J Chromatogr A, 2009, 1216(45): 7630-7638.
[18] ANASTASIOS E, HELEN B, SPYROS A, et al. Determination of multi-class pesticides in wines by solid-phase extraction and liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A, 2009,1216(31): 5856-5867.
[19] ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispensive solid-phase extraction” for the determination of pesticide residues in produce[J]. J AOAC Int, 2003, 86(2): 412-431.
[20] 袁雪婵. QuEChERS方法及其在食品农药多残留分析中的应用[J]. 中国食品添加剂, 2009(2): 144-148.
Determination of Boscalid and Fenhexamid Residues in Fruits and Vegetables by HPLC-MS/MS
GUO Qing-long1,CUI Shu-hua2,*,DUAN Hao2,LIN Li-ming3,QIAN Jia-liang2,XU Mei-ling2,WU Shu-xiu2
(1. Huangdao Entry-Exit Inspection and Quarantine Bureau, Qingdao 266555, China;2. Inspection and Quarantine Technology Center, Linyi Entry-Exit Inspection and Quarantine Bureau, Linyi 276034, China;3. Shandong Inspection & Quarantine and Science &Technology Academy, Qingdao 266002, China)
A liquid chromatography-tandem mass spectrometry method was established to determine boscalid and fenhexamid residues in fruits and vegetables. Analytes were extracted from samples using 1% acetic acid acetonitrile, and then purified by solid phase extraction cartridge packaged with sorbent primary secondary amine (PSA) and C18. The residues were determined by high-performance liquid chromatography coupled with tandem MS (HPLC-MS/MS) using external standard method, and the interference of matrix was deducted by the matrix-matched calibration standards curve. A good linearity of calibration curve was exhibited over a concentration range of 1μ g/L to 100μ g/L for boscalid and fenhexamid with a correlation coefficient of 0.9996 and 0.9997, respectively. Average recoveries for boscalid and fenhexamid in 4 samples at spiked levels of 5 - 50 μg/kg were between 77.7% and 93.8%, with a relative standard deviations between 2.1% and 6.3%. For boscalid and fenhexamid, the limit of quantification were 1.32, 1.20 μg/kg and the limit of detection were 0.395, 0.361 μg/kg, respectively.
HPLC-MS/MS;boscalid;fenhexamid;fruits;vegetables
TS207.5
A
1002-6630(2012)10-0255-05
2011-05-06
国家质检公益性行业科研专项(200910145-2)
郭庆龙(1981—),男,农艺师,硕士,研究方向为植物检疫与农产品安全。E-mail:long_xian1@163.com
*通信作者:崔淑华(1980—),女,工程师,硕士,研究方向为农兽药残留分析。E-mail:cuishuh@163.com
