固相萃取-气相色谱法测定食品包装材料中邻苯二甲酸酯类物质
2012-10-25曹小妹吴晓燕张敬轩高文惠
曹小妹,吴晓燕,李 挥,张敬轩,高文惠,*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省产品质量监督检验院,河北 石家庄 050000;3.河北省食品质量监督检验研究院,河北 石家庄 050000)
固相萃取-气相色谱法测定食品包装材料中邻苯二甲酸酯类物质
曹小妹1,吴晓燕2,李 挥3,张敬轩3,高文惠1,*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省产品质量监督检验院,河北 石家庄 050000;3.河北省食品质量监督检验研究院,河北 石家庄 050000)
建立采用固相萃取-气相色谱法同时分析检测邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二环己酯(DCHP)、邻苯二甲酸丁基苄基酯(BBP)和邻苯二甲酸二-2-乙基己酯(DEHP)4种邻苯二甲酸酯类物质的方法。研究塑料包装材料中邻苯二甲酸酯类在水、65%乙醇、4%乙酸、正己烷4种模拟液中的溶出及利用固相萃取技术对浸出液进行富集的情况,考察气相色谱操作条件对4种邻苯二甲酸酯类物质分离的影响。结果表明,该方法具有良好的线性相关性,线性相关系数在0.9986~0.9994之间;回收率在80.63%~95.50%之间;DBP、BBP、DCHP和DEHP的检测限分别是0.050、0.010、0.055μg/mL和0.012μg/mL。该方法样品预处理简便,测定方法灵敏、可靠,可用于食品包装材料中邻苯二甲酸酯类的监测。
邻苯二甲酸酯类物质;模拟物;固相萃取;气相色谱法
邻苯二甲酸酯类物质(phthalates,PAEs)是一种理想的增塑剂,因而被普遍加入到塑料中增加塑料的柔软性能[1]。它被添加到塑料中并未聚合到高分子聚氯乙烯(poly vinyl chloride,PVC)碳链上,而是以氢键或范德华力与PVC分子结合,彼此保留独立的化学性质,因此在使用过程中,如果遇到水和有机溶剂等物质,增塑剂就会不断的从塑料制品中溶出,转移到食品或环境中,造成污染,因此,近年来国际上越来越重视邻苯二甲酸酯的毒性问题,同时邻苯二甲酸酯的分析技术也成为检验热点。邻苯二甲酸酯类是典型的环境激素污染物,长期接触影响人体内分泌,严重者将导致畸形、癌变和致突变[2-3]。目前邻苯二甲酸酯类物质常用的检测方法有气相色谱法[4-9]和高效液相色谱法[10-16]。本实验拟通过优化固相萃取条件,建立气相色谱法测定邻苯二甲酸酯类物质。
1 材料与方法
1.1 材料与试剂
正己烷、无水乙醇、乙酸、无水硫酸钠、甲醇、丙酮均为分析;邻苯二甲酸酯类标准物质:邻苯二甲酸二丁酯(99.9%)、邻苯二甲酸二环己酯(99.8%)、邻苯二甲酸丁基苄基酯(99.3%)、邻苯二甲酸二-2-乙基己酯(99.7%)及PVC塑料保鲜膜 北京路桥公司;实验用水均为二次蒸馏水。
标准储备液:分别准确称取50mg邻苯二甲酸二-2-乙基己酯(di-2-ethylhexyl phthalate,DEHP)、邻苯二甲酸丁基苄基酯(benyl butyl phthalate,BBP)、邻苯二甲酸二丁酯(dibutyl phthalate,DBP)、邻苯二甲酸二环己酯(dicyclohexyl phthalate,DCHP)标准品置于50mL容量瓶,正己烷定容。
100 μ g/mL标准使用液:各取5mL标准储备液于50mL容量瓶,正己烷定容。
1.2 仪器与设备
CP-3800气相色谱仪(配氢火焰离子化检测器) 美国Varian有限公司;HH.S11-6电热恒温水浴锅 北京长安科学仪器厂;202-2型电热恒温干燥箱 通州市测量仪器仪表厂;固相萃取装置 美国Agilent公司;N-EVAP氮吹仪 美国Organomation公司;KQ-250DB型数控超声波清洗器 上海楚定分析仪器有限公司。
1.3 样品前处理
1.3.1 以水为模拟物提取
用水模拟水性食品。提取:取150cm2的PVC塑料保鲜膜袋,加入200mL二次蒸馏水,在80℃的恒温烘箱中提取4h,收集提取液于250mL的锥形瓶中;萃取:取上述提取液100mL,用C18固相萃取小柱进行固相萃取。先用2mL正己烷清洗柱床,再用2mL甲醇和2mL二次蒸馏水停留5min后,以大约2~3mL/min流出,当液面距萃取相1cm时,将100mL水提取液缓缓倒入,通过萃取柱,上样速率为8mL/min,整个萃取过程中固定相不得有液体断层。待水样全部通过后,用2mL二次蒸馏水清洗柱体,并用平稳的气流继续抽吸10min。用2mL 正己烷-丙酮(30:1,V/V)混合洗脱剂将待测物从固相柱上洗脱下来,洗脱速率为4mL/min,将洗脱液收集到盛有1g无水硫酸钠的10mL离心管中。用氮吹仪吹去溶剂,用2mL正己烷定容后供色谱分析用。
1.3.2 以65%乙醇为模拟物提取
用65%乙醇模拟含醇食品。提取:取150cm2的PVC塑料保鲜膜袋,加入200mL 65%的乙醇溶液,在40℃的恒温烘箱中提取4h,收集提取液于250mL的锥形瓶中;去醇:将乙醇提取液于90℃的水浴锅中加热,直到将乙醇除净;萃取:用C18固相萃取小柱对49mL提取液进行固相萃取,萃取步骤和条件同1.3.1节方法。
1.3.3 以4%乙酸为模拟物提取
用4%乙酸模拟含酸食品。提取:取150cm2的PVC塑料保鲜膜袋,加入200mL 65%的乙酸溶液,在40℃的恒温烘箱中提取4h,收集提取液于250mL的锥形瓶中;去酸:将盛有乙酸提取液的锥形瓶放入到90℃的水浴锅中加热,直到将乙酸除净;萃取:用C18固相萃取小柱对60mL提取液进行固相萃取,萃取步骤和条件同1.3.1节方法。
1.3.4 以正己烷为模拟物提取
用正己烷模拟油脂性食品。提取:取150cm2的PVC塑料保鲜膜袋,加入100mL正己烷,常温放置4h,收集提取液于250mL的锥形瓶中。提取液可直接用于测定。
1.4 气相色谱条件
载气为纯度99.99%的高纯氢、流量30mL/min、空气流量300mL/min、尾吹气流量25mL/min、进样口温度250℃、检测器温度280℃。柱温采用程序升温:起始温度90℃,保持1min后以10℃/min的升温速率升至250℃,保持2min,再以40℃/min的升温速率升至280℃,保持5min。分流比1:10,进样量1μL。
2 结果与分析
2.1 固相萃取条件的确定
在固相萃取操作中,影响分析物峰面积的主要固相萃取因素有洗脱剂、洗脱体积、洗脱速率和上样速率。洗脱剂一般用有机溶剂,根据相似相溶原则选择,洗脱剂可使用单一一种溶剂,也可使用混合溶剂。实验考察乙酸乙酯以及正己烷和丙酮的混合溶液作为洗脱剂,结果表明采用乙酸乙酯做洗脱剂时,DEHP回收率偏低,为20.67%。当以正己烷和丙酮的混合溶液作为洗脱剂时,考察C18固相萃取洗脱剂配比(正己烷与丙酮的体积比)、洗脱体积、洗脱速率、上样速率4因素对峰面积产生的影响。为了综合考虑同时测定时的固相萃取条件,将单一因素对4种分析物影响的数据综合作图得到单一因素综合影响图(以峰面积作为4种PAEs萃取效果的度量指标),如图1所示。
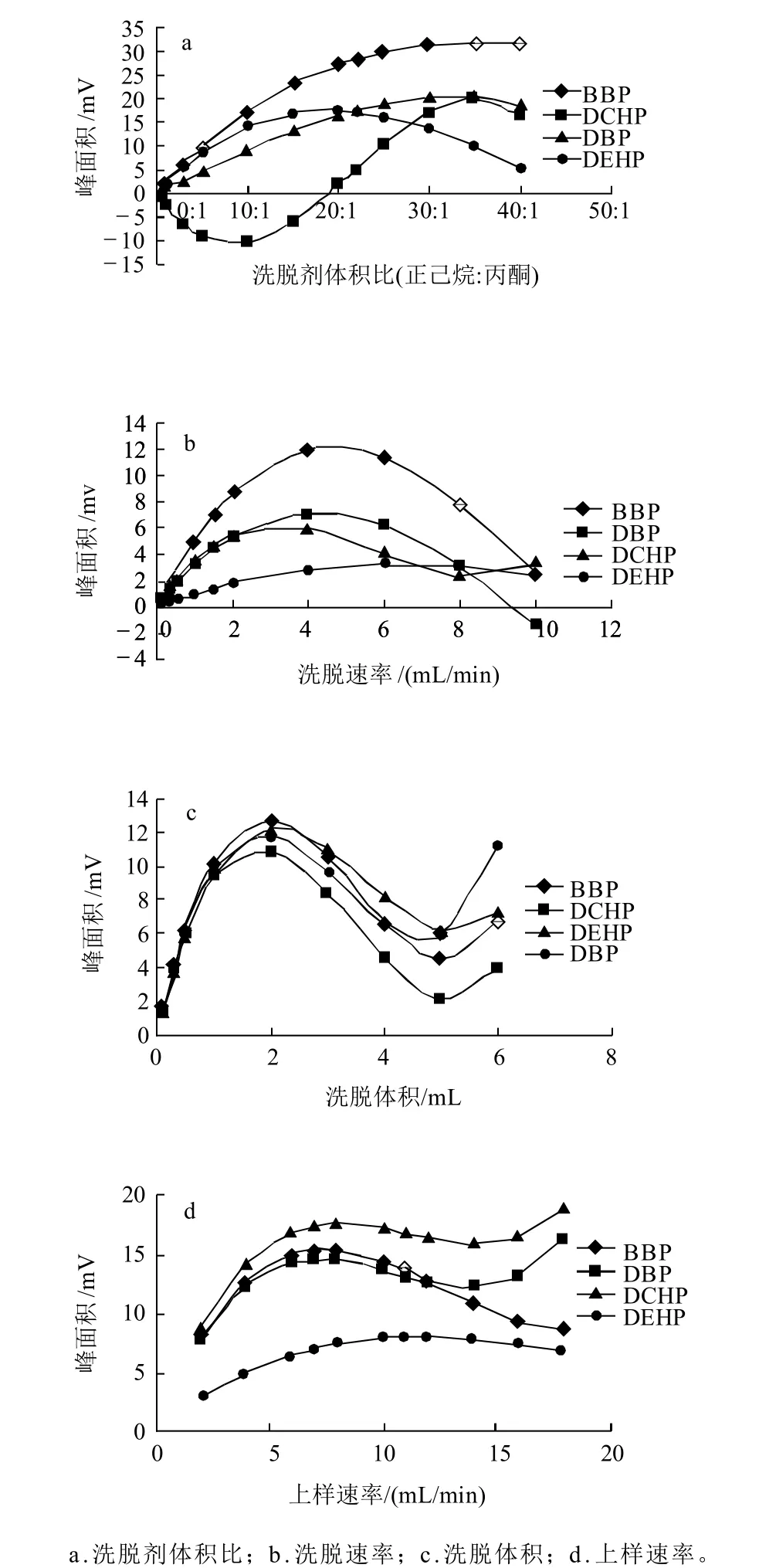
图1 洗脱条件对PAEs萃取的影响Fig.1 Effect of elution condition on the extraction of four PAEs
从图1可以看出,4种PAEs的最佳条件大部分呈较好的一致性。综合考虑并通过验证实验最后确定同时测定4种PAEs的最佳固相萃取条件为正己烷-丙酮(30:1,V/V),洗脱体积为2mL,洗脱速率为4mL/min,上样速率为8mL/min。
2.2 气相色谱条件的确立
由于邻苯二甲酸酯类化合物沸点较高,而且待分离的4种PAEs分子量相差比较大,程序升温所需要的温度较高,如果色谱柱极性越强能达到的最高使用温度越低。因此,本实验选择非极性HP-1(100%的聚二甲基硅氧烷)和弱极性的HP-5(5%的苯基+95%聚二甲基硅氧烷)熔融弹性石英毛细管柱分离4种PAEs,这两根色谱柱最高使用温度能达到325℃。当使用非极性HP-1色谱柱时,DBP和BBP不能分开,而使用弱极性的HP-5毛细管色谱柱能将4种PAEs完全分离,见图2。故选择弱极性的HP-5毛细管色谱柱作为分析柱。
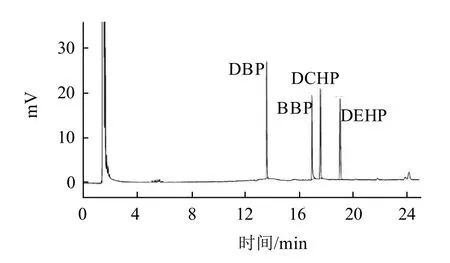
图2 HP-5毛细管柱分离4种PAEs的色谱图Fig.2 Chromatogram of four PAEs using HP-5 capillary column
2.2.1 汽化室温度的选择
邻苯二甲酸酯类的沸点高,汽化室温度低不利于汽化。实验分别考察进样口温度为125、150、200、250、280℃,结果为250℃时,PAEs各化合物的峰面积平均是125℃时的5倍;同时,在150℃,250℃两个温度下进样后,再分别进溶剂一次,发现在150℃时,PAEs各化合物均出现色谱峰,而250℃,则不出峰。因此,测定邻苯二甲酸酯类化合物时进样口温度设定为250℃。
2.2.2 载气流速的选择
不同的载气流速对邻苯二甲酸酯类的出峰时间有很大的影响,分别采用流速为10、15、30、35mL/min,结果表明,15mL/min和30mL/min分离效果最好,分离度大于1.5,从分析时间和分离效果综合考虑选择30mL/min较合适。
2.2.3 柱温的选择
根据4种PAEs的特点,考察以下3个柱温条件。
条件1:90℃(保持1min),以5℃/min升至290℃(保持3min),然后以15℃/min升至300℃。在此条件下,BBP、DEHP、DBP峰形较好,基线平稳,但DCHP没有出峰。
条件2:90℃(保持1min),以10℃/min升至250℃(保持2min),然后以40℃/min升至280℃(保持5min)。在此条件下4种分析物在20min内得到较为理想的色谱分离,如图2所示。
条件3:100℃(保持1min),以5℃/min升至230℃,然后以25℃/min,升至260℃(保持3min)。在条件3下4种分析物均出峰,分析时间31min。
实验结果表明,初始温度过低时,峰形明显变宽;本着在保证较好分离效果的前提下,尽量缩短分析时间的原则,最终确定条件2为该实验色谱条件。
2.3 线性范围及检测限
使用标准使用液配制100.0、10.00、1.00、0.10、0.0200、0.0100μg/mL标准系列溶液。在1.4节条件下进行测试,得到DBP和DCHP的线性范围为0.1~100μg/mL,BBP和DEHP的线性范围为0.02~10μg/mL。DBP、BBP、DCHP和DEHP线性相关系数分别为0.9992、0.9986、0.9994和0.9991,检测限分别为0.050、0.010、0.055μg/mL和0.012μg/mL。
2.4 回收率实验
分别向水、65%乙醇、4%乙酸和正己烷中加入邻苯二甲酸酯类标准品,使其质量浓度为2.27、2.45、2.36μg/mL和3.57μg/mL,按照1.3节和1.4节方法进行测定,其结果见表1,4种模拟物提取时的回收率在80.63%~95.50%之间,RSD在2.75%~5.74%之间。
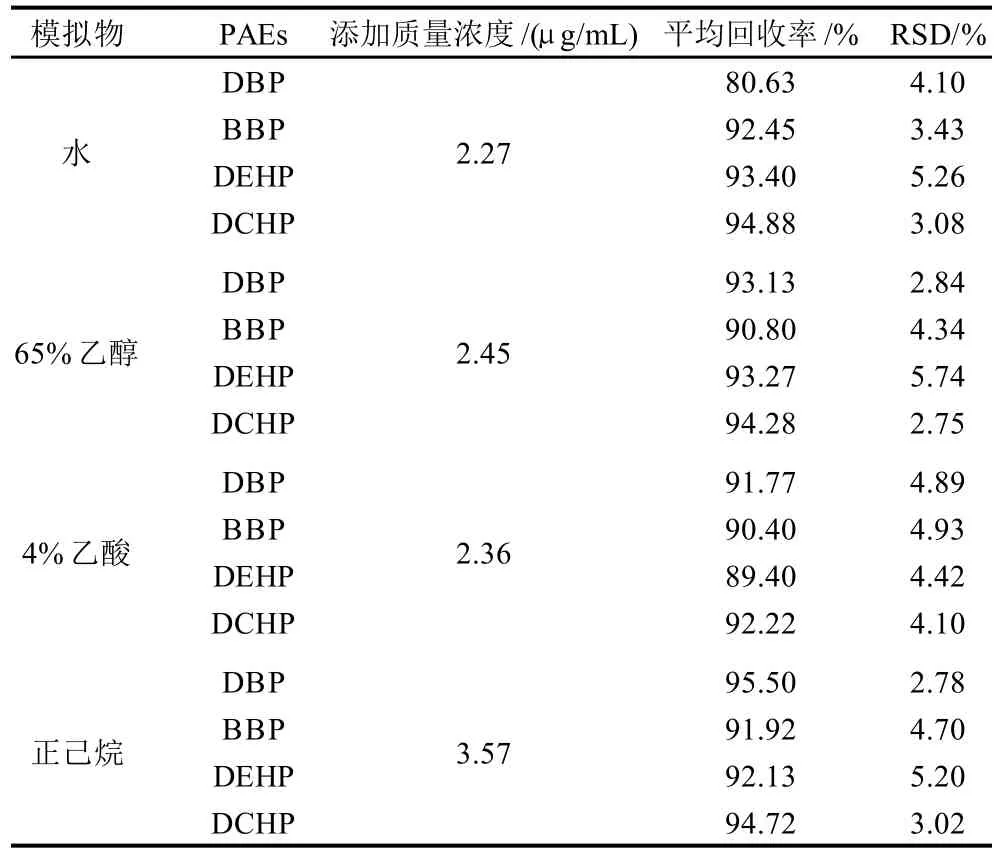
表1 PVC塑料保鲜膜中添加PAEs在不同模拟物中提取的回收率结果Table 1 Recovery rates of PAEs in PVC preservative film using different simulants
3 结 论
本实验将固相萃取技术用于水、乙醇溶液、乙酸溶液中增塑剂PAEs的富集,大大简化了样品的预处理工作,提取后的PAEs采用气相色谱法检测。采用该方法DBP和DCHP的线性范围为0.1~100μg/mL,BBP和DEHP的线性范围为0.02~10μg/mL,DBP、BBP、DCHP、DEHP的最低检测限分别为0.050、0.010、0.055μg/mL和0.012μg/mL。用4种模拟物提取时的回收率在80.63%~95.50%之间。4种PAEs的检测的精密度在2.75%~5.74%之间。
[1] 山西省化工研究所. 塑料橡胶加工助剂[M]. 北京: 化学工业出版社,2002: 69-73.
[2] 任晋, 蒋可. 内分泌干扰剂的研究进展[J]. 化学进展, 2001, 14(2):135-143.
[3] 丁鹏, 赵晓松, 刘剑锋. 酞酸酯类化合物(PAES)研究新进展[J]. 吉林农业大学学报, 1999, 21(3): 119-124.
[4] FENG Y, ZHU J, SENSENSTRIN R, et al. Development of a headspace solid-phase microextraction method combined with gas chromatography mass spectrometry for the determination of phthalate esters in cow milk[J]. Analytica Chimica Acta, 2005, 538(1/2): 41-48.
[5] FAAHANI H, NOROUZI P, DINARVAND R, et al. Development of dispersive liquid-liquid microextraction combined with gas chromatography-mass spectrometry as a simple, rapid and highly sensitive method for the determination of phthalate esters in water samples[J]. Journal of Chromatography A, 2007, 1172(2): 105-112.
[6] OZER E T, GUCER S. Determination of some phthalate acid esters in artificial saliva by gas chromatography-mass spectrometry after activated carbon enrichment[J]. Talanta, 2011, 84(2): 362-367.
[7] 柴丽月, 辛志宏, 蔡晶, 等. 食品中邻苯二甲酸酯类增塑剂含量的测定[J]. 食品科学, 2008, 29(7): 362-365.
[8] 刘芃岩, 高丽, 申杰, 等.固相微萃取-气相色谱法测定白洋淀水样中的邻苯二甲酸酯类化合物[J]. 色谱, 2010, 28(5): 517-520.
[9] 卢春山, 李玮, 屠海云, 等. 气相色谱-质谱联用测定食品中的邻苯二甲酸酯[J]. 分析测试学报, 2010, 29(10): 1036-1040.
[10] LOPEZ-JIMENEZ F J, RUBIO S, PEREZ-BENDITO D. Determination of phthalate esters in sewage by hemimicelles-based solid-phase extraction and liquid chromatography-mass spectrometry[J]. Analytica Chimica Acta, 2005, 551(1/2): 142-149.
[11] JEN J, LIU T. Determination of phthalate esters from food-contacted materials by on-line microdialysis and liquid chromatography[J]. Journal of Chromatography A, 2006, 1130(1): 28-33.
[12] De ORSI D, GAGLIARDI L, PORRA R, et al. A environmentally friendly reversed-phase liquid chromatography method for phthalates determination in nail cosmetics[J]. Analytica Chimica Acta, 2006, 555(2): 238-241.
[13] 殷雪琰, 许茜, 吴淑燕, 等. 基于PA6纳米纤维膜固相萃取-液相色谱法检测牛奶中的邻苯二甲酸酯[J]. 高等学校化学学报, 2010, 31(4): 690-695.
[14] 张会军, 张敬轩, 李挥, 等. 凝胶渗透色谱- 高效液相色谱法对辣椒酱中14种邻苯二甲酸酯的同时检测[J]. 食品科学, 2011, 32(4): 152-154.
[15] 徐向华, 方晓明, 丁卓平, 等. 高效液相色谱测定牛奶中邻苯二甲酸酯的方法研究[J]. 化学通报, 2008(3): 420-424.
[16] 李波平, 林勤保, 宋欢, 等. 快速溶剂萃取-高效液相色谱测定塑料中邻苯二甲酸酯类化合物[J]. 应用化学, 2008, 25(1): 63-66.
Determination of Phthalate Esters in Plastic Food Packing Materials by Solid Phase Extraction-Gas Chromatography
CAO Xiao-mei1,WU Xiao-yan2,LI Hui3,ZHANG Jing-xuan3,GAO Wen-hui1,*
(1. College of Biological Science and Engineering, Hebei University of Science and Technology, Shijiazhuang 050018, China;2. Hebei Institute of Product Quality Supervision and Determination, Shijiazhuang 050000, China;3. Hebei Institute of Food Quality Supervision, Inspection and Research, Shijiazhuang 050000, China)
A method was developed by solid phase extraction-gas chromatography for the simultaneous determination of dibutyl phthalate (DBP), benzyl butyl phthalate (BBP), dicyclohexyl phthalate (DCHP) and di-2-ethylhexyl phthalate (DEHP) in plastic food packing materials. The dissolution of phthalate esters from plastic packing materials into water, 65% alcohol, 4%acetic acid and n-hexane was studied. The enrichment of phthalate esters in extraction solution was conducted by solid phase extraction. The effect of gas chromatographic conditions on the separation of four phthalate esters was investigated. The results showed that the method had an excellent linear relationship with the correlation coefficient of 0.9986-0.9994. The recovery rates and detection limits of this method for DBP, BBP, DCHP and DEHP were 80.63%-95.50%, and 0.050, 0.010, 0.055 and 0.012 μg/mL, respectively. This developed method is easy, sensitive and reliable, which can be used to analyze phthalate esters in plastic food packing materials.
phthalate esters;simulants;solid-phase extraction;gas chromatography
O657.7
A
1002-6630(2012)10-0251-04
2011-09-26
河北省科技支撑计划项目(10276902D);河北省科技厅重大科技攻关项目(09227134D);河北省自然科学基金项目(B2008000669)
曹小妹(1986—),女,硕士研究生,研究方向食品安全分析与检测。E-mail:xiaomei_cao0403@sina.com
*通信作者:高文惠(1963—),女,教授,博士,研究方向食品安全与分离科学。E-mail:wenhuigao@126.com
