酶催化菜籽油酸解制备结构脂质工艺
2012-10-25寿佳菲潘丽军操丽丽
寿佳菲,潘丽军,2,*,操丽丽,2,刘 模
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.安徽省农产品精深加工重点实验室,安徽 合肥 230009)
酶催化菜籽油酸解制备结构脂质工艺
寿佳菲1,潘丽军1,2,*,操丽丽1,2,刘 模1
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.安徽省农产品精深加工重点实验室,安徽 合肥 230009)
以菜籽油和辛酸为原料,用来自Thermomyces lanuginosa固定化脂肪酶TL IM作为催化剂,采用单因素试验结合响应曲面(Box-Behnken设计)优化得到酶法制备结构脂质的工艺条件,最佳制备条件为底物(菜籽油:辛酸)物质的量比1:3.57、加酶量10.57%(以底物质量计)、加水量5.2%(以酶质量计)、反应温度48.6℃、反应时间12h。该条件下辛酸插入率可达23.19%。对提高油菜籽油附加值、延长油菜加工产业链具有重要意义。
菜籽油;辛酸;酸解;结构脂质;响应曲面
结构脂质(structured lipids),是对甘油三酯和脂肪酸经过改性或结构调整得到的脂,将特殊营养或生理功能的脂肪酸结合到特定位置,在保留天然油脂的部分或全部性质外,以最大限度发挥各种脂肪酸的功能,如能增强免疫力、易消化吸收、降低血脂、改善氮平衡、减少癌症、心血管疾病、肥胖症的患病风险等等[1]。有研究表明,脂肪酸的种类及其在甘油骨架上的位置与代谢途径密切相关。甘油三酯在体内的代谢过程中脂肪酶只水解1,3位上的脂肪酸,而2位上的所有脂肪酸都以单甘酯的形式被吸收[2-4]。因此,1,3位是中(短)碳链脂肪酸、2位是长链脂肪酸的结构脂质的生产引起了国内外广泛关注。
结构脂质的生产方法主要有物理法、化学催化法和酶合成法[5]。物理法是经过简单的调和或分馏来制取,但不能改变甘油三酯中脂肪酸的分布,因此不能得到所需的产品。化学催化法一般以碱金属为催化剂,反应条件强烈、无特异性、产物难以分离、难以得到期望的结构脂质[6]。而在酶法中,由于脂肪酶具有位置专一性和脂肪酸专一性,因此可避免上述两种方法的缺点,并能在温和的条件下,合成特定的结构脂质,且副产物少、产品易回收[6-7]。因此酶法合成结构脂质具有广阔的应用前景。本实验以商品化1,3特异性脂肪酶TL IM(来自Thermomyces lanuginosa)作为催化剂,一级精炼菜籽油和辛酸为底物,采用单因素实验结合响应曲面(Box-Behnken设计)优化酶催化酸解反应,确定最佳反应工艺条件。
1 材料与方法
1.1 材料与试剂
一级精炼菜籽油 安徽省大平油脂厂;固定化脂肪酶 TL IM 丹麦诺维信公司;辛酸甲酯标准品 美国Sigma公司;猪胰脂肪酶 北京索莱宝科技有限公司;辛酸(98%) 国药集团化学试剂有限公司;正己烷等其他试剂均为国产分析纯或色谱纯。
1.2 仪器与设备
SHY-2A型恒温气浴摇床 江苏金坛市金城国胜实验仪器厂;AR1140/C型电子天平 奥豪斯(上海)公司;GC-2010气相色谱仪 日本岛津制作所;台式高速冷冻离心机 美国Beckman公司。
1.3 方法
1.3.1 菜籽油与辛酸的酸解反应
称5.0g菜籽油和适量辛酸加入到50mL具塞锥形瓶中,加入一定量的固定化脂肪酶,在转速150r/min、一定温度条件下,密闭振荡反应。定时取样,分离纯化以及甲酯化后用于分析辛酸插入率。
1.3.2 产物分离纯化方法[8]
将过滤除去脂肪酶的混合产物置于分液漏斗中,加入适量正己烷溶解,用1g/mL的酚酞溶液作为指示剂,加碱皂化除去游离脂肪酸,无水乙醇-水(80:20,V/V) 溶液和蒸馏水多次洗涤干燥后,经旋转蒸发后即得产物。
1.3.3 甲酯化方法[9-10]
取分离纯化后的产物1mL 溶于2mL的色谱纯正己烷中,加入适量无水硫酸钠干燥后,取上清液,加入400μL KOH-甲醇溶液(1mol/L),用力摇晃1min后,加入适量蒸馏水静置分层,取上清液用无水硫酸钠干燥后用于分析。
1.3.4 色谱分析条件
色谱柱:DB-WAX 毛细管柱(30m×0.25mm,0.25μm);FID检测器,温度250℃;进样口温度230℃;升温程序:60℃保持1 min,以50℃/min升至200℃,保持1min后,以3℃/min升至250℃,保留3min;氦气流速30mL/min,进样量1μL;分流比50:1。
1.3.5 辛酸插入率的计算
以样品峰的保留时间与辛酸甲酯标准品的保留时间定性,按峰面积归一法计算辛酸插入率。

1.3.6 单因素试验
1.3.6.1 底物(菜籽油:辛酸)物质的量比的影响
在无溶剂体系中,加酶量为10%(以底物质量计),加水量10%(以酶质量计),反应温度为50℃,转速为150r/min,密闭反应一段时间,制备结构脂质。考察不同底物物质的量比(菜籽油:辛酸)对辛酸插入率的影响。
1.3.6.2 反应温度的影响
选取1.3.6.1节的最适底物物质的量比,其他条件同
1.3.6.1节,考察不同反应温度对辛酸插入率的影响。
1.3.6.3 加酶量的影响
选取1.3.6.2节的最适反应温度,其他条件同1.3.6.2节,考察不同加酶量对辛酸插入率的影响。
1.3.6.4 加水量的影响
选取1.3.6.3节的最适加酶量,其他条件同1.3.6.3节,考察不同加水量对辛酸插入率的影响。
1.3.7 响应面优化试验
在单因素试验基础上,采用中心组合试验Bo x-Behnken设计,因素及其水平如表1所示。

表1 酶法制备结构脂质响应面优化试验因素及水平Table 1 Factors and levels of RSM
2 结果与分析
2.1 单因素试验
2.1.1 底物物质的量比对辛酸插入率的影响
在脂肪酶催化酸解反应中,反应达到平衡后产物的组成与底物物质的量比有密切关系。由图1可知,底物物质的量比(菜籽油:辛酸)为1:3时辛酸插入率相对较高,原因可能是高水平的游离脂肪酸会产生大量的羧酸基团,从脂肪酶表面夺取部分必需水,而且可以从油水界面进入到周围的水层中,导致底物抑制效应的发生[11]。
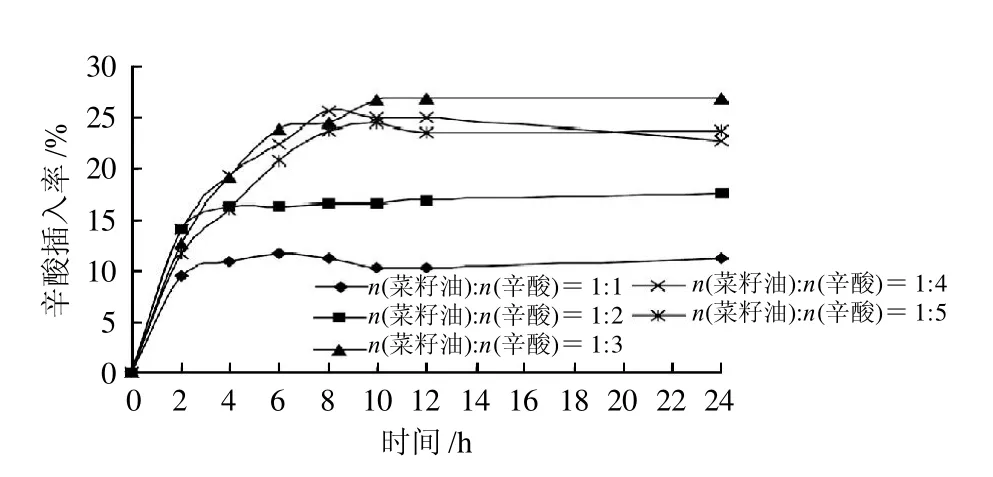
图1 底物物质的量比对辛酸插入率的影响Fig.1 Effect of substrate molar ratio on the incorporation rate of caprylic acid
2.1.2 反应温度对辛酸插入率的影响
酶催化酸解反应时一个热力学反应,反应温度的高低不仅影响底物的溶解状态及黏度,而且影响底物在反应体系中的传质[12]。另外,温度也影响着酶的活性。由图2可知,温度越高,辛酸插入率越高。高温有助于反应底物的互溶,增加底物的接触面积,加快反应速度,缩短反应时间[12]。但是温度从40℃升高到50℃时,辛酸插入率增加很快,而50℃后增加趋势放慢。考虑到较高温度对酶的活性影响很大,选择反应温度为50℃左右较为合适。
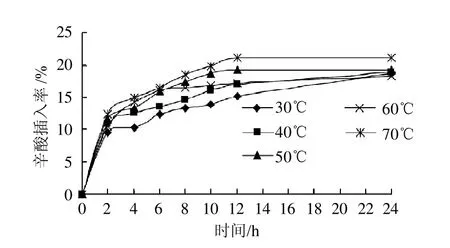
图2 反应温度对辛酸插入率的影响Fig.2 Effect of reaction temperature on the incorporation rate of caprylic acid
2.1.3 加酶量对辛酸插入率的影响
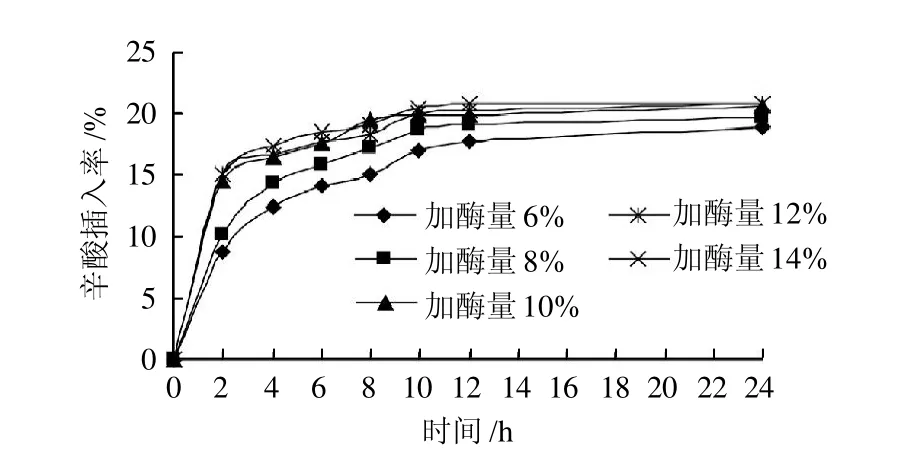
图3 加酶量对辛酸插入率的影响Fig.3 Effect of enzyme dosage on the incorporation rate of caprylic acid
图3表明,随着酶量的增加,辛酸插入率逐渐增大,但是到10%后,辛酸插入率增大得很缓慢,可能是随着酶量的增加,底物与酶分子接触的机会增多,加速了酸解反应的进行[13]。但是酸解反应是复杂的可逆反应,酶量的增加也加速了逆反应的进程和油脂水解反应,同时,在无溶剂体系中,酶量的增加可能会提高体系的黏度,影响传质,同时也会加大成本。综合考虑,适宜酶添加量为10%左右。
2.1.4 加水量对辛酸插入率的影响
脂肪酶只有在油-水界面才具有催化活性,因此水是维持酶活性的必要条件,然而反应体系中水分含量超过一定限度,反应会向水解方向进行,使反应混合物中游离脂肪酸含量增加,产品得率降低,但水分过低又会影响酶分子表面的水分子层,进而影响酶分子的构象和活性[14-15]。
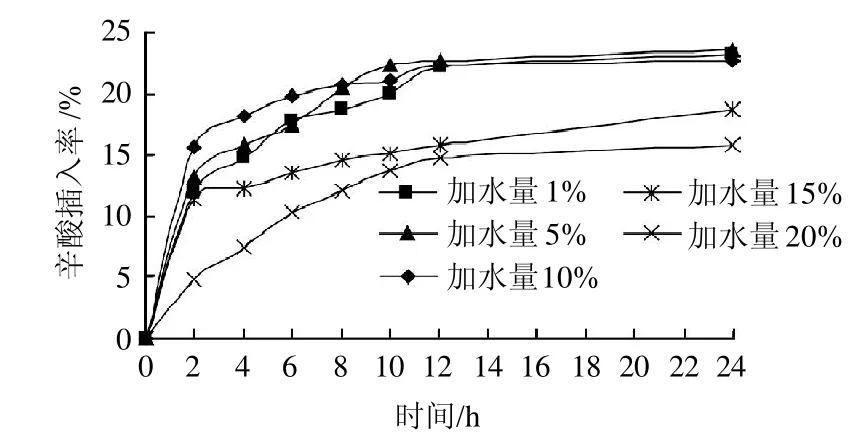
图4 加水量对辛酸插入率的影响Fig.4 Effect of water addition amount on the incorporation rate of caprylic acid
由图4可以看出,在水添加量低于10%时,辛酸插入率是随着水量的增加而增大的,可能是由于在水量添加较低时,酶的活性随水量的增加而增大。然而当水量继续增加到15%时,辛酸插入率开始降低,过多的水反而使底物的水解、酰基转移等副反应发生[16-17]。
2.1.5 反应时间对辛酸插入率的影响
从图1~4可以看出,随着反应时间的延长,辛酸插入率逐渐升高,且在1~12h内辛酸插入率增加迅速,而在12~24h辛酸插入率增加非常缓慢,说明在12h左右反应已基本达到稳定状态,因此再延长反应时间没有实际意义。综上分析,选择反应时间为12 h。
2.2 响应面试验
2.2.1 响应面试验结果与分析
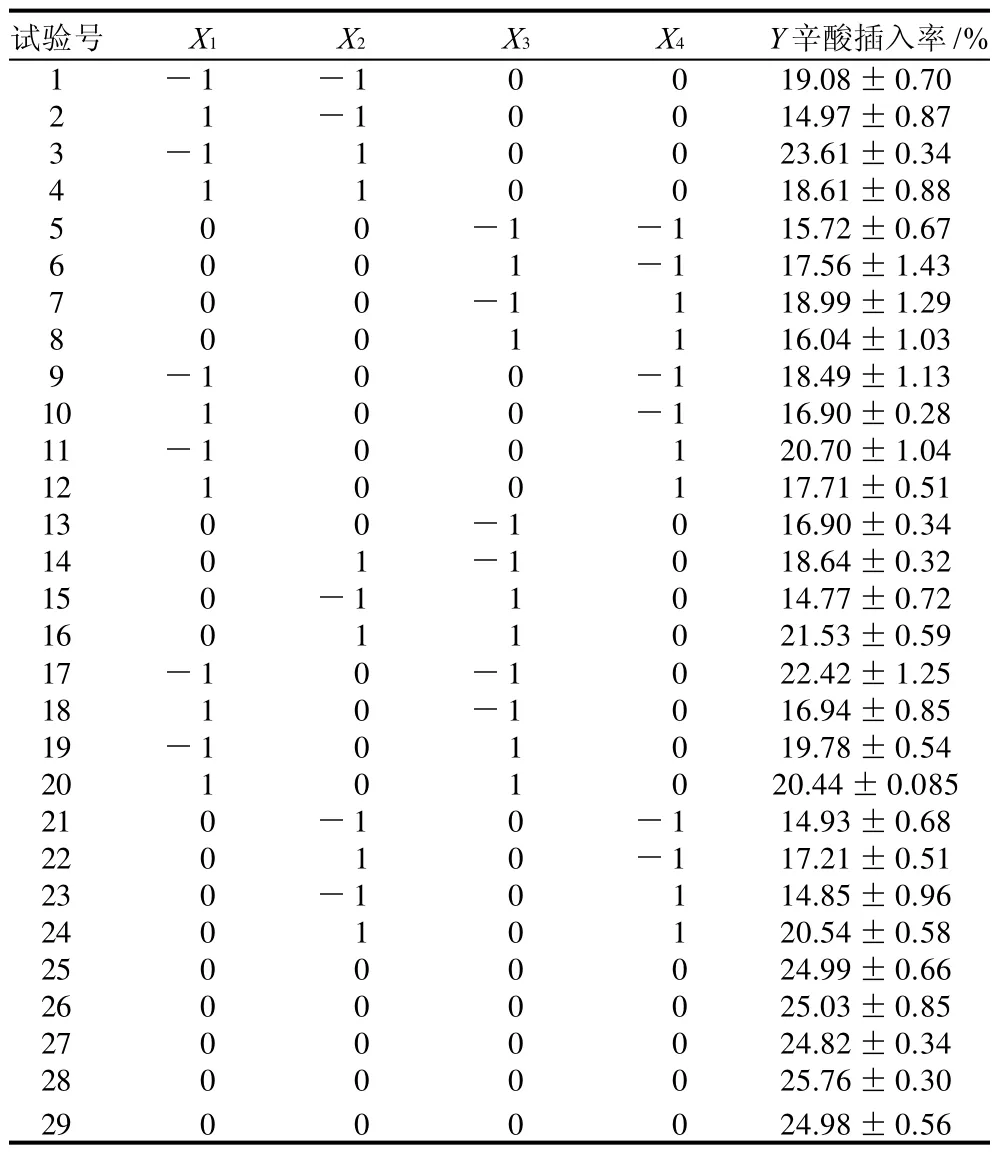
表2 酶法制备结构脂质响应面优化试验设计及结果Table 2 Design and results of response surface tests for optimizing the incorporation of caprylic acid
按表1试验方案,采用多元回归分析,拟合二次多项式回归模型的Box-Behnken设计。所有实验重复3次,结果取平均值,见表2。
2.2.2 回归模型的建立及其显著性检验
由Design-Expert 7.0 软件,通过对多项式回归分析,得到的拟合全变量二次回归方程模型为:
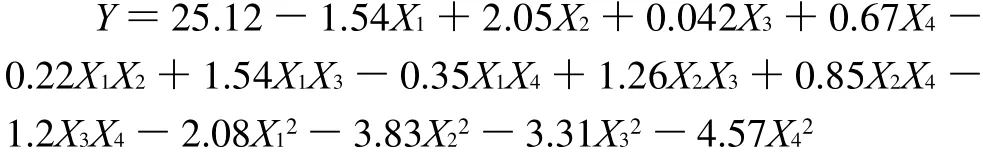
由回归方程可知,交互项的系数较小,说明响应面分析所选的4个因素之间交互作用较小。由表3可知,在α=0.01水平上,该模型失拟不显著,回归方程显著。模型的决定系数R2为98.46549%,模型的拟合程度很好,能较好地反映各因素与响应值变化的关系,可以用于结构脂质中辛酸插入率的理论预测。
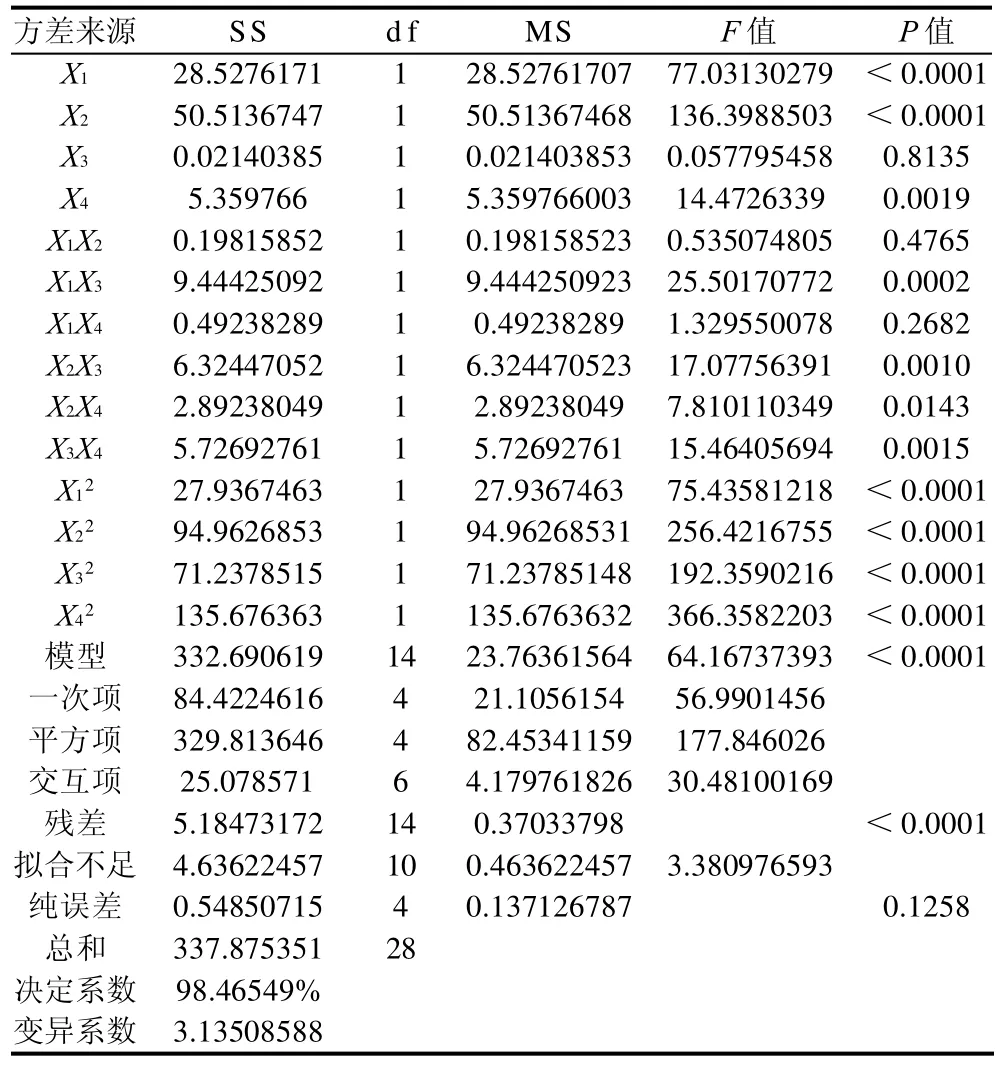
表3 回归模型的方差分析表(α=0.01,置信度99%)Table 3 Analysis of variance for the fitted quadratic regression equation
2.2.3 响应因素水平的优化及模型验证
对回归模型进行响应面分析,寻找最优组合条件,得到当底物物质的量比(菜籽油:辛酸)1:3.57、加酶量10.57%(以底物质量计)、加水量5.2%(以酶质量计)、反应温度48.6℃、反应12h后辛酸插入率的理论最高值可达到25.77%。
为了进一步验证上述模型与预定的可靠性,按上述组合条件进行验证实验,重复3次,得到辛酸的平均插入率为23.19%,与预测值很接近,说明该模型拟合较好。
3 结 论
通过响应面法优化得出最优条件为底物物质的量比(菜籽油:辛酸)1:3.57、加酶量10.57%(以底物质量计)、加水量5.2%(以酶质量计)、反应温度48.6℃。在此条件下反应12h,实测辛酸插入率为23.19%,与模型预测值25.77%非常接近。说明采用固定化脂肪酶TL IM催化菜籽油和辛酸合成结构脂质的方法过程简单,条件温和,产物易于分离,有应用生产的潜力。
[1] RUBIN M, MOSER A, VASERBERG N, et al. Structured triacylglycerol emusion, containing both medium and long-chain fatty acids, in longterm home parenteral nutrition: a double- blind randomized cross- over study[J]. Applied Nutritional Investigation, 2000, 16(2): 95-100.
[2] MU Huiling, HOY C E. The digestion of dietary triacylglycerols[J].Progress in Lipid Research, 2004, 43(2): 105-133.
[3] 刘燕萍, 李宁, 张思远. 中链甘油三酯的代谢特点及临床应用研究进展[J]. 营养, 2001, 8(1): 54-56.
[4] ROYNETTE C E, RUDKOWSKA I, NAKHASI D K, et al . Structured medium and long chain triglycerides show short-term increases in fat oxidation, but no changes in adiposity in men[J] Nutrition, Metabolism and Cardiovascular Diseases, 2008,18(4): 298-305.
[5] 王瑛瑶. 新型功能性油脂: 结构脂质的研究现状[J]. 食品研究与开发, 2008, 29(4): 162-165.
[6] 陈翔, 王瑛瑶, 栾霞, 等. 无溶剂体系中酶催化合成结构脂质条件初探[J]. 中国油脂, 2010, 35(3): 35-38.
[7] HITA E, ROBLES A, CAMACHO B, et al. Production of structured triacylglycerols by acidolysis catalyzed by lipases immobilized in a packed bed reactor[J]. Biochemical Engineering Journal, 2009, 46(3): 257-264.
[8] MARIA E C, GUILLERMO H C. Enzymatic acidolysis of sunflower oil with a palmitic-stearic acid mixture[J]. Journal of Food Engineering,2008, 84(2): 243-249.
[9] 李桂华. 油料油脂检验与分析[M]. 北京: 化学工业出版社, 2006: 107.
[10] 寇秀萍, 于国萍. 脂肪和脂肪酸甲酯化方法的研究[J]. 食品研究与开发, 2005, 26(2): 46-47.
[11] 郭玉宝, 裘爱泳, 徐霞. 酶促酯交换制备定向结构脂研究[J]. 粮食与油脂, 2001(8): 31-33.
[12] SENANAYAKE N S P J, SHAHIDI F. Enzyme-catalyzed synthesis of structured lipids via acidolysis of seal (Phoca groenlandica) blubber oil with capric acid[J]. Food Research International, 2002, 35(8): 745-752.
[13] KIMA I H, YOON C S, CHO S H, et al. Lipase-catalyzed incorporation of conjugated linoleic acid into tricaprylin[J]. Journal of the American Oil Chemists' Society, 2001, 78(5): 547-551.
[14] GARCIA H S, ACROS J A, KEOUGH K J, et al. Immobilized lipase -mediated acidolysis of butter oil with conjugated linoleic acid: batch reactor and packed bed reactorstudies[J]. Journal of Molecular Catalysis B: Enzymatic, 2001, 11(4/6): 623-632.
[15] 孟祥河, 邹东芽, 段作营, 等. 无溶剂体系中合成1,3 -甘油二酯用脂肪酶的筛选及其酯化性质的研究[J]. 无锡轻工大学学报, 2004, 23(2): 31-35.
[16] FORESTI M L, FERREIRA M L. Lipase-catalyzed acidolysis of tripalmitin with capric acid in organic solvent medium: analysis of the effect of experimental conditions through factorial design and analysis of multiple responses[J]. Enzyme and Microbial Technology, 2010, 46(6):419-429.
[17] BEKYAS I, YUCEL S, USTUN G, et al. Production of reduced calorie structured lipid by acidolysis of tripalmitin with capric acid: optimisation by response surface methodology[J]. Journal of the Science of Food and Agriculture, 2008, 88(11): 1927-1931.
Lipase-Catalyzed Acidolysis of Rapeseed Oil for Preparing Structural Lipids
SHOU Jia-fei1,PAN Li-jun1,2,*,CAO Li-li1,2,LIU Mo1
(1. School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China;2. Key Laboratory for Agricultural Products Processing of Anhui Province, Hefei 230009, China)
In this study, the lipase (fromThermomyces lanuginosa)-catalyzed acidolysis process of rapeseed oil with caprylic acid was investigated to prepare structural lipids using single factor and response surface tests. The results showed that the incorporation rate of caprylic acid reached up to 23.19% at the conditions of the molar ratio between rapeseed oil and caprylic acid of 1:3.57, immobilized lipase addition amount of 10.57%, water addition amount of 5.2%, reaction temperature of 48.6 ℃and reaction time of 12 h. This investigation will be significance for improving the additional value of rapeseed oil and extending its industry chains.
rapeseed oil;caprylic acid;acidolysis;structural lipids;response surface methodology
TS229
A
1002-6630(2012)10-0029-04
2011-05-07
“十二五”国家科技支撑计划项目(2011BAD02B04)
寿佳菲(1985— ),女,硕士研究生,研究方向为食品资源综合利用。E-mail:shoujiafei@163.com
*通信作者:潘丽军(1955—),女,教授,硕士,研究方向为农产品资源综合利用。E-mail:panlijun1955@163.com
