保加利亚乳杆菌关键糖代谢机制的研究
2012-10-25孙懿琳霍贵成
孙懿琳,田 辉,方 伟,霍贵成
(乳品科学教育部重点实验室,东北农业大学,黑龙江哈尔滨 150030)
保加利亚乳杆菌关键糖代谢机制的研究
孙懿琳,田 辉,方 伟,霍贵成*
(乳品科学教育部重点实验室,东北农业大学,黑龙江哈尔滨 150030)
以五株德氏乳杆菌保加利亚亚种为出发菌株,通过高效液相色谱法对四株后酸化强弱不同的保加利亚乳杆菌发酵的酸奶中葡萄糖、乳糖、半乳糖及乳酸的含量进行测定,通过Carrez法处理沉淀蛋白,采用Aminex HPX 87H色谱柱,5mmol/LH2SO4溶液为流动相,流速0.6mL/min。结果表明,本实验中保加利亚乳杆菌室温贮存过程中产乳酸的途径为乳糖到葡萄糖,葡萄糖通过糖酵解生成乳酸,生成的半乳糖不被利用,一直处于累积状态;后酸化强的菌株代谢乳糖和葡萄糖的含量比后酸化弱的菌株代谢量更高,乳糖代谢途径为菌株贮存期产酸关键途径。
保加利亚乳杆菌,发酵乳,糖代谢,后酸化,高效液相色谱
保加利亚乳杆菌是酸奶发酵剂中重要的菌种之一,也是导致后酸化现象发生的主要菌种,如果能够筛选出自然状况下的质量优良的弱后酸化保加利亚乳杆菌,使其在酸奶发酵时正常产生乳酸,而在低温贮存过程中具有较弱的产酸能力,可从根本上解决酸奶后酸化问题[1]。目前通过改善工艺水平控制后酸化的方法很多,但都不能从根本上解决后酸化问题[2],而诱变育种及基因工程的遗传稳定性受到多因素影响和制约[3-4]。我国拥有丰富的乳酸菌资源,且拥有年销售额上百亿的酸奶市场,完全可以不断筛选出更好的功能性菌株,这是解决酸奶后酸化的长远大计。酸乳发酵菌种主要包括德氏乳杆菌保加利亚亚种与嗜热链球菌,研究表明,此二株菌对乳糖的代谢方式为同型乳酸发酵,乳糖经透膜酶被转运到细胞内,经β-半乳糖苷酶催化,产生葡萄糖和半乳糖,葡萄糖经糖酵解途径生成乳酸和三磷酸腺苷;而半乳糖不被利用,被排除细胞外[5-6]。RobertW Hutkins等[7]认为乳糖与半乳糖通过反向转座子运输,来维持乳酸菌的新陈代谢平衡。研究德氏乳杆菌保加利亚亚种的糖代谢机制,对于开发一种弱后酸化的酸乳发酵剂具有重要意义。本文主要目标是从实验室菌株中筛选出天然的弱后酸化保加利亚乳杆菌,采用高效液相色谱法利用Am inex HPX 87H分析柱对菌株在代谢乳糖,半乳糖和葡萄糖量的测定和对比中,找出酸奶贮藏过程中菌株可以通过哪些途径代谢糖产酸,找出酸奶贮藏过程中菌株代谢糖产酸的关键途径,从而为有针对性的控制酸奶后酸化问题,为直投式弱后酸化酸奶发酵剂的制备提供一定的理论指导。
1 材料与方法
1.1 材料与仪器
菌种 实验菌株为德氏乳杆菌保加利亚亚种KLDS-1.0207、KLDS-1.1009、KLDS-1.1005、KLDS-1.1006、KLDS-1.1011,自行从弱后酸化商业发酵剂中分离的保加利亚乳杆菌命名为G-495;培养基 MRS培养基和11%(w·v-1)脱脂乳培养基;乳糖、葡萄糖、半乳糖和乳酸 Sigma公司,色谱纯;亚铁氰化钾、乙酸锌和冰乙酸等其他化学试剂 均为分析纯。
Delta 320精密pH计 Mettler Toledo公司;GL-21M高速冷冻离心机 上海市离心机械研究所;HPLC Waters 2695高效液相色谱仪 美国Waters公司;Aminex HPX 87H分析柱(300mm×7.8mm,9μm) 美国Bio-Rad公司。
1.2 实验方法
1.2.1 弱后酸化菌株的筛选 a.初筛:将15株实验室菌株以3%接种于MRS液体培养基中,每隔2h取样,测定pH,OD600nm,从中筛选出生长速度差异较大的菌株。
b.复筛:将生长速度差异较大的菌株接种至11%的脱脂乳中,做单菌发酵实验,检测菌株在4℃贮存过程中的后发酵能力,从中筛选出后酸化强弱差异较大的菌株。
c.对照菌株:自行从商业发酵剂中分离出的菌株G-495为弱后酸化保加利亚乳杆菌,不经过筛选,直接作为后期糖代谢实验的标准对照菌株。
1.2.2 脱脂乳发酵酸奶的制作 将活化好的保加利亚乳杆菌以5×106cfu/m L的接种量接入11%脱脂乳中充分混匀、迅速分装至无菌小烧杯中,于42℃培养箱中发酵,待pH达到4.5,立即终止发酵,4℃后熟24h,将发酵乳移至25℃培养箱,加速后酸化,贮藏10d。
1.2.3 低温贮存过程中酸度的测定[8]测定单菌发酵的酸奶在4℃贮存过程中酸度的变化情况。滴定酸度采用GB 5413.34-2010,pH测定方法采用Delta 320精密pH计直接测定。
1.2.4 室温后酸化贮存过程中乳糖、葡萄糖、半乳糖和乳酸的测定[9-10]采用高效液相色谱技术对保加利亚乳杆菌单菌发酵乳在25℃贮存下,1、4、10d的葡萄糖、乳糖、半乳糖及乳酸含量进行高效液相色谱分析,每组三个平行。
样品处理:采用Carrez法对样品进行处理。称取均匀保加利亚乳杆菌单菌发酵乳样品5.0000g(精确至0.1mg),加25g水溶解,缓慢加入CarrezⅠ溶液和CarrezⅡ溶液各2.5m L,加水使溶液质量为50.0000g(精确至0.1mg),磁力搅拌30m in,放置室温后5000r/m in离心15m in,获上清液并用0.22μm微孔滤膜过滤以去除蛋白及细菌菌体,-20℃保存。其中CarrezⅠ溶液:称取10.6g亚铁氰化钾,加水溶解至100m L;CarrezⅡ溶液:称取21.9g乙酸锌加3m L冰乙酸,加水溶解并稀释至100m L[13]。
机器参数:Bio-Rad Aminex HPX 87H(300mm× 7.8mm,9μm)色谱柱,RID214示差折光检测器,5mmol/L H2SO4流动相,流速0.6m L/m in,温度为65℃,进样量10μL,每个样品检测时间13m in。
标准曲线的绘制:用流动相为溶剂,精确配制葡萄糖为0.5~2.5mg/m L,乳糖为4~12mg/m L,半乳糖为1~5mg/m L,乳酸为2.5~7.5mg/m L,用0.22μm滤膜过滤于样品瓶中,以标准品含量(mg/m L)为横坐标,吸收峰面积为纵坐标,绘制标准曲线。
2 结果与讨论
2.1 弱后酸化菌株
2.1.1 初筛 从15株实验室菌株中筛选出5株生长速度差异较大的菌株。生长曲线如图1所示。
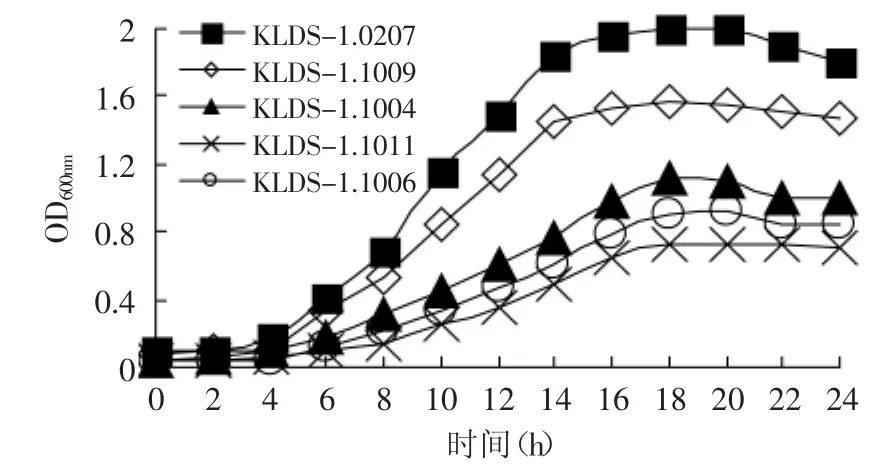
图1 五株菌的生长曲线Fig.1 Growth curve of the five strains
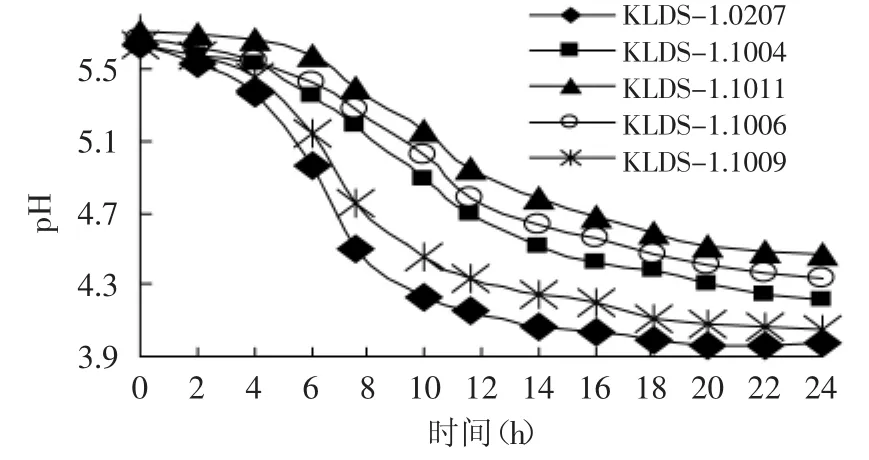
图2 五株菌的pH变化曲线Fig.2 pH curve of the five strains
菌株的生长速度与菌株的代谢和产酸有直接关系,菌株较低的生长能力也导致了其较弱的产酸能力,所以将生长速度作为筛选弱后酸化菌株的第一个标准。由图1、图2可知,菌株24h的产酸情况与细胞密度一致,其中生长较快的菌株24h后的pH达到3.9~4.1,光密度值(OD600)为1.6~1.8;而生长较慢的菌株pH为4.3~4.6,光密度值(OD600)仅为0.8~1.0,这是因为H+-ATPase活性可以调节德氏乳杆菌保加利亚亚种的能量代谢和菌株自身的生长,生长较慢的菌株可能是由于其H+-ATPase较弱,使得底物磷酸化水平较低[11],因此ATP的产量也随之减少,导致了菌株的低生长率和弱产乳酸能力[12]。经过初筛后,从实验室菌株中筛选出生长速度慢的菌株KLDS-1.1006、KLDS-1.1011和KLDS-1.1004,生长速度快的菌株KLDS-1.0207和KLDS-1.1009。
2.1.2 复筛 从5株生长速度差异较大的菌株中筛选出2株弱后酸化菌株,并以1株后酸化较强的菌株作为对照菌株,酸度变化曲线如图3所示。
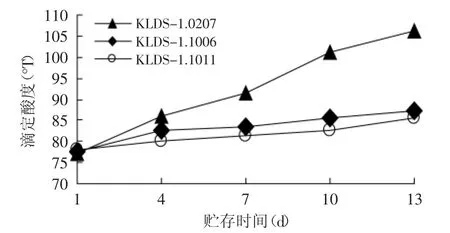
图3 贮存期间三株菌的滴定酸度变化曲线Fig.3 Acidity curve of the three strains in the storage duration
Donkor[13]认为高质量的酸奶在消费者消费时,其pH应为4.2~4.3,国标GB 19302-2010对酸奶及其制品规定:酸度为≥70°T(乳酸度为≥0.63)。由图3、图4可知,三株生长速度相差很大的实验室菌株的后酸化程度差异很大,KLDS-1.0207在贮存13d后发生了严重的后酸化,pH达到4.15,滴定酸度达到110°T,而两株生长速度缓慢的菌株KLDS-1.1006和KLDS-1.1011在贮存期间pH变化趋势平缓,在贮存13d后,pH仍能维持在4.5左右,滴定酸度在86~89°T之间,增长量不足10°T。故经过复筛后,筛选出KLDS-1.1006和KLDS-1.1011为野生弱后酸化保加利亚乳杆菌。
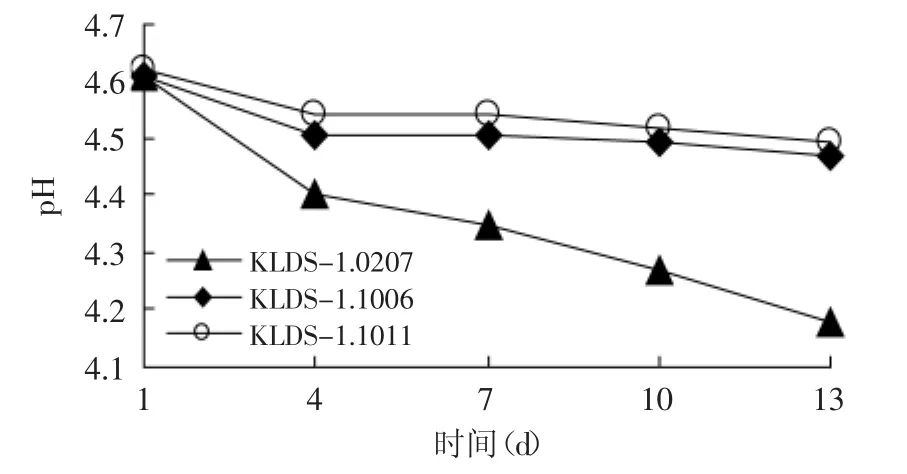
图4 贮存期间三株菌pH变化曲线Fig.4 pH curve of the three strains in the storage duration
2.2 乳糖、葡萄糖、半乳糖和乳酸的含量分析
2.2.1 标准曲线 标准样品的回归方程、相关系数见表1,由表1可知各组分的质量浓度0.5~12mg/m L与峰面积呈现良好的线性关系,相关系数在0.9997~0.9999之间,可见,标准曲线具有较高精确度,符合定量要求。

表1 标准曲线的线性Table 1 The linearity of standard curve
2.2.2 混合标准品及样品高效液相色谱图 葡萄糖和半乳糖互为手性同分异构体,一般色谱技术很难将它们分开,但是离子交换树脂柱Aminex HPX 87通过离子调节分配层析技术分离不同化学特性的混合物,可以很好地分离各种糖类物质并准确定量[14],本实验采用Am inex HPX 87分离柱很好地将两者分开。混合标准品色谱分离图见图5。
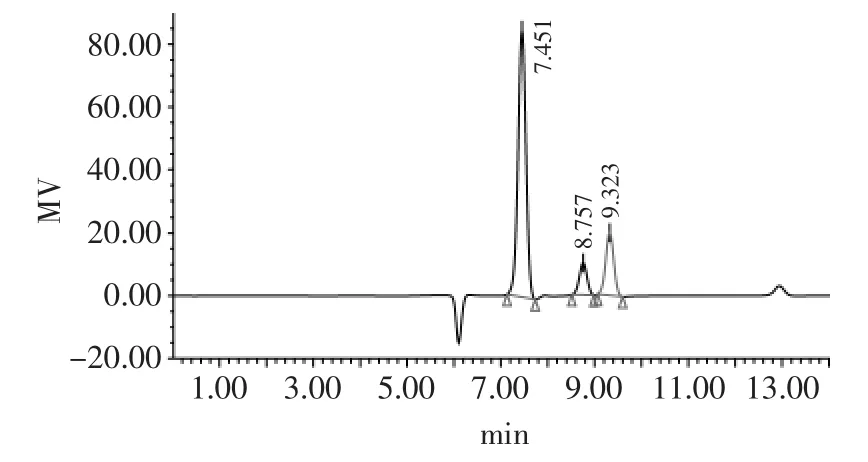
图5 乳糖、葡萄糖、半乳糖标准样品的高效液相色谱图Fig.5 HPLC chromatogram ofmixed sugar standards
本实验中选取Carrez法处理样品,方法简单快速,能消除杂质对样品的潜在影响,排除干扰能力强;不同的流速和柱温对样品分离时间会有很大影响[15],本实验中样品分离时间仅为13min,能很好得将葡萄糖和半乳糖分开。样品分离图见图6。

图6 Carrez法处理样品后的色谱图Fig.6 HPLC chromatogram of fermented milk
2.2.3 乳糖、葡萄糖、半乳糖和乳酸的含量分析 因为要找出乳酸菌代谢乳糖产酸的关键途径,所以需测定各菌株的糖和酸在贮藏期的变化,找出后酸化强弱不同的菌株对关键糖代谢量的差别,所以对受试菌株的选择和测定天数是很重要的。本实验选取25℃为贮存温度,可以更快更明显的反映出菌株的后酸化能力,而菌株在0~2d贮存中的pH下降极快,在第4d是真正决定后酸化强弱的关键一天[16],故本实验分别测试在25℃贮藏第1、4、10d发酵乳中的葡萄糖、半乳糖、乳糖和乳酸的量,表2~表4为根据HPLC对各菌株代谢糖产酸量的结果,分别计算出各菌在1~4d和1~10d内的乳糖代谢量,半乳糖的积累量及乳酸的生成量。
由表2~表4可知,菌株贮存过程中的糖代谢与产酸是完全相对应的,即消耗乳糖量越多,生成乳酸量则越多;其中前4d的糖代谢量较大,乳糖消耗量和半乳糖的积累量均占10d内整体消耗量的大部分,尤其是对于后酸化弱的菌株来说,前4d的乳酸生成量与前10d的乳酸生成量相差不大,这进一步证明了前4d是贮存期菌株产酸的关键时期;在贮存后期(6~10d),后酸化弱的菌株糖代谢率低,产酸缓慢;后酸化强的菌株则继续快速代谢糖产酸。
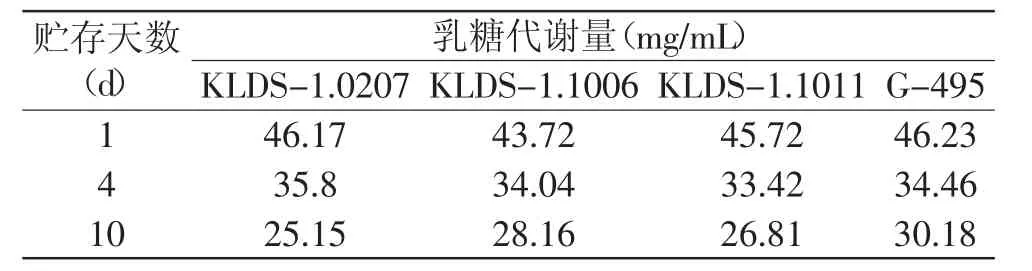
表2 高效液相色谱法(HPLC)测定单菌发酵酸奶中乳糖含量Table 2 Changes in lactose contents in fermented milk during storage as determined by the HPLCmethod
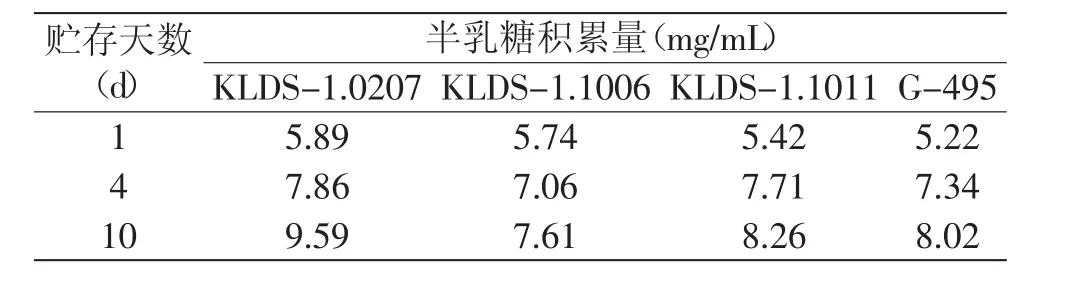
表3 高效液相色谱法(HPLC)测定单菌发酵酸奶中半乳糖含量Table 3 Changes in galactose contents in fermented milk during storage as determined by the HPLCmethod

表4 高效液相色谱法(HPLC)测定单菌发酵酸奶中乳酸含量Table 4 Changes in lactic acid contents in fermented milk during storage as determined by the HPLCmethod
在乳糖酶存在的情况下,乳糖的水解伴随着半乳糖的释放,其中,葡萄糖通过类似于PTS系统转运,乳糖和半乳糖通过通透酶系统转运[17]。Terence Thomas、Vaughan Crow和Rob Hutkins均曾报道过嗜热链球菌自发突变株可以在半乳糖作为唯一碳源的环境中生长,而其他大多数的乳酸菌均只能代谢乳糖和葡萄糖[18],菌株不能利用半乳糖,部分原因可能是其不能合成调节Leior途径的足够数量的半乳糖激酶,另一方面也可能是由于乳糖-半乳糖的反向转座子运输竞争抑制了半乳糖激酶的酶活[19]。本实验结果中半乳糖从贮存开始就一直在积累,随着时间的延长,半乳糖的含量逐渐增多,这也和Robert等认为的保加利亚乳杆菌选择性代谢半乳糖的观点是一样的[5-7];乳酸菌产酸的另一个关键就是葡萄糖经糖酵解途径生成乳酸,葡萄糖反应的量应等于乳酸生成的量,而本实验中并未检测到葡萄糖的含量,这是因为葡萄糖经乳糖水解生成后,立即通过EMP途径瞬间转化而不会排放到胞外,因此含量极低未到HPLC检出限[20],这和很多研究者认为的贮存过程中葡萄糖的量极低或者根本检测不出来[21-22]是一致的,其中Richmond[14]研究表明发酵乳贮藏至50d才可检测到葡萄糖且痕量。
碳源迅速有效的利用是快速产酸、pH急剧下降的主要因素[23]。后酸化强的菌株KLDS-1.0207代谢乳糖量和半乳糖积累量远远超过了后酸化程度弱的KLDS-1.1006和G-495,而后酸化较弱的KLDS-1.1001代谢乳糖量和半乳糖积累量均较低,可见菌株表现出来的后酸化差异与它们的乳糖代谢有直接关系。A lm[24]研究表明,在贮存11d的酸奶制品中,乳糖含量从最初的非发酵乳中4.8g/100g降低到酸奶中的2.3g/100g,而半乳糖则由原来的微量增加到发酵结束后的1.3g/100g;李琦[10]报道,嗜热链球菌发酵乳室温贮存10d后,乳糖含量从新鲜酸乳的50.01mg/m L下降至42.93mg/m L,而本实验中四株保加利亚乳杆菌单菌发酵乳在25℃贮存10d后,乳糖的含量分别降低了35%~43%,半乳糖的含量分别增加了26%~35%(和第一天相比),理论上乳糖的吸收量和半乳糖的释放量是在同等摩尔下进行的[25],但从我们的实验结果来看,生成的半乳糖的量并不是乳糖消耗量的一半,这是因为还有一部分细胞内的半乳糖没有被测出来的原因。
由实验结果可以得出,乳糖经β-半乳糖苷酶代谢分解这一步对于贮藏过程中保加利亚乳杆菌代谢产酸来讲尤为重要,同时糖代谢结果进一步验证了本实验中筛选出的菌株KLDS-1.1006和KLDS-1.1001是弱后酸化菌株。
3 结论
3.1 低温贮存期间,由于乳中的乳酸菌可继续代谢乳糖产酸,导致酸度增加,使产品出现消费者不可接受的过酸味及其他感官质量下降的现象,目前控制后酸化的方法较多,虽有一定效果,但成本均较高。本实验中筛选出的天然弱后酸化菌株KLDS-1.1006及KLDS-1.1011,性状稳定,生产上操作简单,可降低成本,且贮存期间pH缓慢下降,可保证乳制品酸味适中,口感良好,符合消费者的需求,拥有广阔的市场前景。
3.2 通过高效液相色谱法测定出保加利亚乳杆菌单菌发酵乳在后酸化贮存中产酸关键途径为乳糖到葡萄糖,葡萄糖通过糖酵解在乳酸脱氢酶的作用下生成乳酸,其并不能利用半乳糖;本实验中后酸化强的菌株代谢乳糖和葡萄糖的含量比后酸化弱的菌株代谢量均高,可见,菌株的糖代谢量与产酸多少有直接的关系,即糖代谢量多,产酸多,后酸化强,故可通过检测糖代谢量来判断菌株的后酸化强弱。通过确定的菌株代谢糖产酸的关键途径,可为进一步解决酸奶后酸化问题提供理论指导。
[1]徐成勇,郭本恒,吴昊,等.酸奶发酵剂和乳酸菌生物技术育种[J].中国生物工程杂志,2004,24(7):55-59.
[2]徐成勇,吴昊,郑思聪,等.酸乳后酸化影响因子的初步研究[J].食品与发酵工业,2006,32(12):10-14.
[3]Mollet B,Delley M.Spontaneous deletion formation within the beta-galactosidase gene of lactobacillus bulgaricus[J].J Bacteriol,1990,172:5670-5676.
[4]Sienna Y,Robin M A,Stanley E M,et al.Generation and characterization of environmentally sensitive variants of the betagalactosidase from Lactobacillus delbrueckii subsp.bulgaricus[J]. Appl Envir Microbiol,1994,60:1221-1226.
[5]郭清泉.酸奶发酵机理及后酸化控制措施[J].食品与发酵工业,2001,27(2):80-83.
[6]孟昭赫.乳酸菌与人体健康[M].北京:人民卫生出版社,1993:36-42.
[7]RobertW,Hutkins,Nancy LNannen.pH homeostasis in lactic acid bacteria[J].Dairy Sci,1993,76(8):2354-2365.
[8]江汉湖.食品微生物学[M].北京:中国农业出版社,2002.
[9]INDYK H E,EDWARDS M J,WOOLLARDB D C.High performance liquid chromatographic analysisof lactose-hydrolysed milk[J].Food Chemistry,1996,57(4):575-580.
[10]李琦.高效液相色谱法测定发酵乳中的乳糖、葡萄糖和半乳糖[J].食品科学,2012(4):162-166.
[11]DAVE R I,SHAH N P.Viability of yogurt and probiotic bacteria in yogurtsmade from commercial starter cultures[J].Int Dairy J,1997,7(8/9):31-41.
[12]O N Donkor,A Henriksson,T Vasiljevic,et al.Effect of acidification on theactivity of probiotics in yoghurt during cold storage[J].International Dairy Journal,2006,16(10):1181-1189.
[13]刘飞,杜鹏,王玉堂.德氏乳杆菌保加利亚亚种H+-ATPase缺陷型菌株的筛选[J].微生物学报,2009,49(1):38-43.
[14]RICHMOND M L,BARFUSS D L,HARTE B R,et al. Separation of carbohydrates in dairy products by high performance liquid chromatography[J].Journal of Dairy Science,1982,65(8):1394-1400.
[15]Deborah A Hyman.Development and validation of a fast high pressure liquid chromatography method for the analysis of lignocellulosic biomass hydrolysis and fermentation products[J]. Journal of Chromatography A,2010:2082-2087.
[16]李琦.低pH条件下嗜热链球菌产酸关键酶及控制研究[D].哈尔滨:哈尔滨工业大学,2010.
[17]Hickey MW,Hillier AJ,Jago GR.Trans-port and metabolism of lactose,glucose and galactose in homofermentative lactobacilli [J].Appl Environ Microbio,1986,51:825-831.
[18]Aat Ledeboer,Jeroen Hugenholtz,Jan Kok,etal.Thirty years of research on lactic acid bacteria[M].Holland:Max Blngham,2011.
[19]ROBERTW HUTKINS,CARINA PONNE.Lactose uptake driven by galactose efflux in streptococcus thermophilus:Evidence for a galactose-lactose antiportert[J].Applied and Environmental Microbiology,1991:941-944.
[20]VALVERDE V C,VILLA CM,HERRANZ J.Determination of soluble carbohydrates in yogurts by high performance liquid chromatography[J].JournalofDairy Science,1983,67(4):759-763.
[21]LI B W,SCHUHMANN P J,HOLDEN J M,et al. Determination of sugars in yogurt by gas-liquid chromatography [J].Journal of Agricul-tural and Food Chemistry,1983,31(5):985-989.
[22]RICHMOND M L,HARTE B R,GRAY J I,et al. Determination of sugars in yogurt and microbiologicalmedia by high performance liquid chromatography during processing and subsequent storage[J].Journal of Dairy Science,1987,70(6):1140-1147.
[23]RGINIA SO’LEARY,JOHN H WOYCHIK.Utilization of lactose,glucose,and galactose by amixed culture of streptococcus thermophilus and lactobacillus bulgaricus in milk treated with lactase enzyme[J].Applied and Environmental Microbiology,1976(7):89-94.
[24]ALM L.Effect of fermentation on lactose,glucose and galactose content in milk and suitability of fermented milk products for lactose intolerant individuals[J].Journal of Dairy Science,1982,65(3):345-352.
[25]Tinson W,M F Ratcliff,A JHillier,et al.Metabolism of Streptococcus thermophilus I.utilization of lactose,glucose,and galactose[J].Aust JDairy Technol,1982,37:8-13.
Study on the key glycometabolism of Lactobacillus delbrueckiisubsp.Bulgaricus
SUN Yi-lin,TIAN Hui,FANG W ei,HUO Gui-cheng*
(Key Lab of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
Five Lactobacillus delbrueckii subsp.bulgaricus strains were regarded as the research sub ject,an HPLC method for the determ ination of lactose,g lucose and galactose in fermented m ilk was estab lished. Proteins from sam p les were p recipitated w ith Carrez reagent.The chromatog raphic separation was achieved on an Am inex HPX 87H column using 5mmol/L H2SO4as mobile phase at a flow rate of 0.6m L/m in.Results demonstrated that the metabolism of Lac tobacillus delbrueckiisubsp.bulgaricus was from lac tose to g lucose,the latter would be transferred into lactic acid,they had inability to uilize galac tose.The strains which had strong ability of metabolizing g lucose and lactose also showed serious postacidification.The metabolic pathway from lactose to lactic acid was the crucial fac tor that results in postacid ification of yogurt.
Lactobacillus delb rueckiisubsp.bulgaricus;fermented m ilk;g lycometabolism;postacid ification;high p ressure liquid chromatog raphy(HPLC)
TS201.3
A
1002-0306(2012)20-0202-05
2012-05-21 *通讯联系人
孙懿琳(1987-),女,硕士研究生,研究方向:乳品科学与工程。
教育部长江学者和创新团队发展计划项目(IRT0959);国家自然基金项目(31171717)。
