Bβ448野生型及突变型纤维蛋白原稳定转染细胞系的建立
2012-10-25李积凤牛梦林
林 媛 李积凤 刘 杰 牛梦林 孙 然 王 军 刘 岩 王 辰
(1.首都医科大学附属北京朝阳医院呼吸与危重症医学科,北京市呼吸和肺循环疾病重点实验室,北京呼吸疾病研究所,北京 100020;2.首都医科大学基础医学院生理学教研室,北京 100069;3.卫生部北京医院,北京 100730;4.首都医科大学附属北京朝阳医院心外科,北京 100020)
纤维蛋白原(fibrinogen)由Aα、Bβ、γ三对多肽链组成,分别由3个独立的基因编码:FGA、FGB和FGG[1]。其中Bβ链的合成是整个分子合成的限速步骤[2],且Bβ链基因多态性是导致个体间血浆纤维蛋白原水平差异的重要遗传因素,同时也与心脑血管疾病存在密切的相关性。BβArg448Lys是纤维蛋白原较常见的基因多态性之一,相关研究表明BβArg448Lys与心肌梗死[3]、冠状动脉粥样硬化性心脏病(以下简称冠心病)[4]及中国香港人高血压[5]的发病有关。BβArg448Lys的位置靠近以下3个重要区域:预测的β链聚合点、β链和α链羧基端结合的区域及β链的钙离子结合部位,这3个区域在纤维蛋白聚合过程中起重要作用[6-7],故推测此突变位点参与调节纤维蛋白聚合进而影响纤维蛋白凝块的结构与功能。以往有关BβArg448Lys基因多态性的研究多集中于病例对照研究,但一个基因位点的突变能否真正影响整个纤维蛋白原分子的功能,需要进一步的功能学实验证据。而功能学研究的重要步骤之一就是要构建纤维蛋白原稳定表达细胞系。为此本研究通过借助体外重组技术,探讨了构建野生型(BβArg448)和突变型(BβLys448)纤维蛋白原稳定表达细胞系的方法,为探讨BβArg448Lys所致纤维蛋白原的结构与功能异常奠定基础,进而为其相关血栓性疾病的研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 质粒、宿主菌、细胞
人纤维蛋白原Aα链全长cDNA、Bβ链全长cDNA、γ链全长 cDNA的表达载体 pRSV-FGA、pMLPFGB、pRSV-FGG均由美国北卡罗来纳大学教堂山分校Susan T.Lord教授惠赠。宿主菌E.coli DH5α及CHO-K1细胞均为本实验室保存。
1.1.2 主要试剂
脂质体(Lipofectamine 2000)购自 Invitrogen公司;G418购自北京欣经科生物科技有限公司;组氨醇(Histidinol)、RNA提取试剂TRIzol购自Sigma公司;DMEM-F12培养基、胎牛血清购自Gibco公司;AMV反转录酶、限制性内切酶Dpn I、Pfu Turbo DNA聚合酶、ExTaq DNA聚合酶、600 bp DNA marker购自TaKaRa公司;QuikChange Site-Directed Mutagenesis Kit购自Stratagene公司;质粒大量提取试剂盒购自天根生化科技有限公司;PCR引物均由Invitrogen公司合成;其他试剂均为国产分析纯。
1.2 方法
1.2.1 定点突变构建人工突变体 BβLys448的表达载体pMLP-FGB(448A)
根据突变位点设计并合成一对互补引物,上游引物:5'-GGAAGGGGTCATGGTACTCAATGAAGAAGATGAGTATG-3';下游引物:5'-CATACTCATCTTCTTCATTGAGTACCATGACCCCTTCC-3',以 pMLP-FGB(448G)为模板,按照QuikChange Site-Directed Mutagenesis Kit方法,PCR扩增人工突变体BβLys448的表达载体pMLP-FGB(448A)。PCR反应条件为:95℃预变性30 s,95℃变性30 s,55℃退火1 min,68℃延伸10 min,共12个循环。PCR产物经DpnI在37℃下酶切1 h,直接取1 μL酶切产物转化入E.coli XL1-Blue感受态细胞,蓝白斑筛选后挑白斑单菌落培养扩增,保存菌株,提取质粒并送Invitrogen公司测序鉴定。
1.2.2 建立稳定转染细胞系
将CHO-K1细胞置于含10%胎牛血清,1×105U/L青霉素和0.1 g/L链霉素的DMEM-F12培养基(完全培养基)中,接种于直径为100 mm的培养皿中,5%CO2培养箱37℃培养,待细胞融合至80% ~90%时,用于细胞转染。
首先将正常CHO-K1细胞接种于24孔板,检测G418的1周最小致死浓度,重复3次,确定细胞G418的1周最小致死浓度为600 mg/L。
8 μg DNA(4 μg pRSV-FGA+4 μg pRSV-FGG)及 16 μL脂质体分别溶于200 μL无血清培养基,混匀室温静置5 min,混合稀释的DNA和脂质体,室温静置20 min,移去细胞培养皿内含血清的正常培养基,PBS清洗后替换为4.6 mL无血清培养基,将稀释的DNA与脂质体的混合物加入培养皿中,轻轻混匀。5%CO2培养箱37℃培养4 h后将无血清培养基更换为10 mL完全培养基。24 h后将细胞1∶10稀释接种于10个直径为100 mm的培养皿中。24 h后更换培养液,加G418(600 mg/L),每2 d换液1次,1周后改用200 mg/L的G418维持筛选,4周后抗性克隆初步形成。显微镜下挑出单个细胞集落于24孔板中,并对应标记,避免单克隆之间的污染,分别逐步扩大培养。每个单克隆细胞株分别做RT-PCR鉴定,检测出同时显示表达纤维蛋白原Aα链与γ链的单克隆细胞株,继而扩大培养,维持G418(200 mg/L)选择压力,每3 d换液或传代,即得到稳定表达纤维蛋白原Aα链与γ链的细胞株CHO-K1-Aα-γ。
同理,将 CHO-K1-Aα-γ细胞接种于24孔板,检测组氨醇的1周最小致死浓度,重复3次,确定细胞组氨醇的1周最小致死浓度为300 mg/L。
按上述方法将 pMLP-FGB(448G)8 μg、pMLP-FGB(448A)8 μg分别转染于 CHO-K1-Aα-γ 细胞,加组氨醇300 mg/L,G418 200 mg/L,每2 d换液1 次,1 周后改用组氨醇100 mg/L,G418 200 mg/L维持筛选,4周后同时抗组氨醇与G418的抗性克隆初步形成。在细胞密度达80%时,移至培养瓶中传代扩增,维持组氨醇100 mg/L+G418 200 mg/L的选择压力,每3 d换液或传代,从而培养稳定表达野生型(BβArg448)与突变型(BβLys448)纤维蛋白原的细胞系CHO-K1-fibrinogen(BβArg448)、CHO-K1-fibrinogen(BβLys448)。
1.2.3 RT-PCR鉴定稳定转染细胞系
收集持续传代的稳定表达野生型与突变型纤维蛋白原细胞株 CHO-K1-fibrinogen(BβArg448)、CHOK1-fibrinogen(BβLys448)和未转染质粒的CHO-K1细胞,根据TRIzol一步法分别提取细胞总RNA,用全波长酶标仪和琼脂糖电泳检测RNA纯度、浓度及完整性。采用TaKaRa试剂盒,以(Oligo)dT为引物,在AMV反转录酶作用下反转录生成cDNA,-20℃保存备用或立刻用于PCR。在20 μL反应体系中加入cDNA 模板 1 μL,10 × PCR 缓冲液 2.0 μL,dNTP(25 mmol/L)1.0 μL,上下游引物(10 μmol/L)各 0.8 μL,ExTaq DNA 多聚酶0.1 μL,H2O 补足至20 μL。反应条件如下:95℃预变性5 min,95℃ 30 s,56℃退火30 s,72℃延伸30 s,35个循环,72℃继续延伸10 min,置4℃保温。取等体积RT-PCR产物进行1%琼脂糖凝胶电泳并进行紫外成像。
FGA上游引物:5'-ATCTGCCTGCAAAGATTCAGAC-3',下游引物:5'-CCTACTGCATGACCCTCGAC-3';FGB上游引物:5'-ATCCCAACTAACCTTCGTGTG-3',下游引物:5'-TCTTGACGGTTCTGAATCACT-3';FGG上游引物:5'-TCAAGACATTGCCAATAAGGGA-3',下游引物:5'-GTCACTAGGATCATCGCCAA-3'。
2 结果
2.1 突变型BβLys448纤维蛋白原表达载体pMLPFGB(448A)质粒的鉴定
DNA测序结果(图1)显示FGB448位碱基序列已由原来编码精氨酸(Arg)的AGG成功地突变为编码赖氨酸(Lys)的AAG,且无其他基因的错读及错配。表明成功构建了人工突变体pMLP-FGB(448A)。

图1 野生型(A)与突变型(B)纤维蛋白原表达载体pMLP-FGB核苷酸序列比对Fig.1 Nucleotide blast of wild type(A)and mutant type(B)fibrinogen expression vector pMLP-FGB
2.2 稳定转染细胞系的筛选
pRSV-FGA及pRSV-FGG转染CHO-K1细胞,G418维持筛选后,抗 G418(图2A)细胞克隆初步形成。RT-PCR鉴定筛选出同时表达纤维蛋白原Aα链与γ链的单克隆细胞株,继而转染pMLP-FGB(448G)/pMLP-FGB(448A),G418与组氨醇维持筛选后,同时抗G418与组氨醇(图2B、C)的细胞克隆初步形成。
2.3 稳定转染细胞系 CHO-K1-Aα-γ、CHO-K1-fibrinogen(BβArg448)、CHO-K1-fibrinogen(BβLys448)鉴定结果
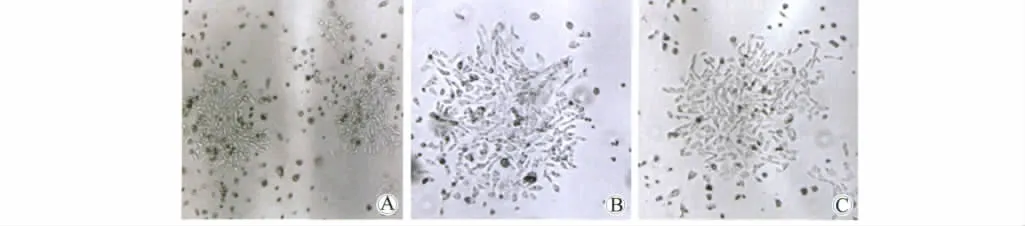
图2 稳定转染细胞系的筛选Fig.2 Screening of stably transfected cell clones
稳定转染细胞系CHO-Aα-γRT-PCR结果显示,可以扩增得到FGA 427 bp及FGG 445 bp的特异性条带(图 3)。稳定转染细胞系 CHO-K1-fibrinogen(BβArg448)(野生型)、CHO-K1-fibrinogen(BβLys448)(突变型)RT-PCR结果显示,可以扩增得到FGA 427 bp、FGB 290 bp及FGG 445 bp的特异性条带(图4、5),且全部经测序确定。而在未转染质粒的CHO细胞中,FGA、FGB、FGG均未有mRNA水平的表达,表示稳定转染细胞系CHO-K1-Aα-γ、CHO-K1-fibrinogen(BβArg448)、CHO-K1-fibrinogen(BβLys448)在转录水平构建成功。

图3 稳定转染细胞(CHO-K1-Aα-γ)与未转染质粒的CHO-K1细胞RT-PCR检测结果Fig.3 RT-PCR results of stable transfected cells CHO-K1-Aα-γ and untransfected CHOK1 cells
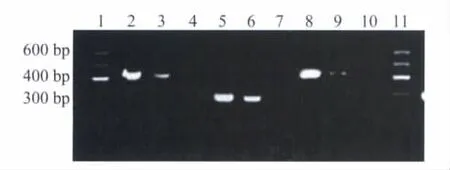
图4 野生型纤维蛋白原稳定转染细胞CHOK1-fibrinogen(BβArg448)与未转染质粒的CHO-K1细胞RT-PCR检测结果Fig.4 RT-PCR results of stable transfected cells CHO-K1-fibrinogen(BβArg448)and untransfected CHO-K1 cells
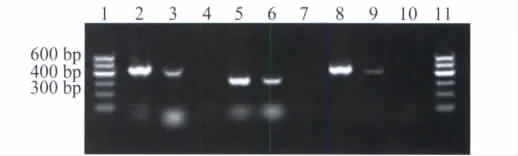
图5 突变型纤维蛋白原稳定转染细胞CHOK1-fibrinogen(BβLys448)与未转染质粒的CHO-K1细胞RT-PCR检测结果Fig.5 RT-PCR results of stable transfected cells CHO-K1-fibrinogen(BβLys448)and untransfected CHO-K1 cells
3 讨论
纤维蛋白原(fibrinogen)是一种相对分子质量为340 000的糖蛋白,由肝细胞合成并分泌。每一个纤维蛋白原分子由3对非等同的多肽链Aα,Bβ和γ组成[8]。纤维蛋白原作为凝血系统中含量最高的凝血因子,是凝血系统的主要成分,是整个凝血过程的底物[9]。
纤维蛋白原的基因多态性与多种疾病的发生相关[10-11]。BβArg448Lys是纤维蛋白原研究较多的基因多态性之一。Behague I等[4]通过血管造影术评估冠状动脉疾病患者(CAD)时发现,三支血管病变的病人BβLys448等位基因频率高于双支、单支血管病变的CAD患者。Carter A M等[12]对305例急性脑卒中患者及197例健康对照进行的病例研究发现,BβArg448Lys位点基因型频率及等位基因频率在女性脑卒中患者组与女性健康对照组之间存在明显差异,且不依赖于纤维蛋白原水平的变化,推测BβArg448Lys可能导致纤维蛋白原分子结构变化,进而改变纤维蛋白凝块结构,形成更坚固或更不易被纤溶酶溶解的纤维蛋白凝块。也有报道[13]表明,纤维蛋白凝块的结构受基因因素影响,且多于三分之一由基因变异所致。但一项包含2组人群(一组为3 657名心肌梗死患者与1 211例正常对照组;另一组为1 392名正常心肌梗死患者与1 392名对照组)的大样本病例对照研究证实,BβArg448Lys与心肌梗死没有明显相关性[14]。Theodoraki E V 等[15]也认为在希腊人中,BβArg448Lys基因多态性与CAD的发病危险性无相关性。关于BβArg448Lys对纤维蛋白原的结构影响报道不一,有研究[16]表明 BβLys448基因型血浆标本形成的凝块结构较BβArg448基因型更紧密,有研究[17]则否认这一相关性。因此,纤维蛋白原BβArg448Lys基因多态性所致的纤维蛋白原功能学的改变待进一步深入研究,以丰富人类基因库,为相关的疾病提供基础资料,且亟待进一步用体外重组等方法探讨其机制,为疾病的病因提出新的学说。
而要体外重组构建稳定转染纤维蛋白原BβArg448Lys野生型及突变型细胞系,是研究纤维蛋白原BβArg448Lys基因多态性所致的纤维蛋白原功能学改变的关键步骤。为此,本研究采用两步法构建野生型及突变型纤维蛋白原稳定转染细胞系。本研究采用CHO-K1细胞作为转染细胞是因为CHO-K1细胞是用于外源蛋白表达常见的哺乳动物细胞,具有外源蛋白质表达稳定,易于规模化培养等优点,且由于正常CHO-K1细胞株不表达纤维蛋白原,因此CHO-K1细胞是纤维蛋白原专一表达的合适宿主细胞。
本研究先将编码纤维蛋白原Aα链及γ链的表达载体共转染入CHO-K1细胞,二者为新霉素抗性,G418抗性克隆细胞经RT-PCR鉴定筛选获得同时具有Aα链及γ链mRNA水平表达的稳定转染细胞系。在此基础上再分别转染编码野生型及突变型纤维蛋白原Bβ链的质粒(带组氨醇筛选标签),同时抗G418及组氨醇的细胞克隆扩增培养并经RT-PCR鉴定同时具有纤维蛋白原Aα链、γ链、野生型/突变型Bβ链mRNA水平表达。此外考虑到目的基因可能由于同源重组置换了原有的转基因,本实验在无G418及组氨醇维持培养构建的纤维蛋白原稳定转染细胞系3月后重复检测,仍可检测到Aα链、γ链、野生型/突变型Bβ链mRNA水平表达,表明外源性野生型/突变型人纤维蛋白原已稳定整合和表达。当然本转染体系仍面临一些问题,如启动子之间有可能由于竞争或饱和作用造成目的基因的表达不均衡,但纤维蛋白原三条链的合成速率与表达量本身就不均衡[18],且不影响重组纤维蛋白原的功能及纯化。
综上所述,本研究成功建立了在mRNA水平稳定表达野生型(BβArg448)和突变型(BβLys448)纤维蛋白原稳定转染细胞系,为独立考察纤维蛋白原BβArg448Lys基因多态性及与纤维蛋白凝块的结构及功能的关系提供了理想的细胞模型,使直接对BβArg448Lys的功能学研究成为可能,为相关疾病的研究提供有用工具。
[1]Brummel K E,Butenas S,Mann K G.An integrated study of fibrinogen during blood coagulation[J].J Biol Chem,1999,274(32):22862-22870.
[2]Roy S N,Mukhopadhyay G,Redman C M.Regulation of fibrinogen assembly.Transfection of Hep G2 cells with B beta cDNA specifically enhances synthesis of the three component chains of fibrinogen[J].J Biol Chem,1990,265(11):6389-6393.
[3]Carter A M,Ossei-Gerning N,Wilson I J,et al.Association of the platelet Pl(A)polymorphism of glycoprotein IIb/IIIa and the fibrinogen Bbeta 448 polymorphism with myocardial infarction and extent of coronary artery disease[J].Circulation,1997,96(5):1424-1431.
[4]Behague I,Poirier O,Nicaud V,et al.Beta fibrinogen gene polymorphisms are associated with plasma fibrinogen and coronary artery disease in patients with myocardial infarction.The ECTIM Study.Etude Cas-Temoins sur l'Infarctus du Myocarde[J].Circulation,1996,93(3):440-449.
[5]Ong K L,Tso A W,Cherny S S,et al.A genetic variant in the gene encoding fibrinogen beta chain predicted development of hypertension in Chinese men[J].Thromb Haemost,2010,103(4):728-735.
[6]Weisel J W.Fibrinogen and fibrin[J].Adv Protein Chem,2005,70:247-299.
[7]Litvinov R I,Gorkun O V,Galanakis D K,et al.Polymerization of fibrin:Direct observation and quantification of individual B:b knob-hole interactions[J].Blood,2007,109(1):130-138.
[8]Carlisle C R,Coulais C,Namboothiry M,et al.The mechanical properties of individual,electrospun fibrinogen fibers[J].Biomateriale,2009,30(6):1205-1213.
[9]Bowley S R,Okumura N,Lord S T.Impaired protofibril formation in fibrinogen gamma N308K is due to altered D:D and“A:a”interactions[J].Biochemistry,2009,48(36):8656-8663.
[10]Siegerink B,Rosendaal F R,Algra A.Genetic variation in fibrinogen;its relationship to fibrinogen levels and the risk of myocardial infarction and ischemic stroke[J].J Thromb Haemost,2009,7(3):385-390.
[11]Lord S T.Molecular mechanisms afecting fibrin structure and stability[J].Arterioscler Thromb Vasc Biol,2011,31(3):494-499.
[12]Carter A M,Catto A J,Bamford J M,et al.Gender-specific associations of the fibrinogen B beta 448 polymorphism,fibrinogen levels,and acute cerebrovascular disease[J].Arterioscler Thromb Vasc Biol,1997,17(3):589-594.
[13]Dunn E J,Ariens R A,de Lange M,et al.Genetics of fibrin clot structure:a twin study[J].Blood,2004,103(5):1735-1740.
[14]Koch W,Hoppmann P,Biele J,et al.Fibrinogen genes and myocardial infarction:a haplotype analysis[J].Arterioscler Thromb Vasc Biol,2008,28(4):758-763.
[15]Theodoraki E V,Nikopensius T,Suhorutsenko J,et al.Fibrinogen beta variants confer protection against coronary artery disease in a Greek case-control study[J].BMC Med Genet,2010,11:28.
[16]Lim B C,Ariens R A,Carter A M,et al.Genetic regulation of fibrin structure and function:complex gene-environment interactions may modulate vascular risk[J].Lancet,2003,361(9367):1424-1431.
[17]Maghzal G J,Brennan S O,George P M.Fibrinogen B beta polymorphisms do not directly contribute to an altered in vitro clot structure in humans[J].Thromb Haemost,2003,90(6):1021-1028.
[18]Yu S,Sher B,Kudryk B,et al.Fibrinogen precursors.Order of assembly of fibrinogen chains[J].J Biol Chem,1984,259(16):10574-10581.
