诺如病毒性胃肠炎快速检测方法的研究
2012-10-25高志勇张国军闫惠平康熙雄
吕 虹 高志勇 张国军 闫惠平 康熙雄*
(1.首都医科大学附属北京天坛医院实验诊断中心,100050;2.北京市疾病预防控制中心传染病与地方病防治所,北京 100013;3.首都医科大学附属北京佑安医院感染与免疫中心,北京 100069)
人类杯状病毒(human caliciviruses,HuCV)包括诺如病毒(norovirus,NVs)和札如病毒(sapovirus,SVs),是导致人类急性非细菌性胃肠炎的常见病原体,也是仅次于轮状病毒导致儿童急性腹泻的重要病原体。长期以来,由于检测方法的局限,对HuCV给人类造成的危害及其严重程度缺乏正确的认识,常常低估其危害。1992年以美籍学者Jiang X[1]为首的研究组建立并发展了RT-PCR方法检测HuCV后,HuCV所致疾病的危害性和严重性越来越被研究者重视。有效的RT-PCR检测的关键是找到可以用于RT-PCR扩增的保守引物序列,并保证检测的敏感性和特异性,目前,用于HuCV检测的RT-PCR引物序列主要针对RNA多聚酶基因。由于HuCV病毒在粪便标本中的含量较低,需要建立更敏感、更特异的检测方法。同时传统的RT-PCR方法操作繁琐,对实验室和操作人员要求较高,容易引起结果假阳性或假阴性,给疾病诊断带来困难。因此本研究建立了一种检测NVs的新方法,并以传统RT-PCR方法为标准对新方法进行评价,为NVs的检测提供一种快速灵敏的检测方法。
1 材料与方法
1.1 材料
1)标本来源:选取2007年2月至2007年3月北京市36家医疗机构(二级以上医院和区、市疾病预防控制中心)门诊就诊或住院的腹泻患者364例,其中男性患者 202例,女性患者 162例,男女性别比1.25∶1。患者年龄从 <1岁至 79 岁,平均年龄(37.22±19.84)岁。诊断标准依据《诺如病毒感染性腹泻防治方案(试行)》[2],患者均有腹泻或呕吐等临床症状,每日排便次数≥3次,粪便性状发生明显改变(稀水样、蛋花样、黏液便或稀便等,无脓血),粪便、血常规检查无特殊发现,显微镜检查排除常见细菌、寄生虫等感染,怀疑病毒性胃肠炎。
2)收集方法:样本采集便盒由北京市疾病预防控制中心统一发放,无菌采便盒外包裹一层可开启的塑料袋。样本均为发病3 d内患者的粪便样本,每份标本量不少于5 mL,不得用肛拭子采集,标本采集后要求立即低温送检,不能及时送检的要求-20℃冰冻保存,标本避免反复冻融。长期保存样本置于-80℃冰箱。
3)试剂来源:恒温快速检测诺如病毒试剂盒由日本东曹公司提供,诺如病毒提取试剂采用美国QIAGEN公司病毒核酸提取试剂盒(QIAamp®Viral RNA Mini Kit),反转录体系采用Promega公司RNA反转录试剂盒。
4)引物:扩增区域位于诺如病毒基因组ORF1,基因位点在nt 4 568~4 886之间(参考株序列号为M87661)。由北京市中国疾病预防控制中心提供[3],见表1。

表1 RT-PCR所用引物Tab.1 Primers used in RT-PCR
5)仪器设备:恒温扩增系统由日本东曹公司提供,BIO-RAD扩增仪,Eppendorf高速低温离心机,电泳仪,凝胶成像系统等。
1.2 方法
1)样本处理:粪便样本从-80℃冰箱取出,室温复融。将1 mL样本稀释液(来自DAKO公司诺如病毒ELISA 试剂盒)至1.5 mL Eppendorf管中,加入0.1 g固体粪便样本或0.1 mL液体粪便样本,置于漩涡振荡器上混匀,室温静置10 min,室温下5 500 r/min离心5 min,进行检测。
2)病毒RNA提取:病毒RNA提取采用美国QIAGEN公司病毒提取试剂盒。
3)反转录-聚合酶链反应(RT-PCR):采用 Promega公司RNA反转录试剂盒,反应体系:10×缓冲液2.5 μL,25 mmol/L MgCl24 μL,2.5 mmol/L dNTPs 5 μL,1%BSA 2.5 μL,0.2 μg/μL 引物 289 混合液 1 μL,10 U/μL AMV-RT 0.35 μL,50 U/μL RNase 0.1 μL,DEPC 处理 H2O 8.05 μL,模板 RNA 1.5 μL,总体积25 μL。轻微离心混匀,42℃反转录1 h。PCR反应体系:10 × 缓冲液 5 μL,25 mmol/L MgCl24 μL,10 mmol/L dNTPs 1 μL,0.2 μg/μL 引物 289 混合液 1 μL,0.1 μug/μL 引物 290 混合液 1 μL,5 U/μL Taq酶0.4 μL,DEPC 处理 H2O 29.6 μL,cDNA 8 μL,总反应体积50 μL。轻微离心混匀,放入PCR仪中进行扩增。反应条件:94℃变性3 min,94℃ 1 min,58℃ 80 s,72℃ 1 min,循环30次,最后72℃延伸10 min。扩增产物用1.2%的琼脂糖凝胶电泳进行检测。
4)恒温快速检测方法:将试剂从-20℃冰箱取出,室温复融。分别取10 μL试剂A和10 μL试剂B于0.5 mL PCR扩增管中,再加入5 μL模板RNA,每批次反应加阳性对照和阴性对照。将反应体系放入恒温扩增系统中,43℃预热5 min,同时将混合酶预热3 min,将5 μL酶依次加入反应体系中,进行检测。仪器通过1.3倍阈值判断阴阳性结果。
1.3 统计学方法
用SPSS 11.5统计学软件分析结果,计数资料以百分比表示,采用χ2检验,一致性分析采用Kappa系数,以P<0.05为差异有统计学意义。
2 结果
2.1 应用TRC方法对病毒性胃肠炎患者进行NVs核酸检测的结果
TRC方法检测诺如病毒,可以同时检测NVs GGI型和NVs GGⅡ型,364例病毒性胃肠炎患者粪便样本应用TRC方法进行检测(表2),NVs GGI型阳性14例,占总检测病例的3.85%(14/364),阴性350例,占总检测病例的96.15%(350/364);NVs GGⅡ型阳性146例,占总检测病例的40.11%(146/364),阴性218例,占总检测病例的59.89%(218/364)。

表2 不同型别诺如病毒应用TRC方法检出情况Tab.2 Different types of norovirus detection using TRC method
应用TRC方法对病毒性胃肠炎患者粪便样本进行检测,NVs阳性总数为160例,占总检测病例的43.96%(160/364)。其中 NVs GGI占 8.75%(14/160),NVs GGⅡ占91.25%(146/160)。
应用TRC方法进行诺如病毒检测,可以通过实时检测荧光检测信号观察结果,检测阳性曲线如图1所示。在146例诺如病毒2型阳性的结果中,阳性结果检出时间显示89.73%的结果小于20 min,在14例诺如病毒1型阳性的结果中,阳性结果检出时间显示78.58%的结果小于20 min。
恒温检测方法共检测出阳性数为160例,检测阳性率为43.96%(160/364)。其中男性患者检出率为45.54%(92/202),女性患者检出率为 41.76%(68/162),两组差异无统计学意义(χ2=0.465,P=0.495)。364例腹泻病人样本按年龄分组(表3),其中阳性率最高的为50岁 ~59岁组,其阳性率为63.63%(35/55),阳性率最低的为10~19岁组,其阳性率为18.93%(5/26),通过χ2检验,除10~19岁组检出率低于各组外,其余各组间检验结果差异无统计学意义(χ2=11.704,P=0.069)。
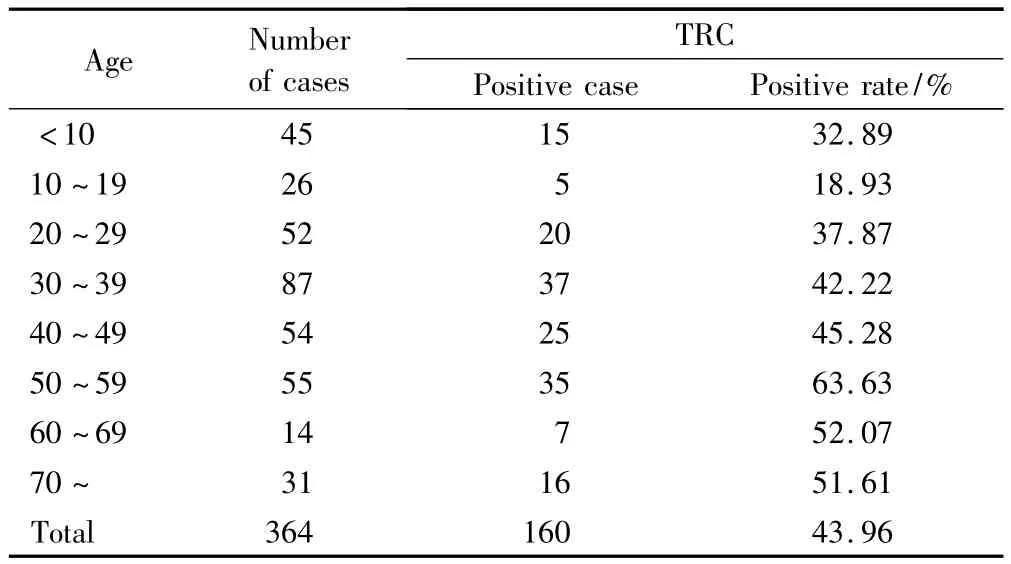
表3 364例腹泻患者NVs检测结果Tab.3 Test results of norovirus determination in 364 sporadic cases of acute viral gastroenteritis
2.2 TRC方法与RT-PCR方法检测病毒性腹泻患者粪便样本中的核酸结果比较
RT-PCR方法检出结果同TRC方法进行比较(表4),两种方法检测双阳性为139例,双阴性为191例,另外有34份样本两种方法检测结果不一致,其中TRC检测方法阳性但是RT-PCR检测方法结果阴性有21份,用RT-PCR方法检测阳性而TRC方法检测阴性的为13份。
以RT-PCR为标准,计算TRC方法的敏感度、特异性等指标如下:
敏感度Se=a/(a+c)=139/(139+13)=91.45%;

图1 诺如病毒检测阳性曲线Fig.1 Positive curve for detection of norovirus NVs:norovirus.

表4 TRC方法与RT-PCR方法的检测结果Tab.4 Test results of TRC and RT-PCR
特异度Sp=d/(b+d)=191/(21+191)=90.09%;
总的符合率π=(a+d)/(a+b+c+d)=(139+191)/(139+21+13+191)=90.66%;
比数积OP=Se/(1-Se)*Sp/(1-Sp)=ad/bc=139*191/21*13=97.25;
阳性预测值PV+=a/(a+b)=139/(139+21)=86.88%;
阴性预测值PV-=d/(c+d)=191/(13+191)=93.63%。
这两组检验结果经过配对χ2检验,P=0.229,说明两组阳性检出率之间的差异无统计学意义,即两种实验方法结果无差异。通过一致性检验结果显示Kappa=0.809,P=0.000,可见这两种试验方法结果一致性极佳。
3 讨论
NVs属于HuCV科中诺如病毒属,病毒直径约为26~35 nm,无包膜,表面粗糙,球形,呈二十面体对称;NVs基因组是单股正链RNA,全长约7 642 nt。诺如病毒家族成员庞杂,目前已对其100多个分离株进行基因测序。核酸的同源性分析表明,世界不同地区、不同时间流行的诺如病毒基因RNA多聚酶区序列相对保守,核苷酸氨基酸序列同源性高于60%,有的达到90%以上。因此,根据 RNA多聚酶区核苷酸序列的相似性,将诺如病毒分为5个遗传组(genogroups,GG),其中感染人的包括 GGⅠ、Ⅱ和Ⅳ。GGⅠ组也可感染猪,GGⅢ和GGⅤ组分别感染牛和鼠。NVs除了分5个遗传组外还分29个基因型,其中GGⅠ组有8个,GGⅡ组有17个,GGⅢ组2个,GGⅣ组有1个,GGⅤ组有1个。其中GGⅡ/4型是传播最广的基因型,中国以及世界上绝大多数胃肠炎的暴发疫情都是由GGⅡ/4型引起的[4-6]。由于NVs不能进行体外培养,也没有合适的动物模型,因此对其研究受到制约,检测方法的进展研究缓慢。目前用于检测该病毒的方法主要有电镜法、免疫学检测和分子检测等,这些检测方法是分别基于病毒外形特点、主要抗原决定簇和特异性核酸序列而建立的。1972年美国科学家Kapikian A Z等[7]就是通过免疫电镜的方法发现NVs,因此该方法在很长一段时间内成为检测NVs的经典方法。此方法对操作者的技能和经验要求很高,没有得到广泛的推广。RT-PCR方法特异性好、灵敏度高,能检测到10~40拷贝的病毒核酸。20世纪90年代以来,研究者们分别成功地运用RT-PCR的方法对感染者粪样中的NVs核酸进行了检测,设计引物对RNA多聚酶基因相对保守的区域进行扩增,获得了较高的阳性率。直至今日,RT-PCR方法仍是检测NVs的常用方法。本研究中RT-PCR方法所用引物为针对HuCV RNA多聚酶区而设计的P289/P290混合引物,此方法检出率高[8-11],对于NVs的扩增产物为319 bp,SVs的扩增产物为331 bp,2者由于片段大小接近,很难用琼脂糖凝胶电泳区分,需通过测序分析鉴定。
本研究所采用的TRC方法是一种带荧光标记的实时监控恒温扩增方法,引物设计位于 ORF1和ORF2的交界区。在43℃条件下,利用INAF荧光探针对目标RNA进行实时监测。应用TRC方法检测病毒性胃肠炎患者粪便样本中NVs核酸检出率为43.96%(160/364),略高于 RT-PCR 方法(41.76%)。以RT-PCR方法为标准,TRC方法,敏感度91.45%,特异度90.09%,总的符合率为90.66%,阳性预测值86.88%,阴性预测值93.63%。通过配对 χ2检验和Kappa检验,两种方法结果之间差异无统计学,一致性极佳。
此外,TRC方法可以同时检测NVs GGI和NVs GGⅡ,无需经过克隆测序分型,快速、简便、灵敏、经济,适合临床和疾控部门推广使用。
[1]Jiang X,Wang J,Graham D Y,et al.Detection of Norwalk virus in stool by polymerase chain reaction[J].J Clin Microbiol,1992,30(10):2529-2534.
[2]诺如病毒感染性腹泻防治方案(试行)[J].医药导报,2007,26(3):Ⅰ.
[3]高志勇,吕虹,黄芳,等.90例急性胃肠炎患者粪便中诺如病毒检出情况分析[J].中国病原生物学杂志,2008,3(8):564-567.
[4]Estes M K,Prasad B V,Atmar R L.Norovirus everywhere:has something changed?[J].Curr Opin Infect Dis,2006,19(5):467-474.
[5]吴疆,高志勇,刘桂荣,等.北京地区诺如病毒感染的流行病学调查[J].中华流行病学杂志,2007,28(7):667-670.
[6]詹惠春,聂军,刘翼,等.广州儿童秋冬腹泻中人类杯状病毒感染的分子流行病学研究[J].南方医科大学学报,2006,26(7):967-970.
[7]Kapikian A Z,Wyatt R G,Dolin R,et al.Visualization by immune electron microscopy of a 27-nm particle associated with acute infections nonbacterial gastroenteritis[J].J Virol,1972,10(5):1075-1081.
[8]焦艳梅,画伟,李娟,等.建立反向PCR检测HIV-1整合位点的方法[J].首都医科大学学报,2009,30(5):635-638.
[9]Blanton L H,Adams S M,Beard R S,et al.Molecular and epidemiologic trends of caliciviruses associated with outbreaks of acute gastroenteritis in the United States,2000-2004[J].J Infect Dis,2006,193(3):413-421.
[10]Haustein T,Harris J P,Pebody R.et.al.Hospital admissions due to norovirus in adult and elderly patients in England[J].Clin Infect Dis,2009,49(12):1890-1892.
[11]李海燕,蒋搏,孙志军,等.医院感染诺如病毒胃肠炎的流行病学调查[J].中华医院感染学杂志,2009,19(2):166-167.
