嗜热棉毛菌圈体发酵产木聚糖酶条件的优化
2012-10-24范光森杨绍青闫巧娟江正强
范光森,杨绍青,闫巧娟,严 烨,江正强,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;
2.中国农业大学工学院,北京 100083)
嗜热棉毛菌圈体发酵产木聚糖酶条件的优化
范光森1,杨绍青1,闫巧娟2,严 烨1,江正强1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;
2.中国农业大学工学院,北京 100083)
通过单因素实验优化了嗜热棉毛菌CAU44利用农业废弃物固体发酵产木聚糖酶的发酵条件。结果表明,发酵产酶的最佳碳源为玉米芯和麦麸以4∶6混合的复合碳源,最佳氮源为(NH4)2SO4,最佳水分含量为80%,培养基最佳初始pH为4.0,最佳表面活性剂及添加量为0.5%的Tween-60。在优化后的发酵条件下50℃培养7d,嗜热棉毛菌CAU44产木聚糖酶的酶活力最高,达到20343U/g干基碳源,为目前国内报道的最高值。因此,嗜热棉毛菌CAU44在利用农业废弃物固体发酵产木聚糖酶方面有很大的应用前景。
嗜热棉毛菌,木聚糖酶,固体发酵,农业废弃物
木聚糖是主链由木糖残基以β-1,4糖苷键连接而成的一类可再生的半纤维素类物质,其有效降解对于自然界的碳循环至关重要。木聚糖酶(EC.3.2.1.8)是一类重要的木糖苷键水解酶,它能够以内切方式作用于木聚糖分子中的β-1,4木糖苷键,将木聚糖水解生成低聚木糖和木糖。木聚糖酶可以广泛应用于食品、饲料、造纸、能源等行业,具有广阔的应用前景。相对于液体发酵,固体发酵由于具有生产成本低、工艺简单,对工厂机械设备和能源等的要求不高、不易污染杂菌、无废液,对环境友好等优点,在酶制剂的生产方面具有一些独特的优势[1],近年来逐渐受到了众多研究者的关注。国际上已有许多真菌固体发酵产木聚糖酶的研究报道[2-3]。Chapla等[2]优化了臭曲霉(Aspergillus foetidus)利用农业废弃物小麦麸皮固体发酵生产木聚糖酶的发酵条件,最终产酶水平达到了 8450U/g干基碳源。Gaffney等[3]研究了嗜热棉毛菌利用麦麸固体发酵产木聚糖酶,通过优化发酵温度、发酵时间和接种量,最终使酶活力达到2335U/g干基碳源[3]。国内关于真菌固体发酵产木聚糖酶的研究相对较少[4-6]。耐热木聚糖酶因其具有很好的热稳定性和应用适应性,目前已成为木聚糖酶研究的热点。嗜热真菌是目前耐热木聚糖酶生产的主要菌株。国际上已有许多嗜热真菌产耐热木聚糖酶的研究报道,如耐热子囊菌 (Thermoascusaurantiacus)[7]、嗜热毛壳菌(Chaetomiumthermophilum)[8]、嗜 热 拟 青 霉(Paecilomycesthermophila)[9]以 及 嗜 热 棉 毛 菌(Thermomyces lanuginosus)[10-11]等,其中嗜热棉毛菌是迄今已报道的最好的木聚糖酶生产菌株之一[6]。目前,关于嗜热棉毛菌产耐热木聚糖酶研究主要集中在酶的分离纯化以及酶学性质上[10-11],而关于其固体发酵产酶优化的研究报道相对较少。本实验室在前期的研究工作中从自然界筛选得到了一株嗜热棉毛菌CAU44,并对其液体发酵产木聚糖酶进行了研究,发现该菌能够高产木聚糖酶[12]。本文拟继续采用固体发酵的方式,研究嗜热棉毛菌CAU44利用农业废弃物生产耐热木聚糖酶的发酵条件,为其工业化生产提供理论依据。
1 材料与方法
1.1 材料与仪器
嗜热棉毛菌CAU44 由中国农业大学食品科学与营养工程学院酶工程研究室保存[12];桦木木聚糖、木糖 购于Sigma公司;低分子量标准蛋白样品 购于TaKaRa公司;酵母提取物、胰蛋白胨 购于英国Oxoid公司;其他试剂 均为分析纯。
LRH-恒温恒湿培养箱 广东省医疗器械厂; TU-1800PC紫外分光光度计 北京普析通用仪器设备有限责任公司;Power Pac Basic TM电泳仪 美国BIO-RAD公司;GL-20B高速冷冻离心机 上海安亭科技仪器厂。
1.2 固体发酵产木聚糖酶
孢子悬液的制备:待嗜热棉毛菌CAU44在PDA (土豆培养基)斜面上培养5d孢子完全萌发后,加入10mL无菌水,用灭菌的接种环轻轻刮动培养基表面,制成孢子悬液,混匀后用血球计数板计孢子数,调整孢子悬液的浓度为106个/mL。
营养盐溶液(g/L):KH2PO41,NaCl 2.5,MgSO4· 7H2O 0.5,(NH4)2SO41,CaCl20.5,调节pH为7.0(考察pH对发酵产酶的影响时,分别调节至需要pH)。
发酵培养:在250mL三角瓶中加入5g烘干后过筛(筛孔0.45~0.9mm)的农业废弃物和20mL营养盐溶液,搅拌均匀,121℃灭菌30min,冷却后接种1mL孢子悬液(106个/mL),混匀后置于50℃培养箱中静止培养5d。
粗酶液的提取:每克固体发酵物加入10mL 50mmol/L,pH 6.2的柠檬酸缓冲液,30℃下200r/min震荡提取2h,10000×g冷冻离心10min,吸取上清液即为木聚糖酶的粗酶液。
1.3 发酵产酶条件的优化
采用单因素法优化嗜热棉毛菌CAU44固体发酵产木聚糖酶的条件。选用不同的农业废弃物作为单一碳源考察碳源对产酶的影响,在前面产酶结果的基础上研究两种最优碳源的复配,得到产酶水平最高的碳源组成比例,接着逐一考察氮源、pH、表面活性剂、水分含量以及发酵时间对产酶的影响。实验中均在前一个最佳发酵条件的基础上优化下一个参数。
1.4 酶活力及蛋白浓度的测定
采用DNS法[13]测定木聚糖酶的酶活力:0.1mL适当稀释的酶液,加入到0.9mL 1%的桦木木聚糖底物溶液中(用50mmol/L,pH 6.5的MOPS缓冲液配制),50℃水浴反应10min后加入1mL DNS试剂,煮沸终止反应并显色,测定所释放的还原糖量,同时以木糖作为标准。木聚糖酶的活力单位定义为:在上述反应条件下,每分钟生成1μmol木糖所需要的酶量。酶活力计算公式为:
A=(k×OD540+b)×n
式中:A为酶活力,k为标准曲线斜率,n为稀释倍数,b为标准曲线截距。
蛋白质浓度的测定参照Lowry等[14]的方法,以牛血清白蛋白作为标准蛋白。
1.5 SDS-PAGE(聚丙烯酰胺凝胶电泳)及酶谱分析
SDS-PAGE参照Laemmli[15]的方法进行。分离胶为12.5%,浓缩胶为4.5%,考马斯亮兰R250染色显示蛋白条带。木聚糖酶酶谱参照杨绍青等[5]的方法。
1.6 实验数据分析
每组实验设置3个重复,实验数据采用Excel软件处理,结果取平均值并计算标准偏差。
2 结果与分析
2.1 碳源对菌株固体发酵产木聚糖酶的影响
分别采用玉米芯、玉米杆、稻草、高粱杆、玉米皮、麦麸、麦秆和甘蔗渣作为单一碳源进行菌株的固体发酵产酶实验,结果如图1所示。当以麦麸作为单一碳源时嗜热棉毛菌CAU44产木聚糖酶活力最高,达到2483U/g干基碳源,其次是玉米芯(1755U/g干基碳源)和麦秆(1687U/g干基碳源),而以其它几种农业废弃物作为碳源时,其所产木聚糖酶活力差别不大,均在1000U/g干基碳源左右。
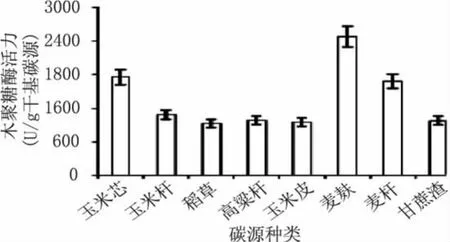
图1 不同碳源对嗜热棉毛菌CAU44固体发酵产木聚糖酶活力的影响Fig.1 Effect of carbon source on the xylanase production from Thermomyces lanuginosus CAU44 by solid-state fermentation
由于麦麸的使用成本比其它几种农业废弃物纤维质原料高,因此为了进一步降低发酵产酶的生产成本,选用产酶量相对较高而成本较低的玉米芯与麸皮进行混合碳源发酵。结果表明在麸皮中适当添加玉米芯有利于菌株的产酶(图2),其产酶量与单一碳源相比都有明显提高,当玉米芯与麦麸的比例为4∶6时,酶活力最高,达到11683U/g干基碳源,继续增加玉米芯的含量,菌株产酶量出现大幅降低。
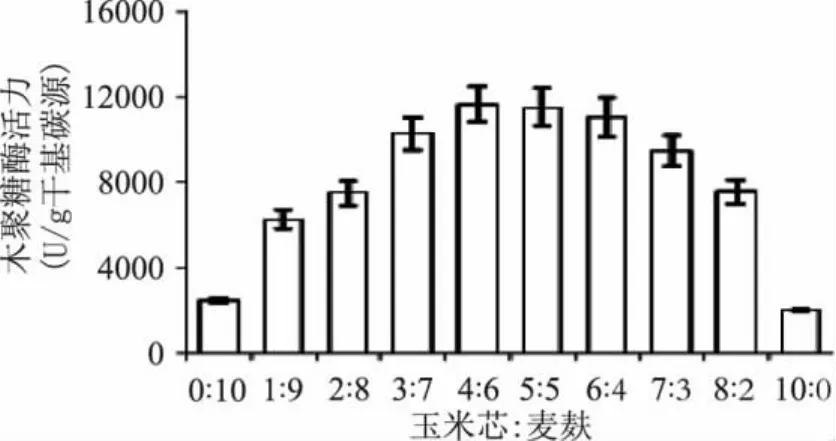
图2 复合碳源配比对嗜热棉毛菌CAU44固体发酵产木聚糖酶活力的影响Fig.2 Effect of the ratio of corncob to wheat bran on the xylanase production from Thermomyces lanuginosus CAU44 by solid-state fermentation
同时还考察了碳源粒度对菌株产酶的影响(结果未列出),实验表明当复合碳源粒度较大时(0.9~2mm),菌株产酶量在所有实验组中最高,达到了13833U/g干基碳源,随着碳源粒度的减小,菌株产酶量呈现下降的趋势,当碳源粒度小于0.18mm时,酶活力与最高值相比下降了67%。
2.2 氮源对菌株固体发酵产木聚糖酶的影响
在最佳的复合碳源基础上(玉米芯∶麦麸=4∶6),添加不同氮源(添加量均为0.21g/L的有效氮)考察氮源对嗜热棉毛菌CAU44产木聚糖酶的影响。实验结果如表1所示,不同氮源对菌株产酶影响不大,但以(NH4)2SO4作为氮源时酶活力最高,达到13794U/g干基碳源。接着考察了(NH4)2SO4添加量对产酶的影响,结果(未列出)表明随着(NH4)2SO4添加量的增加,菌株产木聚糖酶的量不断增加,当添加量为1.5g/L时,酶活力达到最高值15452U/g干基碳源。继续增加(NH4)2SO4的量时,木聚糖酶活力反而开始下降。

表1 不同氮源对嗜热棉毛菌CAU44固体发酵产木聚糖酶活力的影响Table 1 Effect of nitrogen source on the xylanase production from Thermomyces lanuginosus CAU44 by solid-state fermentation
2.3 培养温度和培养基初始pH对菌株固体发酵产木聚糖酶的影响
不同温度下发酵培养嗜热棉毛菌CAU44以考察温度对其产酶的影响,结果如图3所示。当发酵温度为50℃时菌株产酶量最高,达到15564U/g干基碳源。当培养温度降低到45℃时,酶活力明显下降,为最高酶活力的80%左右,当温度进一步降低到40℃以下或升高到55℃以上时,产酶量出现了显著的降低,55℃和40℃培养时产酶量仅分别为最高酶活力的29.4%和40.2%。

图3 不同培养温度对嗜热棉毛菌CAU44固体发酵产木聚糖酶活力的影响Fig.3 Effect of temperature on the xylanase production from Thermomyces lanuginosus CAU44 by solid-state fermentation
将固体发酵培养基调节至不同的pH进行发酵,以考察初始pH对菌株产酶的影响。实验结果(图4)表明,当初始pH为4.0时,菌株产酶量最高,达到15580U/g干基碳源。初始pH降低至3.0或升至7.0时,菌株产酶量变化不大,分别为最高值的96.2%和99.1%,而当初始pH继续升高时,酶活力逐渐降低,当pH升高至8.0时,嗜热棉毛菌CAU44产酶量仅为最高值的44.4%。
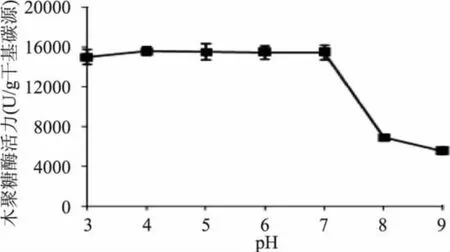
图4 不同初始pH对嗜热棉毛菌CAU44产木聚糖酶活力的影响Fig.4 Effect of initial pH on the xylanase production from Thermomyces lanuginosus CAU44 by solid-state fermentation
2.4 培养基含水量和表面活性剂对菌株产木聚糖酶的影响
实验中分别采用不同的料水比来考察水分含量对产酶的影响。结果表明,当料水比为1∶4时,菌株产酶量最大,酶活力达到15752U/g干基碳源,增加或减少水分含量,菌株产酶量都显著降低(结果未列出)。
在上述最优产酶培养基的基础上添加不同的表面活性剂,考察表面活性剂对嗜热棉毛菌CAU44固体发酵产酶的影响。结果表明(表2),添加Tween-60可提高木聚糖酶的酶活力,与对照比较酶活力提高了11%,其它Tween系列表面活性剂对木聚糖酶活力影响不大,而Triton系列表面活性剂则对木聚糖酶的分泌有显著的抑制作用,添加 Triton-100和Triton-114时酶活力分别下降了58%和64%。确定了最佳表面活性剂后接着研究表面活性剂的添加量对嗜热棉毛菌CAU44固体发酵的影响。实验结果表明,添加0.5%的Tween-60对木聚糖酶的产量促进最为明显,酶活力最高达到17368U/g干基碳源。当继续增加Tween-60的浓度时酶活力反而逐渐降低(结果未列出)。
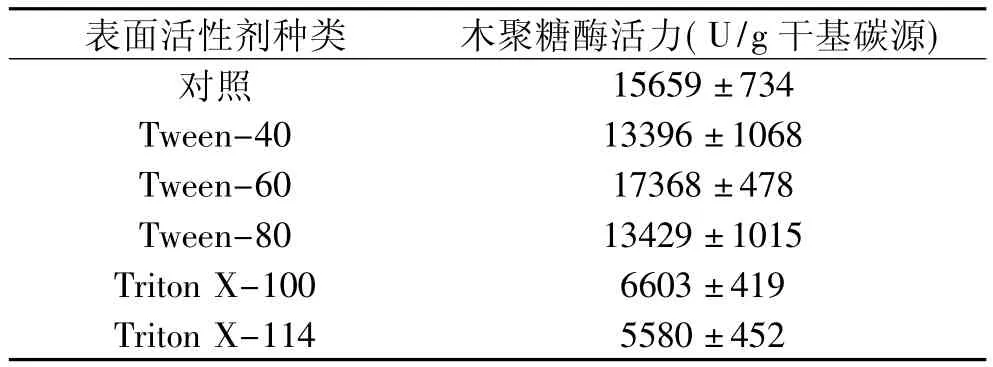
表2 不同表面活性种类对嗜热棉毛菌CAU44固体发酵产木聚糖酶活力的影响Table 2 Effect of surfactant on the xylanase production from Thermomyces lanuginosus CAU44 by solid-state fermentation
2.5 培养时间对菌株固体发酵产木聚糖酶的影响
确定各发酵条件的最优参数后,在最佳条件的基础上考察发酵时间对嗜热棉毛菌CAU44固体发酵产酶的影响。结果如图5所示,菌株在优化后的发酵条件下,从第5d开始产酶速度加快,到第7d时酶活力达到最高值20343U/g干基碳源,然后酶活力趋于平缓略有下降。

图5 培养时间对嗜热棉毛菌CAU44产木聚糖酶活力的影响Fig.5 Effect of culture time on the xylanase production from Thermomyces lanuginosus CAU44 by solid-state fermentation
2.6 木聚糖酶电泳及酶谱分析
在最佳固体发酵产酶条件下培养嗜热棉毛菌7d,采用SDS-PAGE及原位酶谱法检测菌株分泌到胞外的蛋白组成及木聚糖酶情况,结果如图6所示。嗜热棉毛菌CAU44分泌到胞外的蛋白的条带很少,主要为一种单一蛋白,占胞外蛋白总含量的80%以上(图6,泳道1)。进一步采用原位酶谱法对木聚糖酶所处位置进行鉴定,结果显示木聚糖酶谱带在电泳胶上的迁移率与胞外主要蛋白迁移率一致(图6,泳道2),说明该主要胞外蛋白即为木聚糖酶。采用不同低分子量标准蛋白的迁移率与蛋白分子量的对数值作标准曲线,将木聚糖酶的迁移率代入到曲线中,计算出该木聚糖酶的分子量为25.6ku。
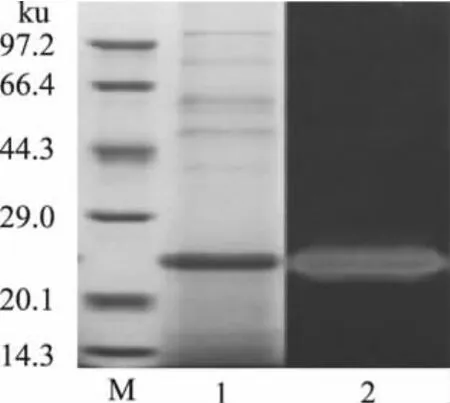
图6 嗜热棉毛菌CAU44固体发酵产木聚糖酶SDS-PAGE及酶谱图分析Fig.6 SDS-PAGE and zymogram analysis of xylanase from Thermomyces lanuginosus CAU44 by solid-state fermentation
3 讨论
3.1 发酵条件对产酶的影响
嗜热棉毛菌是产木聚糖酶的优良菌种之一,迄今已经分离得到数十种嗜热棉毛菌。通过对菌株固体发酵产酶条件的研究,表明嗜热棉毛菌CAU44能够以农业废弃物作为碳源固体发酵产木聚糖酶。本研究发现以麦麸作为单一碳源时诱导嗜热棉毛菌CAU44具有很好的效果,这与李秀婷等[6]研究结论一致。这可能是由于麸皮中富含多糖、蛋白质、维生素和矿物质等常用的培养基成分,既是碳源,又可作为氮源,同时还含有某些能对微生物生长和产酶起促进作用的生长因子。在麦麸中添加适量玉米芯可以改善固体培养基的通气和散热性能,有利于菌丝的生长和木聚糖酶的合成。实验发现当玉米芯与麦麸以4∶6混合作为发酵碳源时,极大的提高了菌株产酶能力,是麦麸作为单一碳源诱导产酶量的4.7倍。这一结果与李秀婷等[6]实验结果相似。另外,农业废弃物粒度的大小对菌株产酶也有显著的影响,本研究表明较大粒度的碳源更有利于菌株产酶。Singh等[16]在研究菌株Thermomyces lanuginosus发酵产木聚糖酶时中也得到了相同的结论。碳源的粒度是影响菌株向胞外分泌酶的重要因素,较大的粒度可能有利于培养基质的通气与散热,进而促进微生物的生长和酶的分泌。
氮源的类型和性质也会影响酶的合成和分泌。本文发现以(NH4)2SO4作为氮源时菌株产酶量最高,这与周晨妍等[17]的研究结论一致。温度对微生物产酶具有重要的影响,实验结果表明嗜热棉毛菌CAU44在50℃发酵产木聚糖酶活力最高,培养温度过高或过低,均会影响微生物产酶能力,这与李秀婷等[6]研究结果一致。本文还发现初始pH对嗜热棉毛菌CAU44木聚糖酶的合成有显著的影响,在中性或偏酸性环境下,嗜热棉毛菌能够较好利用农业废弃物合成和分泌木聚糖酶,而初始pH高于7.0,产酶能力大幅下降,这可能是由于初始pH高于7.0时,基础营养液开始絮凝不利于菌株对营养物质的吸收造成的。
在固体发酵过程中,培养基初始水分含量是影响发酵产酶的关键性因素之一。当水分活度为80%时,嗜热棉毛菌CAU44固体发酵木聚糖酶活力最高,增加或减少水分含量,菌株产酶量都显著降低。这可能是由于含水量过低时,孢子萌发迟滞期延长,影响菌丝体的生长周期,同时降低了固态底物中营养物质的溶解性和微生物生长所需要的水分活度,从而导致产酶量较低;而当含水量过高时,培养基表面粘连,造成培养基溶氧量不足,导致发酵不彻底,培养基利用率下降,从而影响到木聚糖酶的分泌量。因此,适当调节培养基的初始水分含量对菌株的生长至关重要,也是木聚糖酶合成的关键因素之一。这一结果与Kalogeris等[18]在研究嗜热子囊菌固体发酵产酶时的结论比较相近(该菌在料水比为1∶4和1∶5时产酶量最高)。研究发现添加 0.5% 的Tween-60可以提高木聚糖酶产量,这说明一定浓度的表面活性剂可以改善真菌细胞膜的通透性,使合成的酶更多地从胞内释放出来,从而提高胞外酶的产量。但继续增加Tween-60的浓度酶活力反而会下降,这可能是由于高浓度的表面活性剂造成了细胞膜的解体,膜透性增大,使细胞内的电解质大量外渗,从而导致各种代谢失调引起抑制作用。从产酶曲线(图5)可以看出,发酵各阶段菌株的木聚糖酶的合成与分泌量不均衡,发酵后期产酶速率明显较快,可能是由于嗜热棉毛菌CAU44在发酵前期刚开始生长,生物量少,导致酶分泌量少;到发酵后期菌丝生长快,生物量迅速增加,进而使酶的分泌速度加快。菌株在发酵过程中蛋白浓度变化情况与酶活力变化趋势基本相似。

表3 部分嗜热棉毛菌固体发酵产木聚糖酶情况Table 3 Xylanase production of partial thermophilic fungi
3.2 产酶水平比较
国际上已有许多类似的利用农业废弃物作为碳源发酵产酶的研究报道(表3)。Purkarthofer等[19]利用玉米芯作为碳源固体发酵嗜热棉毛菌生产木聚糖酶酶活力达到20216U/g干基碳源,与本研究产量较为接近。Manimaran等[20]以甘蔗渣作为碳源对嗜热棉毛菌固体发酵生产木聚糖酶进行了优化,酶活力能达到19320U/g干基碳源。Sonia等[21]利用高粱秆为碳源,优化了嗜热棉毛菌固体发酵产木聚糖酶的发酵条件,在最佳培养条件下,产酶活力最高达到48000U/g干基碳源,这是目前世界范围内嗜热棉毛菌固体发酵生产木聚糖酶产量的最高值。其它一些相近的研究报道中产酶量均不高,在1000~5000U/g干基碳源之间[3,22]。国内关于嗜热棉毛菌固体发酵生产木聚糖酶的研究报道较少,仅见李秀婷等[6]对嗜热棉毛菌进行了固体发酵条件的优化,酶活力达到15023U/g干基碳源。本研究中优化后的产酶水平为国内最高值,在国际上也处于较高的水平。
嗜热棉毛菌来源木聚糖酶分子量主要分布在23~29ku之间[16]。本研究报道的木聚糖酶分子量(25.6ku)与其它一些嗜热棉毛菌来源的木聚糖酶分子量相近,如来源于Thermomyces lanuginosusTHKU-49的木聚糖酶(24.9ku)[10]。目前,影响木聚糖酶大规模工业化生产和应用的主要障碍是酶的产量和生产成本。本研究采用固体发酵产木聚糖酶的产量达到目前国内最高水平;同时,所产胞外蛋白主要为木聚糖酶,所含杂蛋白很少,这一特点使酶在精制过程中易于纯化,可减少纯化工序,降低酶的生产成本;此外,由于固体发酵采用的主要原料为纤维质材料,不仅生产成本低,而且生产出来的木聚糖酶可直接作为饲料添加剂直接添加在饲料中而无需纯化。因此,本研究的结果表明,采用嗜热棉毛菌CAU44为发酵菌株,利用固体发酵方式生产木聚糖酶非常适合用于木聚糖酶的工业化生产。
4 结论
单因素优化实验结果表明嗜热棉毛菌CAU44酶在最佳发酵条件下固体发酵产木聚糖酶活力最高达到20343U/g干基碳源,为国内报道的最高值。嗜热棉毛菌CAU44能够利用农业废弃物固体发酵高产木聚糖酶的特性,尤其为今后该酶的固体发酵工业化生产奠定了基础。
[1]Dos Santos M M,Da Rosa A S,Dal’Boit S,et al.Thermal denaturation:Is solid-state fermentation really a good technology for the production of enzymes?[J].Bioresource Technology,2004,93(3):261-268.
[2]Chapla D,Divecha J,Madamwar D,et al.Utilization of agroindustrial waste for xylanase production byAspergillus foetidusMTCC 4898 under solid state fermentation and its application in saccharification[J].Biochemical Engineering Journal,2010,49 (3):361-369.
[3]Gaffney M,Doyle S,Murphy R.Optimization of xylanase production byThermomyces lanuginosusin solid state fermentation[J].Bioscience Biotechnology and Biochemistry,2009,73(12): 2640-2644.
[4]张辉,孙占斌,桑青.嗜热侧孢霉固体发酵产木聚糖酶条件研究[J].中国酿造,2010(2):59-61.
[5]杨绍青,闫巧娟,江正强,等.嗜热拟青霉固体发酵产木聚糖酶条件的优化[J].微生物学通报,2006(3):1-6.
[6]李秀婷,杨绍青,江正强,等.利用农业废弃物生产嗜热真菌(T.lanuginosus)耐热木聚糖酶的固体发酵研究[J].工业微生物,2004(4):13-18.
[7]Oliveira D S,Meherb-Dini C,Franco C,et al.Production of crude xylanase fromThermoascus aurantiacusCBMAI 756 aiming the baking process[J].Journal of Food Science,2010,75(7): 588-594.
[8]Katapodis P,Christakopoulou V,Kekos D,et al.Optimization of xylanase production byChaetomium thermophilumin wheat straw using response surface methodology[J].Biochemical Engineering Journal,2007,35(2):136-141.
[9]Yang S Q,Huang Z A,Jiang Z Q,et al.Partition and purification of a thermostable xylanase produced byPaecilomyces thermophila in solid-state fermentation using aqueous two-phase systems[J].Process Biochemistry,2008,43(1):56-61.
[10]Khucharoenphaisan K,Tokuyama S,Kitpreechavanich V. Purification and characterization of a high-thermostable βxylanase from newly isolatedThermomyces lanuginosusTHKU-49[J].Mycoscience,2010,51(6):405-410.
[11]Khucharoenphaisan K,Tokuyama S,Kitpreechavanich V. Characterization of the thermostability of xylanase produced by new isolates ofThermomyces lanuginosus[J].Science Asia,2008,34(2):187-192.
[12]Jiang Z Q,Yang S Q,Yan Q J,et al.Optimizing xylanase production by a newly isolated strain CAU44 of the thermophileThermomyces lanuginosus[J].World Journal of Microbiology&Biotechnology,2005,21:863-867.
[13]Bailey M J,Biely P,Poutanen K.Interlaboratory testing of methodsforassay ofxylanase activity[J].Journalof Biotechnology,1992,23(3):257-270.
[14]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the folin phenol reagent[J].Journal of Biological Chemistry,1951,193(1):265-275.
[15]Laemmli U K.Cleavage of structural proteins during assembly of head of bacteriophage-T4[J].Nature,1970,227:680.
[16]Singh S,Pillay B,Dilsook V,et al.Production and properties of hemicellulases by aThermomyces lanuginosusstrain[J].Journal of Applied Microbiology,2000,88(6):975-982.
[17]周晨妍,张金华,马雪婷,等.黑曲霉产木聚糖酶的固态发酵条件优化[J].安徽农业科学,2010(21):11052-11054.
[18]Kalogeris E,Christakopoulos P,Kekos D,et al.Studies on the solid-state production ofthermostable endoxylanasesfromThermoascus aurantiacus:Characterization of two isozymes[J]. Journal of Biotechnology,1998,60(3):155-163.
[19]Purkarthofer H,Sinner M,Steiner W.Cellulase-free xylanase fromthermomyces-lanuginosus-optimization of production in submerged and solid-state culture[J].Enzyme and Microbial Technology,1993,15(8):677-682.
[20]Manimaran A,Kumar K S,Permaul K,et al.Hyper production of cellulase-free xylanase byThermomyces lanuginosusSSBP on bagasse pulp and its application in biobleaching[J]. Applied Microbiology and Biotechnology,2009,81(5):887-893.
[21]Sonia K G,Chadha B S,Saini H S.Sorghum straw for xylanase hyper-production byThermomyces lanuginosus(D2W3) under solid-state fermentation[J].Bioresource Technology,2005,96(14):1561-1569.
[22]Christopher L,Bissoon S,Singh S,et al.Bleach-enhancing abilities ofThermomyces lanuginosusxylanases produced by solid state fermentation[J].Process Biochemistry,2005,40(10): 3230-3235.
Optimization of xylanase production fromThermomyces lanuginosusCAU44 by solid-state fermentation
FAN Guang-sen1,YANG Shao-qing1,YAN Qiao-juan2,YAN Ye1,JIANG Zheng-qiang1,*
(1.College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China;
2.College of Engineering,China Agricultural University,Beijing 100083,China)
The single-factor tests were employed to evaluate the optimal fermentation conditions for xylanase production ofThermomyces lanuginosusCAU44 by solid-state fermentation using agricultural wastes as carbon source.The results showed that the optimum conditions for xylanase production were as follows:mixture of corncob and wheat bran as carbon source(4∶6),1.5g/L(NH4)2SO4as nitrogen source,the ratio of solid substrate to mineral solution ratio was 1∶4,the initial pH was 4.0,Tween-60 addition was 0.5%,and incubation temperature was 50℃.Under optimized conditions,the highest enzyme activity of 20343U/g dry carbon source was obtained at 7d,which was the highest value ever reported in domestic.Thus,xylanase production byThermomyces lanuginosusCAU44 processed a potential application from the industrial point of view due to the high level of xylanase production and low producing cost.
Thermomyces lanuginosus;xylanase;solid-state fermentation;agricultural wastes
TS201.3
A
1002-0306(2012)06-0219-06
2011-06-22 *通讯联系人
范光森(1984-),男,博士研究生,主要从事酶工程方面的研究。
863计划课题(2011AA100905);新世纪优秀人才支持计划(NCET-08-0534)。
