DNMT3B对人脐带间质干细胞成骨分化能力的影响
2012-10-23吴周睿孙晓晴管晓菲程黎明
吴周睿,胡 笑,徐 委,孙晓晴,管晓菲,程黎明
同济大学附属同济医院脊柱外科,上海 200065
骨科手术中需要使用大量自体骨和/或异体骨进行组织填充。然而目前骨质资源匮乏,而且异体骨可能存在免疫排斥反应,对骨折愈合产生十分不利的影响。近五年来再生医学领域中干细胞技术的广泛应用为治疗众多人类疾病带来革命性突破。目前已经出现了许多干细胞治疗各种人类疾病的研究报道错误!未找到引用源。。同样,通过干细胞技术,理论上也能获得大量患者自体或异体的骨质。并且将取自患者自身的细胞培养、分化成适合进行移植的骨质,能够避免排斥反应,提高质量效果和患者预后生活质量。由于各种来源的干细胞形成骨质的能力不同,与成骨母细胞来自同一发育起源的间质干细胞成为首选种子细胞;而脐带血间质干细胞来源充足,取材简便,成为最佳候选细胞。
但是目前干细胞成骨分化效率较低,其中具体分化机制也尚不明确。有证据表明DNMT3B在人胚胎期和出生后成骨分化过程中发挥了重要作用。另外在人类遗传病ICF综合症中发现,DNMT3B突变可能会引起患者颌面部骨骼发育畸形,这些研究表明DNMT3B在成骨分化过程中十分重要错误!未找到引用源。。
为了进一步提高干细胞成骨分化的效率,明确DNMT3B与细胞成骨分化作用之间的关系,本实验尝试建立带有DNMT3B基因沉默的人脐带血间质干细胞,并通过细胞培养、分化技术,分子学基因表达水平检测和DNA甲基化水平检测技术等,评价DNMT3B缺失后对人脐带血间质干细胞成骨分化造成的影响。
1 材料与方法
1.1 hUMSCs培养及鉴定
实验中使用脐带血间质干细胞购自与Sciencell公司(货号#7530)。将1×106的hUMSCs培养在T25培养瓶中,培养液为低糖 DMEM,5%胎牛血清,10 ng/ml血管内皮生长因子(VEGF),10 ng/ml表皮生长因子(EGF),隔日换液。并通过使用表面标志物CD44和CD90抗体对hUMSCs进行免疫组织化学鉴定。
1.2 DNMT3B突变型hUMSCs建立
设计DNMT3B RNA特异性干扰靶点位于人DNMT3B cDNA 3'UTR区,其结合特异性经过NCBI数据库 blast对比确认。在设计的21 bp siRNA序列中未发现明显的人同源性序列。siRNA正义链序列为5'-AACTGGAGCCACGACGTAACA-3',反 义 链 序 列 为 5'-AACTGGAGCCACGACGTAACA-3'。将此双链置于1×siRNA退火缓冲液(6 mM HEPES(pH 7.4),20 mM KCl和 0.4 mM Mg(OAC)2)中以90℃退火1分钟后,置于37℃中培育1小时形成双链。siRNA转染时,将27 μg siRNA表达载体轻柔加入至 4.5 ml含有 45 μL Lipofectamine®2000转染试剂的Opti-MEM®转染液中,室温静止孵育5分钟。孵育完成后将含有质粒和Lipo2000的Opti-MEM®转染液加入至5×105hUMSCs中。37℃孵育过夜。感染第4天通过免疫组化染色和qPCR法检查细胞感染效率。
1.3 成骨分化实验
将hUMSCs种植于载玻片上,加入成骨细胞培养液中诱导分化2周,即可获得Osteocalcin阳性的成骨细胞,随后进行矿化功能染色鉴定。成骨细胞诱导分化液配方:DMEM+10%胎牛血清+L-抗坏血酸 100,β-甘油磷酸酯 10 mM,地塞米松 10 nM,非必需氨基酸5 ml,谷氨酰胺5 ml,双抗5 ml。
1.4 统计分析
所有数据用SPSS13.0统计学软件完成。实验资料用±s表示组间两两比较,采用单因素方差分析,当P<0.05和P<0.01时,有统计学显著性差异。
2 结果
2.1 DNMT3B突变型hUMSCs建立
野生型hUMSCs购得后,按照该公司培养要求进行一定比例的扩增后进行实验。获得的细胞形态上具有间质干细胞特征(图1)。
图1 野生型hUMSCs培养形态Fig.1 The morphology of hUMSCs
DNMT3B siRNA转染hUMSCs后,免疫组织化学染色和qPCR法检测内源性DNMT3B表达水平。结果显示获得两株DNMT3B突变型细胞(shD3B-1和shD3B-2)转染效率约95%,两株突变型hUMSCs中DNMT3B表达量分别下降至野生型hUMSCs的12.67 ±0.45%和35.60 ±0.76%(P <0.05,图2)。
与野生型 hUMSCs相比,虽然这种两株DNMT3B突变型hUMSCs也能够表达特异性标记物CD44和CD90(图3),但是特异性标记物CD90和CD73 mRNA表达水平下降,shD3B-1和shD3B-2的 CD73水平是正常细胞的15.83±0.44%和16.60±0.37%(P <0.05);而 CD90 的水平是正常细胞的 35.23 ±0.30% 和 58.64 ±0.71%(P<0.05)(图4)。

图2 RNA干扰后DNMT3B mRNA表达水平Fig.2 The expression level of DNTM3B after RNA interference
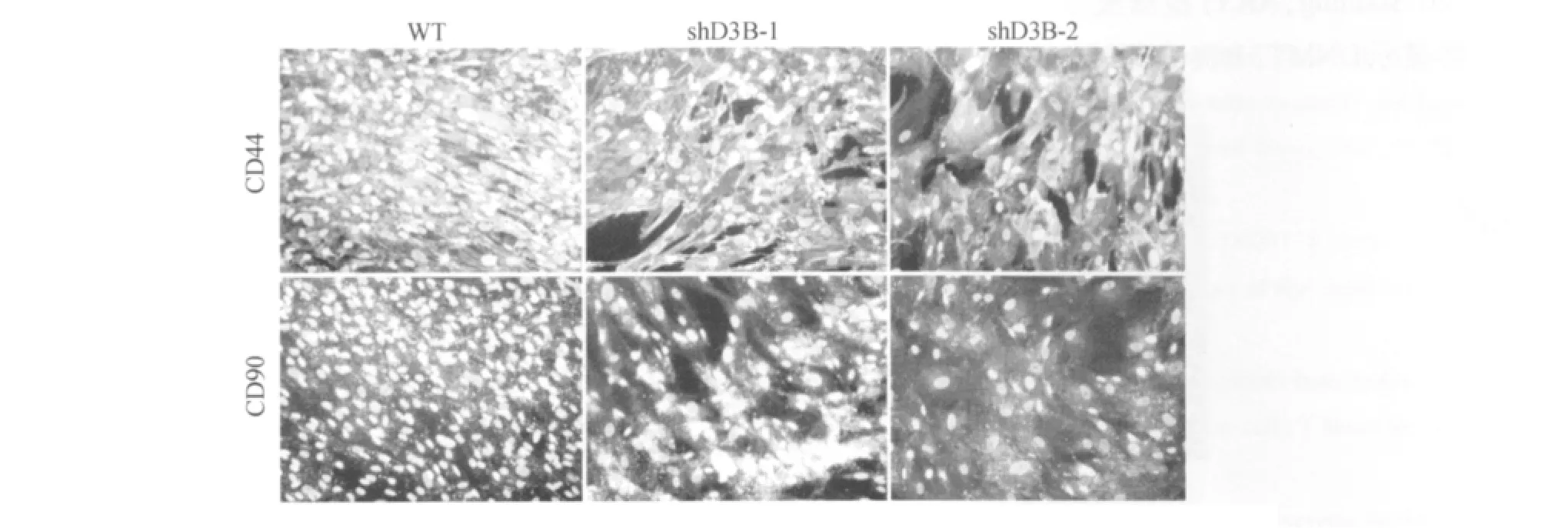
图3 免疫组化染色显示CD44和CD90表达水平Fig.3 The CD44 and CD90 expression were showed by immunostaining
2.2 DNMT3B突变型hUMSCs成骨细胞分化

图4 qPCR结果显示CD73和CD90 mRNA表达水平Fig.4 The CD73 and CD90 expression were showed by qPCR
成骨细胞分化两周后,免疫组化染色显示突变型和野生型hUMSCs细胞均能被诱导为表达Osteocalcin的成骨母细胞,但是DNMT3B突变型细胞信号强度比野生型细胞明显较弱,而且成骨区域形态也不及野生型成熟(图5)。

图5 免疫组化染色显示Osteocalcin在成骨细胞中表达水平Fig.5 The osteocalcin expression were showed by immunostaining
qPCR显示三个与成骨直接相关的基因——RUNX2,IBSP和 ALPL在诱导分化两周后的DNTM3B突变型hUMSCs中表达显著低于野生型hUMSCs(图 6)。其中 shD3B-1和 shD3B-2的RUNX2基因表达水平分别为正常细胞的55.09±0.53%和 53.77 ±0.47%;IBSP 基因表达水平分别为正常细胞的 53.21 ±0.81% 和 41.75 ±0.44%;ALPL基因表达水平分别为正常细胞的15.55±0.10%和 17.86 ±24%(P <0.01)。
进一步对成骨母细胞进行茜素红染色(Alizarin Red Staining,ARS)检测成骨后细胞功能。染色结果显示DNMT3B突变型hUMSCs成骨功能低于野生型hUMSCs(图7)。
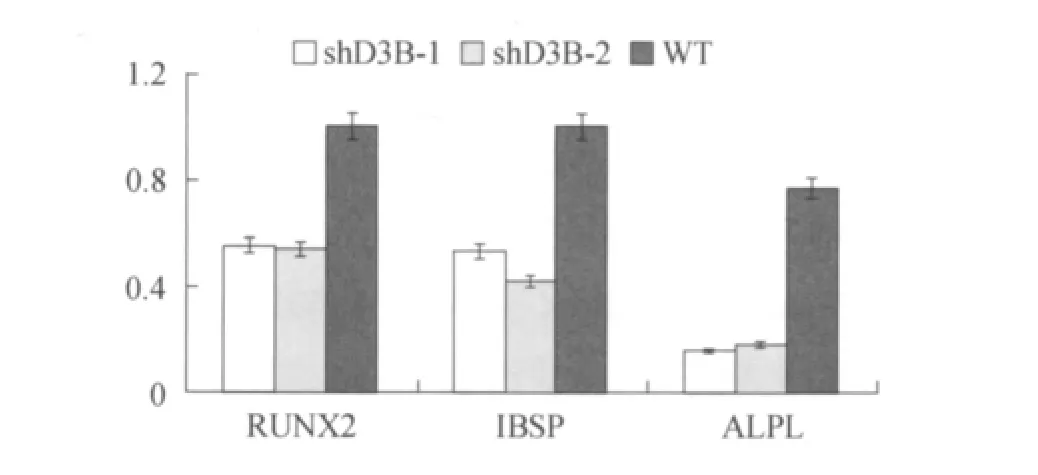
图6 qPCR结果显示成骨相关基因在成骨细胞中的表达情况Fig.6 The RUNX2,IBSP and ALPL expression were showed by qPCR

图7 矿化染色显示成骨分化后细胞功能Fig.7 The function of osteogenesis was tested by alizarin red staining
3 讨论与结论
为了进一步研究DNMT3B基因与间质干细胞成骨分化的关系,本实验通过RNA干扰技术抑制hUMSCs中内源性DNMT3B表达,随后进行终端成骨母细胞分化工作。实验发现:两株DNMT3B突变型hUMSCs和野生型hUMSCs均能被诱导为表达Osteocalcin蛋白的成骨细胞,但是DNMT3B突变型hUMSCs来源的成骨细胞中成骨相关基因的表达(RUNX2,IBSP和 ALPL)比野生型成骨细胞低。而且免疫组织化学结果也证实了这一发现。在进行成骨母细胞功能性检测实验时发现DNMT3B突变型hUMSCs矿化染色活性都比野生型要低。这些结果认为DNMT3B突变或缺失会导致hUMSCs成骨分化能力下降。
DNMTs介导的DNA甲基化在高等哺乳动物胚胎发育过程中发挥着重要的调节作用错误!未找到引用源。。同样在成骨系统发育阶段,DNMTs,尤其是de novo DNMTs介导的DNA甲基化也参与其中。作为DNA甲基化转移酶家族中重要的一员,DNMT3B在细胞中发挥了DNA新建型甲基化的作用。因此DNMT3B突变首先产生的影响是DNA甲基化的丢失。通常来讲,DNA甲基化调控基因表达的主要机制分为三步:首先待转录基因启动子区上CpG二核苷酸的甲基化会导致转录因子与启动子区结合,抑制转录起始错误!未找到引用源;其次DNA甲基化还能通过胞嘧啶上的甲基基团与CpG甲基基团结合蛋白(methyl-CpG binding proteins,MBDs),进一步从空间位置上阻碍转录因子与启动子区结合。;另外MBD蛋白能促进组蛋白去乙酰化转移酶(Histone deacetylase,HDACs)在转录起始区募集,改变组蛋白的构象,进一步抑制基因转录错误!未找到引用源。因此在DNMT3B表达状态缺失情况下,hUMSCs中多能性基因的抑制状态可能被解除,相反成骨相关基因表达被抑制。
值得一提的是,在成骨发育的过程中,成骨基因的表达是时序性调控的过程,首先RUNX2在分化初始阶段(诱导开始4天以内)具有转录起始的作用,因此其表达最早出现;ALPL作为普遍常见的骨形成基因在分化的中期(诱导后1周左右)出现峰值;而作为影响成骨成熟形态及功能的基因,Osteocalcin一般出现在诱导后2~3周时。本实验中发现DNMT3B的缺失对同一时间点上三个不同阶段的基因表达都具有抑制作用,因此不难推断DNMT3B抑制成骨分化的靶点位于hUMSCs中,而不是成骨分化后期;同时由于DNMT3B主要存在于多潜能细胞中,在随着终端分化的进行DNMT3B表达水平逐渐下降。另外CD73和CD90的mRNA水平从另一个方面佐证了DNMT3B缺失对hUMSCs自身的抑制作用。这三个证据都共同指出,DNMT3B对于hUMSCs的成骨分化具有重要的调控作用。在进一步实验中对于成骨基因时序性表达的检测可以更详细的解释DNMT3B对于成骨分化产生的影响。
另外,以免疫球蛋白水平低下,中心粒异染色质区解凝和面部畸形为主要临床表现的ICF(Immunodeficiency,Centromere instability and Facial abnormal)综合征,已经明确了DNMT3B基因突变是其主要遗传学病因错误!未找到引用源。。由此可以认为,DNMT3B与人类骨质结构形成相关。目前还没有证据表明使用DNMT3B重表达技术能够逆转成骨异常,但是在间质干细胞体系中,将来可以通过分子生物学技术将DNMT3B过表达后评价其成骨状态。而且新兴的成体细胞重编程技术(reprogramming)能够在体外完整的模拟ICF综合征的发病过程,进一步明确DNMT3B在成骨细胞分化和骨质形成中的具体作用机制。
[1] Yagi T,Ito D,Okada Y,et al.Modeling familial Alzheimer's disease with induced pluripotent stem cells[J].Hum Mol Genet,2011,20(23):4530-4539.
[2] Wernig M,Zhao JP,Pruszak J,et al.Neurons derived from reprogrammed fibroblasts functionally integrate into the fetal brain and improve symptoms of rats with Parkinson’s disease[J].Proc Natl Acad Sci U S A,2008,105(15):5856-5861.
[3] Marchetto MC,Carromeu C,Acab A,et al.A model for neural development and treatment of Rett syndrome using human induced pluripotent stem cells[J].Cell,2010,143(4):527-539.
[4] Urbach A,Bar-Nur O,Daley GQ,et al.Differential modeling of fragile X syndrome by human embryonic stem cells and induced pluripotent stem cells[J].Cell Stem Cell,2010,6(5):407-411.
[5] Hagleitner MM,LankesterA,Maraschio P,etal.Clinical spectrum of immunodeficiency,centromeric instability and facial dysmorphism(ICF syndrome)[J].J Med Genet,2008,45(2):93-99.
[6] Jiang YL,Rigolet M,Bourc'his D,et al.DNMT3B mutations and DNA methylation defect define two types of ICF syndrome[J].Hum Mutat,2005,25(1):56-63.
[7] Wu Z,Huang K,Yu J,et al.Dnmt3a regulates both proliferation and differentiation of mouse neural stem cells.J Neurosci Res,2012,90(10):1883-1891.
[8] Watt Fand Molloy PL Cytosine methylation prevents binding to DNA of a HeLa cell transcription factor required for optimal expression of the adenovirus major late promoter[J].Genes Dev,1988,2(9):1136-1143.
[9] Lorincz MC,Schubeler D and Groudine M Methylationmediated proviral silencing is associated with MeCP2 recruitment and localized histone H3 deacetylation[J].Mol Cell Biol,2001,21(23):7913-7922.
[10] Ehrlich M,Sanchez C,Shao C,et al.ICF,an immunodeficiency syndrome:DNA methyltransferase 3B involvement,chromosome anomalies,and gene dysregulation[J].Autoimmunity,2008,41(4):253-271.
