超临界CO2绿色萃取人参皂苷Rh1、人参皂苷Rh2的研究
2012-10-20姜晓晴魏福祥姜旭萍张尚正
姜晓晴,魏福祥,张 楠,姜旭萍,许 嫔,张尚正
(河北科技大学环境科学与工程学院,河北石家庄 050018)
人参为五加科植物人参(Panax ginseng C.A.Meyer)的干燥根,作为珍贵药材,具有大补元气、复脉固脱、补脾益肺之功能[1]。西洋参叶为五加科植物,其主要有效成分为人参皂苷,由于其在抗肿瘤方面毒性较低,具有显著提高机体免疫功能,因而日益受到人们的关注。人参皂苷Rh1为20(S)-原人参三醇型皂苷[2],具有极高的生理活性,在抑制癌细胞增殖、抗肿瘤等方面体现了良好的药效[3],因而获得人参皂苷Rh1单体对深入研究其药理作用具有重要意义。人参皂苷Rh2具有诱导癌细胞分化逆转作用,对多种癌细胞的增殖具有直接抑制作用[4]。
人参皂苷的提取主要分为物理、化学方法[5-7](酸解法、碱解法、半合成法)和生物方法[8-11](酶解法、微生物代谢法)。采用超临界CO2萃取人参皂苷的报道有很多,但是将超临界CO2萃取技术应用到人参皂苷Rh1、人参皂苷Rh2的萃取中的研究较少。超临界萃取技术作为绿色、环境友好的技术被广泛地应用于食品[12]、制药[13-14]、化工、环境等领域。笔者采用超临界CO2萃取技术提取西洋参中的人参皂苷Rh1、人参皂苷Rh2,不但得率较高,而且一次性提取量大,有利于工业生产。该技术是一种绿色环保的新型技术,能够缓解工业生产对环境造成的压力。
1 实验部分
1.1 仪器与设备
HA221-50-60超临界CO2萃取装置(江苏华安公司提供);高效液相色谱仪(日本岛津公司提供);电子天平(上海良平仪器仪表有限公司提供)。
1.2 材料与试剂
人参总次苷原料(某中药研究所提供);人参皂苷Rh1、人参皂苷Rh2标准品(中国药品生物制品检定所提供)。
乙腈(用作流动相,色谱纯,体积分数为99.9%,天津市康科德科技有限公司提供);二次蒸馏水;磷酸(分析纯,天津市永大化学试剂厂提供);甲醇、乙醇、乙酸乙酯(色谱纯,天津市永大化学试剂厂提供)。
1.3 实验方法
1.3.1 人参皂苷Rh1、人参皂苷Rh2的萃取
准确称取人参总次苷100g放入物料袋中并向其中注入适量夹带剂(乙酸乙酯),封口,放入萃取釜中。将萃取釜安装到超临界设备,在夹带剂罐中加入所需体积的夹带剂,设定压力、温度,通入CO2,启动设备,用试剂瓶在出口处收集萃出物。
1.3.2 人参总次苷原料的测定
称取一定量的人参总次苷原料,用甲醇溶解配制成质量浓度为0.5mg/mL的溶液,注入液相色谱仪中测定,得原料中人参皂苷Rh1的含量(质量分数,下同)为24.24%,人参皂苷Rh2的含量为13.76%,人参总次苷原料液相色谱图见图1。
1.3.3 人参皂苷Rh1、人参皂苷Rh2的测定
1)标准曲线的制备
采用高效液相色谱法测定人参皂苷Rh1、人参皂苷Rh2。分别精确称取人参皂苷Rh1标准品、人参皂苷Rh2标准品6mg于10mL容量瓶中,用甲醇溶解、定容、摇匀,得0.6mg/mL的人参皂苷Rh1标准溶液、0.6mg/mL人参皂苷Rh2标准溶液。分别吸取上述标准溶液1,2,4,6,8,10μL注入液相色谱仪测定,测定结果以进样量为横坐标,峰面积为纵坐标,绘制标准曲线,得到人参皂苷Rh1的回归方程为Y=44 427X-3 930.9,R=0.999 6;人参皂苷Rh2的回归方程为Y=451 322X-837.94,R=0.999 7。

图1 人参总次苷原料液相色谱图Fig.1 HPLC spectra of total saponins
2)样品的测定
精确量取萃取物1mL,用甲醇定容至10mL,吸取10μL注入高效液相色谱仪中,测定,并计算人参皂苷Rh1、人参皂苷Rh2的得率。
2 结果与讨论
2.1 夹带剂的选择
夹带剂是在纯超临界流体中加入的一种少量的、可以与之混溶的、具有挥发性的、介于被分离物质与超临界组分之间的某一种或多种物质的混合物[15]。目前常用的夹带剂有醇类、丙酮、乙酸乙酯等极性物质[16]。
本研究在萃取温度为45℃、萃取压力为30MPa、萃取时间为3h的条件下,分别用甲醇、乙醇(体积分数为95%)和乙酸乙酯作夹带剂进行实验,测定人参皂苷Rh1和人参皂苷Rh2的得率。结果见表1。由表1可知,用乙酸乙酯作为夹带剂时人参皂苷Rh1和人参皂苷Rh2的得率最高,因此选用乙酸乙酯作为夹带剂。
在前述相同条件下,分别用100,200,300,400,500mL乙酸乙酯作夹带剂进行实验,实验结果如图2所示。可以看出,在夹带剂的量小于300mL时人参皂苷Rh1、人参皂苷Rh2的得率随夹带剂用量的增加而逐渐增加;当夹带剂的量大于300mL时,人参皂苷的得率基本不变,所以选择300mL乙酸乙酯作夹带剂。
在45℃,30MPa及提取时间为3h的条件下,用300mL乙酸乙酯作动态或静态夹带剂进行实验,测定其提取物中Rh1和Rh2的含量。结果见表2。

表1 夹带剂种类的影响Tab.1 Effect of cosolvent sort

表2 夹带剂的加入方式的影响Tab.2 Effect of cosolvent join way
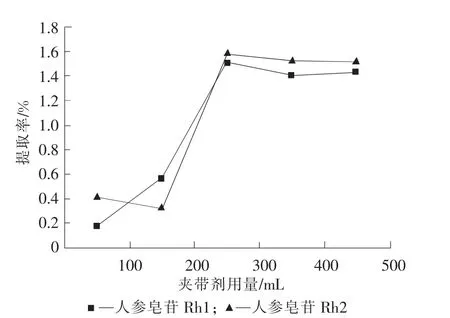
图2 夹带剂用量的影响Fig.2 Effect of cosolvent volume
由表2可知,用10mL乙酸乙酯作固态夹带剂、290mL乙酸乙酯作动态夹带剂时的得率明显高于300mL乙酸乙酯全部作动态夹带剂时的得率,所以选择10mL乙酸乙酯作固态夹带剂,290 mL乙酸乙酯作动态夹带剂。
2.2 单因素实验
2.2.1 温度对人参皂苷得率的影响
在温度分别为25,35,45,55,65℃,压力为30MPa,萃取3h,用10mL乙酸乙酯作固态夹带剂,290mL乙酸乙酯作动态夹带剂的条件下,进行人参皂苷提取实验。实验结果见图3。
由图3可知,人参皂苷Rh1、人参皂苷Rh2的得率随萃取温度的升高先增大后减小,萃取温度为45℃时,两者的得率最高,所以萃取温度选择45℃。
2.2.2 压力对人参皂苷得率的影响
在压力分别为10,20,30,40,50MPa,温度45℃,萃取3h,用10mL乙酸乙酯作固态夹带剂,290mL乙酸乙酯作动态夹带剂的条件下,进行人参皂苷提取的实验。实验结果见图4。

图3 萃取温度对人参皂苷得率的影响Fig.3 Effect of temperature on ginsenoside extraction rate
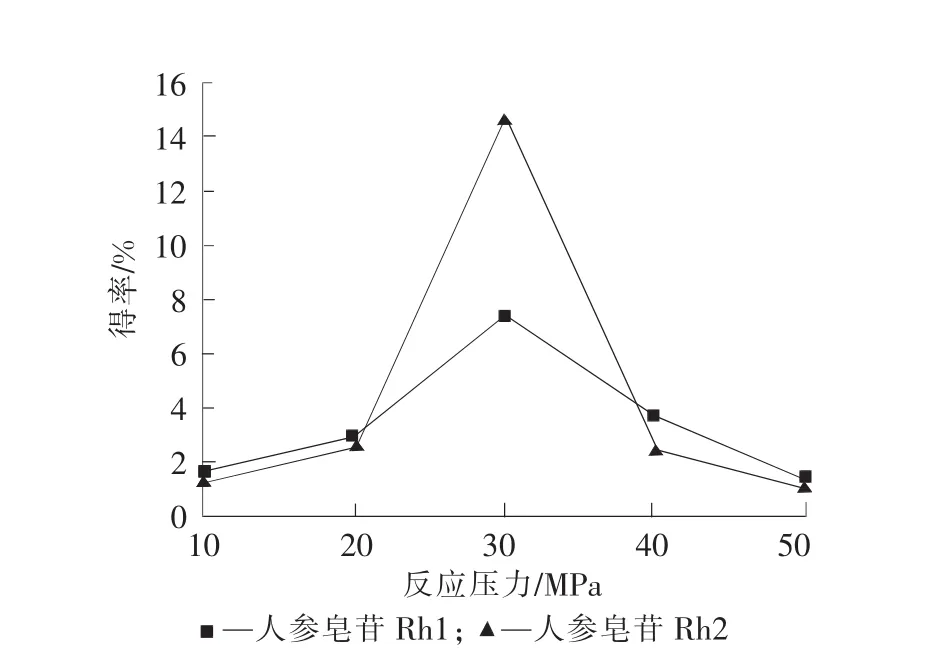
图4 萃取压力对人参皂苷得率的影响Fig.4 Effect of pressure on ginsenoside extraction rate
由图4可知,当压力小于20MPa、大于40MPa时,人参皂苷的得率明显偏低;人参皂苷Rh1、人参皂苷Rh2的得率随萃取压力的升高先增大后减小,在30MPa时达到最高,所以萃取压力选择30MPa。
2.2.3 萃取时间对人参皂苷得率的影响
在萃取时间分别为1,2,3,4,5h,温度为45℃,压力为30MPa,以10mL乙酸乙酯作固态夹带剂,290 mL乙酸乙酯作动态夹带剂的条件下,进行人参皂苷提取的实验。实验结果见图5。
由图5可知,当萃取时间小于2h、大于4h时,人参皂苷的得率急剧降低;萃取时间为3h时,人参皂苷的得率较高,因此选择萃取时间为3h。
2.3 正交试验
根据上述实验结果,确定了以10mL乙酸乙酯作固态夹带剂,290mL乙酸乙酯作动态夹带剂,为优化实验条件,对温度、压力、萃取时间做三因素三水平的正交试验,因素水平安排见表3,结果与分析见表4和表5。

表3 各因素及水平选择Tab.3 Affecting factors and levels
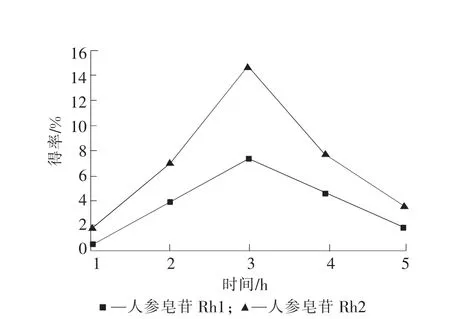
图5 萃取时间对人参皂苷得率的影响Fig.5 Effect of extraction time on ginsenoside extraction rate
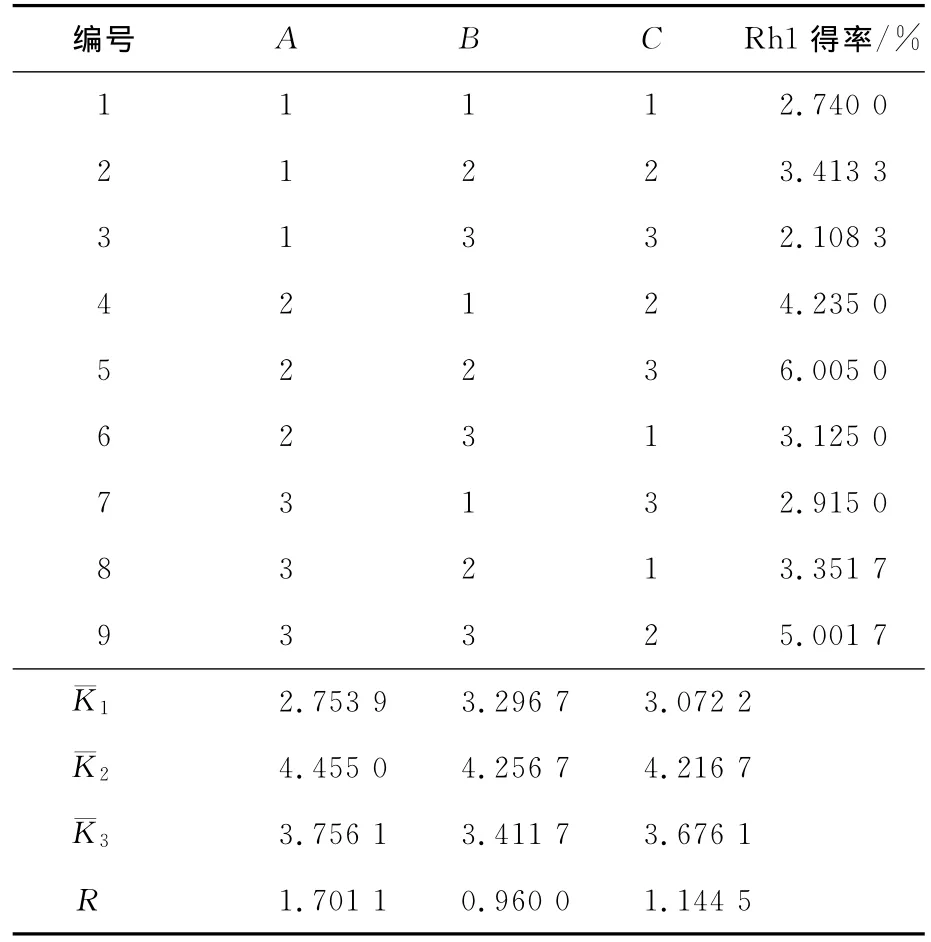
表4 人参皂苷Rh1正交试验设计与结果Tab.4 Scheme and experimental results of orthogonal array design of ginsenoside Rh1

表5 人参皂苷Rh2正交试验结果及极差分析Tab.5 Scheme and experimental results of orthogonal array design of ginsenoside Rh2
由正交试验可以得出,各因素对人参皂苷Rh1得率的影响顺序为温度>萃取时间>压力;提取的最优方案为A2B2C2,即萃取温度为45℃、萃取压力为30MPa、萃取时间为3h的条件下人参皂苷Rh1的得率最高。
由正交试验可以得出,各因素对人参皂苷Rh2得率的影响顺序为温度>压力>萃取时间;得到最优方案为A2B2C2。
结合人参皂苷Rh1、人参皂苷Rh2的正交试验结果,得到萃取的最佳条件:萃取温度为45℃、萃取压力为30MPa、萃取时间为3h。萃取产物液相图谱见图6。
3 结 论
选用10mL乙酸乙酯作固态夹带剂,290mL乙酸乙酯作动态夹带剂,综合实验结果,最终确定超临界CO2提取人参皂苷Rh1和人参皂苷Rh2的条件:萃取温度为45℃、萃取压力为30MPa、萃取时间为3h,10mL乙酸乙酯作固态夹带剂、290mL乙酸乙酯作动态夹带剂。在此最佳条件下,人参皂苷Rh1和人参皂苷Rh2的得率分别为7.33%,14.69%。采用超临界CO2萃取人参皂苷Rh1、人参皂苷Rh2,方法简便,制取过程绿色环保,污染小,收率较高。
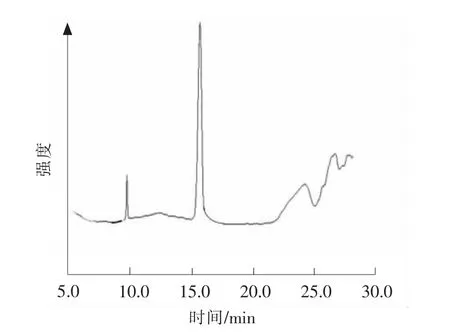
图6 萃取产物液相色谱图Fig.6 HPLC spectra of products
[1] 张 萍,王金东,肖新月,等.人参化学成分分析方法的研究进展[J].中草药(Chinese Herbal Medicines),2004,35(12):1 429-1 432.
[2] 张均田.人参冠百草-人参化学、生物学活性和药代动力学研究进展[M].北京:化学工业出版社,2008.
[3] 金凤燮.天然产物生物转化[M].北京:化学工业出版社,2009.
[4] 梁 伟,孙铁民,金 雨,等.西洋参茎叶总皂苷制取人参皂苷Rh2的应用研究[J].中华中医药学刊(Chinese Archives of Traditional Chinese Medicine),2004,22(5):957-958.
[5] CUI J F,GARLE M,LUND E,et al.Analysis of ginsenosides by chromatography and mass spectrometry:Release of 20S-protopanaxadiol and 20S-protopanaxatriol for quantitation[J].Analytical Biochemistry,1993,210(2):411-417.
[6] HAN B H,PARK M H,HAN Y N,et al.Degradation of ginseng saponins under mild acidic conditions[J].Planta Med,1982,44(3):146-149.
[7] CHA B C,LEE S G.Preparation of ginsenoside-Rh2from dammarane saponins of Panax ginseng leaves[J].Yakhak Hocechi,1994,38(4):425.
[8] 姜彬慧,韩 颖,赵余庆,等.酶转化三七叶总皂苷制备人参皂苷C-K的工艺优化[J].中草药(Chinese Herbal Medicines),2004,35(9):986-988.
[9] 喻春皓,魏 峰,何志敏.酶法修饰人参茎叶总皂苷及其 HPLC图谱研究[J].中草药(Chinese Herbal Medicines),2007,38(1):46-50.
[10] LI Guo-hong,SHEN Yue-mao,ZHANG Ke-qin.A new saponin transformed from ginsenoside Rhl byBacillussubtilis[J].Chinese Chemical Letters,2005,16(3):359-361.
[11] 董阿玲,崔亚君,郭洪祝,等.人参皂苷Rg1的微生物转化研究[J].中国药学:英文版(Journal of Chinese Pharmaceutical Sciences),2001,10(3):115-118.
[12] 李雪梅,赵国群,李再兴.超临界流体萃取技术及其在食品工业中的应用[J].河北科技大学学报(Journal of Hebei University of Science and Technology),1999,20(2):68-71.
[13] 蒋静智,李志义,刘学武.超临界流体技术制备中药超细粉体[J].河北工业科技(Hebei Journal of Industrial Science and Technology),2010,27(6):381-384.
[14] 常虹飞,杨 震.正交试验法优选超临界CO2流体萃取丹参中丹参酮工艺的研究[J].河北工业科技(Hebei Journal of Industrial Science and Technology),2008,25(6):352-353.
[15] 陈维忸.超临界流体萃取的原理和应用[M].北京:化学工业出版社,2000.
[16] DOBBS J M,WONG J M,LAHIERE R J,et al.Modification of supercritical fluid phase behavior using polar cosolvents[J].Ind Eng Chem Res,1987,26(1):56-65.
