负温下的热力学第二定律
2012-10-17孙元和
孙元和
(赤峰学院 物理与电子信息工程系,内蒙古 赤峰 024000)
负温下的热力学第二定律
孙元和
(赤峰学院 物理与电子信息工程系,内蒙古 赤峰 024000)
在热力学第二定律的开尔文表述中,指出热功转化的方向性,但在特定的条件下,会出现特殊情况.本文在讨论卡诺循环的基础上,指出了在负热力学温度条件下的开尔文表述.
开尔文表述;卡诺循环;负热力学温度;卡诺循环
在热力学第二定律的教学中,我们都习惯地指出,功完全转换为热,在理论上是可以实现的.而热完全转化为功却是不可实现的.这一点在有限的系统和热力学温度T>0的情况下是正确的.
然而,随着科学技术的飞速发展,人们在LiF单晶体的核磁共振实验中发现,核自旋系统可以处于负的热力学温度状态.那么在T<0的状态下,热功转换或功热转换有何变化呢?
为了说明这一点,我们假定有一可逆卡诺循环工作于负的热力学温度Ti和Tj之间,且Ti>Tj(即Ti作为高温热源,Tj作为低温热源).
该卡诺循环在作正循环时,系统从Ti处吸收Q1的热量,其中一部分Q2放出给低温热源Tj处,另一部分对外作功,即W=Q1-Q2.其循环效率为:
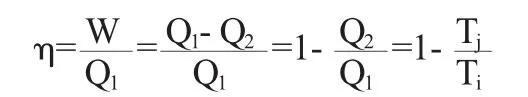
由于 Ti<0,Tj<0,且 Ti>Tj,即,则有

即循环效率是负值,这里Q1是吸热,取正值,由(1)式可知,必然是取负值,即外界对系统作功,如图1所示.
在作逆循环的工程中,在Tj处吸收热量Q2,放出热量Q1给Ti,功为W=Q2-Q1,此时,循环的效率为:
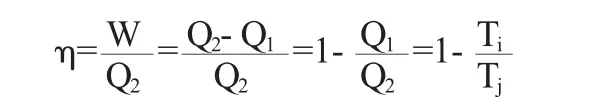
由于 Ti<0,Tj<0,且 Ti>Tj,即则有

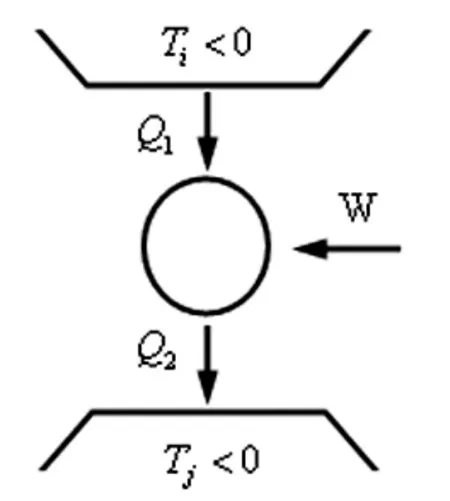
图1
这说明循环对外界作了正功,如图2所示.下面在热力学第一定律的基础上讨论热与功和功与热的转换情况.
1.由(1)式知,W为负值,则系统从Ti处吸热Q1,一部分放给Tj,但却没有对外作功,而是外界对系统作功,这说明外界作功才能维持循环进行.同时系统在循环过程中,向低温热源Tj放出热量Q2,而Q2却不能自动地返回到高温热源Ti中去,因此,若不产生其他影响,在T<0的条件下,功不可能完全转化为热.
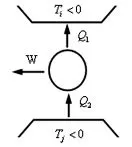
图2
2.由(2)式知,在逆向卡诺循环中,热量从低温热源流向高温热源,同时系统对外界作了正功(这符合热力学第二定律的克劳修斯表述),如果我们在深入一步,通过热接触的方式,如图3所示,让高温热源Ti获得的热量Q2,自动的流回到低温热源Tj中去,那么这一过程的唯一效果是从单一的低温热源取热Q2-Q1,并使之完全转化为功.这就是说,在T<0的条件下,热完全转变为功是可以自发进行的过程.这一结果显然与热力学第二定律的开尔文表述相矛盾,可以考虑把开尔文表述修改为“不可能从一个正温热源取热使之完全转变为功,或者作功把热传给一个负温热源,而不产生其它影响”.
3.T<0的条件下,逆循环的结果与在T>0的条件下,作卡诺循环的工作物质从高温热源取热,一部分放给低温热源,一部分作功的结果相似.可以推知Tj要比Ti更热些,再进一步推断,系统在T<0的状态,要比T>0的状态具有更多的能量.
综上所述,在T>0的条件下,功可以自发地转变为热,而热不能自发地转变为功,在T<0的条件下,功不能自发的完全转化为热,而热可以自发地转化为功.综合两个方面的情况,可以说在一定的条件下,功可以完全转化为热,热也可以完全转化为功,但这并不说明热力学第二定律的开尔文表述不正确,只是在特定条件下的一种特殊情况而已.
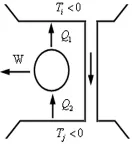
图3
〔1〕黄淑清,聂宜如.热学教程[M].北京:高等教育出版社,1994.
〔2〕程守洙,江之永.普通物理学[M].北京:高等教育出版社,1998.
〔3〕汪竹溪.统计物理学导论[M].北京:高等教育出版社,1965.
〔4〕汪志诚.热力学统计物理[M].北京:人民教育出版社,1980.
O642
A
1673-260X(2012)03-0008-01
