载镍金属有序介孔氧化铝催化一氧化碳甲烷化反应性能研究*
2012-10-17赵瑞红胡会杰
赵瑞红 ,胡会杰 ,郭 奋
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.北京化工大学教育部超重力工程研究中心)
近年来,介孔氧化铝合成得到广泛发展[1-6]。具有高比表面积及窄孔径分布的介孔氧化铝已被成功合成,推动了其在催化领域的应用研究[7-9]。含镍催化剂被广泛应用于许多加氢反应中,而含镍介孔氧化铝的催化性能研究尤为受到重视[10]。 P.Kim等[11]报道了将负载Ni、Mg金属介孔氧化铝催化剂用于二氯苯加氢反应中,NiMg-NP催化剂在此类催化反应中具有很高的催化活性及抗失活性能。然而,上述报道中合成含Ni催化剂所用的铝源及模板剂为价格昂贵的有机铝盐和表面活性剂,催化剂的制备成本很高。笔者将Ni金属负载于采用两种方法制备的介孔氧化铝上:一种在已有的研究基础[12]上以廉价的无机铝盐和聚乙二醇1540为原料,采用传统的沉淀法合成;另一种以异丙醇铝经水解制得。两种催化剂均采用一氧化碳甲烷化反应测定其催化性能,并与负载Ni金属普通氧化铝进行对比。
1 实验部分
1.1 催化剂制备
1.1.1 有序介孔氧化铝的制备
以不同铝源合成有序介孔氧化铝并分别标记为IOA和OA。IOA是以廉价的无机铝盐为铝源,聚乙二醇1540为模板剂,采用传统沉淀法合成[12]。合成的介孔氧化铝具有蠕虫状孔道结构,比表面积可达250~300 m2/g,且孔径分布在6 nm左右。OA是以P123和Triton-100作为复合模板剂,以异丙醇铝为铝源水解制得。两种模板剂在仲丁醇中混合后分成两部分,一部分加入一定量蒸馏水,另一部分以1 mL/min速度加入一定量有机铝,将两部分混合,反应5h后生成白色沉淀,过滤,室温风干24 h,353 K烘干6 h,经煅烧制得具有高比表面积(400~500 m2/g)及窄孔径分布的有序介孔氧化铝。
1.1.2 含镍介孔氧化铝的制备
以硝酸镍为镍源,采用浸渍法制得含镍介孔氧化铝。将一定浓度的硝酸镍溶液与介孔氧化铝粉末混合后用超声波分散,混合溶液置于真空及冰水浴中40min,抽滤,烘干,在723K煅烧5h即得产品。以OA及IOA制得的催化剂分别标记为OAF、IOAF。
1.1.3 含镍普通氧化铝的制备
含镍普通氧化铝(GYA)的制备与负载Ni金属介孔氧化铝的制备方法相同。标记为GYAF。
1.2 催化剂表征
催化剂的孔结构采用低温N2吸附法在NOVA 2000型N2物理吸附仪上测定,比表面积采用BET法计算,孔容和孔分布采用BJH方程计算。催化剂的孔结构、Ni粒子大小及分布用JEM-4000型透射电镜观察。在D/max 2500 VB2+/PC型X射线粉末衍射仪上采用小角度XRD验证催化剂孔结构的有序性,铝和镍的晶相采用大角度XRD检测。采用Chem Bet 3000型化学吸附仪对催化剂进行TPR检测,以10℃/min由室温升到800℃,催化剂用量0.03 g,氢气和氮气混合流量为28 mL/min。采用Optima 5300DV型电感耦合等离子体发射光谱仪对催化剂中Ni和Al含量进行检测。采用ESCALAB250型X射线光电子能谱仪对催化剂表面的Ni含量及结合能进行测定。
1.3 一氧化碳甲烷化反应
催化反应在不锈钢固定床管式反应器中进行。在直径为4 mm的反应管中加入0.3 g催化剂并通入甲醇合成气 (CO体积分数为4%,H2体积分数为72%)。一氧化碳甲烷化反应在压力2.0 MPa、温度为503~673 K下进行。反应产物采用GC-4000A型气相色谱分析仪在线检测。
2 结果与讨论
2.1 介孔氧化铝及含镍催化剂结构特征
不同介孔氧化铝及含镍催化剂以及普通氧化铝及含镍催化剂的结构特征见表1;N2等温吸附-脱附曲线见图1~图3。由图1~图3看出,两种介孔氧化铝均具有典型IV型迟滞环及较窄的孔径分布。由有机铝源制得的介孔氧化铝的比表面积、平均孔径及孔容均大于普通氧化铝。而且,以无机铝源制得的介孔氧化铝与普通氧化铝相比其孔径分布窄。浸渍后,所有含镍催化剂的比表面积均有不同程度的降低,N2等温吸附-脱附曲线及孔径分布有所改变。

表1 有序介孔氧化铝及含镍催化剂结构特征
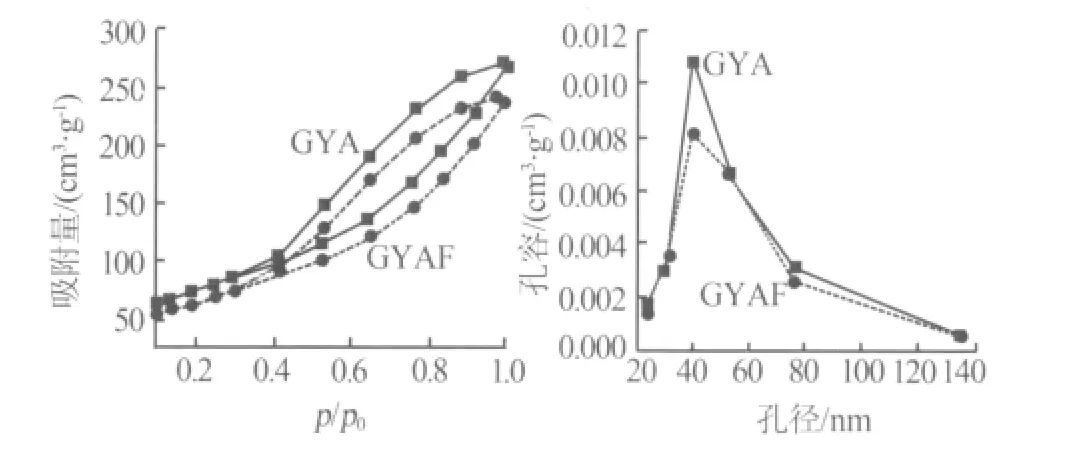
图1 GYA、GYAF氮等温吸附-脱附曲线以及孔径分布曲线
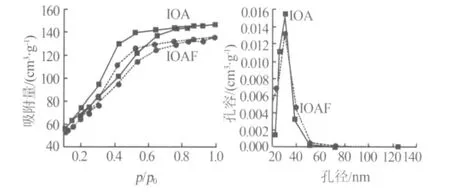
图2 IOA、IOAF氮等温吸附-脱附曲线以及孔径分布曲线

图3 OA、OAF氮等温吸附-脱附曲线以及孔径分布曲线
2.2 ICP及XPS分析
制备的含镍催化剂中Ni和Al的含量采用ICPOES检测,结果见表2。由表2看出:OAF比GYAF具有更高的Ni含量,这主要归因于OA比GYA具有较高的比表面积、大的孔容和孔径;IOAF和GYAF的Ni含量相差不多。采用XPS测定Ni2p的结合能以确定镍物种价态,结果列于表3及图4。由表3看出,OAF的Ni含量高于GYAF的Ni含量,与ICPOES检测结果相符。由图4看出,纯氧化镍及偏铝酸镍的结合能分别为855 eV和857 eV[13],而所有含镍金属催化剂均有介于855 eV和857 eV的强峰,可推知所有催化剂上镍物种主要以偏铝酸镍和氧化镍两种价态存在。值得注意的是,IOAF的结合能接近855 eV,表明IOAF上的Ni主要以NiO存在。

表2 负载Ni金属催化剂ICP-OES检测结果

表3 负载Ni金属催化剂XPS检测结果
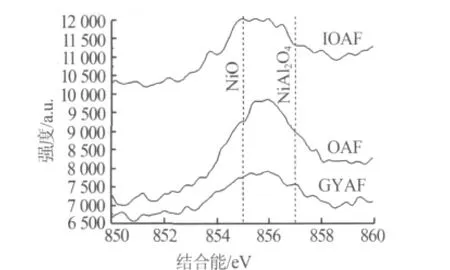
图4 负载Ni金属催化剂XPS表面结合能
2.3 XRD及TEM分析
GYAF、IOAF和OAF的大角度XRD谱图见图5。通过强峰出现的位置可以确定,含镍催化剂上Ni以偏铝酸镍存在,但并没有氧化镍的特征峰被检测到,这与文献研究结果相符[10-11]。

图5 不同含镍催化剂XRD谱图
图6是GYAF、IOAF和OAF的TEM照片。由图6看出,3种催化剂均未观察到氧化镍和偏铝酸镍粒子的存在,这与最近研究结果相符[10],但通过ICP-OES和XPS分析已经证明3种催化剂中存在镍组分,说明采用浸渍法在氧化铝上负载Ni金属时,由于分散状态的Ni颗粒非常小,有时在高倍透射电镜下无法观察到镍氧化物粒子的存在。由图6还可以看出,浸渍处理后仅有IOAF保留了有序孔道结构,相比之下GYAF及OAF仅存在无序的孔道结构,这表明,浸渍处理后的IOAF仍能保持稳定有序的结构,其是一种性能优良的催化剂载体。

图6 不同催化剂TEM照片
2.4 TPR分析
3种镍催化剂程序升温还原曲线如图7所示。已有研究[14-16]表明镍氧化物在载体中以3种状态存在:1)与载体以相对弱的作用力结合的氧化镍,载体仅仅起分散作用;2)氧化镍与载体以强的作用力结合;3)与载体结合成偏铝酸镍存在。由图7可以看出,GYAF和OAF在400℃和700℃出现了2个强的还原峰,分别对应上述镍氧化物的两种形态,300~600℃为载体以强的作用力结合在一起的氧化镍还原峰,它在还原过程中易形成活性中心且不易损失;600~800℃为偏铝酸镍还原峰,通过对比峰强可知,在GYAF和OAF中主要存在偏铝酸镍。另外,由于镍的流失而导致OAF峰值向低温区偏移,这与ICP-OES结果相一致,也与报道相符[16]。在 IOAF的还原曲线中,在400~600℃有很强的NiO还原峰存在,而偏铝酸镍还原峰很弱,因此,在IOAF中镍的存在形态主要以NiO为主,其原因在于IOA具有有序性好、骨架稳定的孔道结构。

图7 不同含镍催化剂TPR谱图
通过XPS和TPR分析结果可知:在合成的镍催化剂中氧化镍的存在并未得到XRD及TEM的验证,其原因可能是由于氧化镍与氧化铝因某种作用而相互结合且氧化镍高度分散于催化剂上,颗粒过于细小,从而无法检测到。
2.5 一氧化碳甲烷化反应催化活性
图8为不同含镍催化剂在一氧化碳甲烷化反应中的催化活性。显然,OAF及IOAF比GYAF具有更高的催化活性,尤其是OAF,在相同反应温度下其催化活性要比GYAF高3倍。这主要是由于OAF比表面积大,吸附能力强,镍负载量高,ICP测试结果也证实此点。图9为OAF催化性能随时间的变化曲线,在一定时间内其催化活性并未降低,表明OAF活性稳定,采用瞬间活性检测其催化性能是合理的。
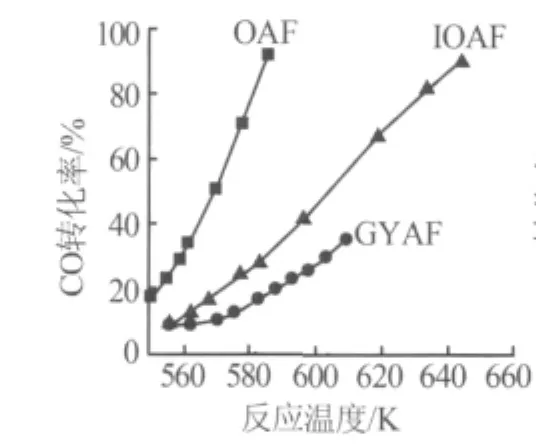
图8 不同催化剂一氧化碳转化率

图9 OAF一氧化碳转化率随时间变化曲线
3 结论
在制备的两种有序介孔氧化铝基础上,采用传统浸渍法成功制备出具有高催化活性的含镍有序介孔氧化铝催化剂。由表征结果可知:制备的两种介孔氧化铝比普通氧化铝具有更高的Ni负载量和更好的Ni分散性能,这主要归因于OAF的高比表面积及IOAF的稳定介孔结构。镍主要以两种形态存在于制备的镍催化剂上,以异丙醇铝水解制得的介孔氧化铝,由于氧化镍与氧化铝间的强相互作用,镍金属主要以偏铝酸镍的形态存在;而由无机铝盐沉淀法制备的介孔氧化铝结构稳定,负载的镍金属主要以氧化镍的形态存在。催化结果表明:由于合成的介孔氧化铝比普通氧化铝具有更高的镍负载量及更好的镍分散性能,因而在一氧化碳甲烷化反应中表现出更高的催化活性。因此,此两种介孔氧化铝在催化方面具有重要的应用价值。
[1]Bagshaw S A,Pinnavaia T J.Mesoporous alumina molecular sieves[J].Angew.Chem.Int.Ed.Engl.,1996,35(10):1102-1105.
[2]Vaudry F,Khodabandeh S,Davis M E.Synthesis of pure alumina mesoporous materials[J].Chem.Mater.,1996,8(7):1451-1464.
[3]Xu B J,Xiao T C,Yan Z F,et al.Synthesis of mesoporous alumina with highly thermal stability using glucose template in aqueous system[J].Microporous Mesoporous Mater.,2006,91:293-295.
[4]Deng W,Bodart P,Pruski M,et al.Characterization of mesoporous alumina molecular sieves synthesized by nonionic templating [J].Microporous Mesoporous Mater.,2002,52(3):169-177.
[5]Liu X H,Wei Y,Jin D L,et al.Synthsis of mesoporous aluminum oxide with aluminum alkoxide and tartaric acid[J].Mater.Lett.,2000,42:143-149.
[6]Valange S,Guth J L,Kolenda F,et al.Synthesis strategies leading to surfactant-assisted aluminas with controlled mesoporosity in aqueous media[J].Microporous Mesoporous Mater.,2000,35:597-607.
[7]Lenarda M,Moretti E,Storaro L,et al.Finely dispersed Pd-Zn catalyst supported on an organized mesoporous alumina for hydrogen production by methanol steam reforming[J].Appl.Catal.A:General,2006,312:220-228.、
[8]Kaluza L,Zdrazil M,Zilkova N,et al.High activity of highly loaded MoS2hydrodesulfurization catalysts supported on organised mesoporous alumina[J].Catal.commun.,2002,3:151-157.
[9]ValangeS,DerouaultA,BarraultJ,et al.One-step generation of highly selective hydrogenation catalysts involving sub-nanometric Cu2O supported on mesoporous alumina:strategies to control their size and dispersion[J].J.Mol.Catal.A:Chem.,2005,228(1):255-266.
[10]Kim P,Kim Y H,Kim H,et al.Synthesis and characterization of mesoporous alumina with nickel incorporated for use in the partial oxidation of methane into synthesis gas[J].Appl.Catal.A:General,2004,272:157-166.
[11]Kim P,Kim Y H,Kim H,et al.Preparation,characterization,and catalytic activity of NiMg catalysts supported on mesoporous aluminafor hydrodechlorination of o-dichlorobenzene[J].J.Mol.Catal.A:Chem.,2005,231(1/2):247-254.
[12]Zhao R H,Guo F,Hu Y Q,et al.Self-assembly synthesis of organized mesoporous alumina by precipitation method in aqueous solution[J].Microporous Mesoporous Mater.,2006,93(1/2/3):212-216.
[13]Lee K M,Lee W Y.Partial oxidation of methane to syngas over calcined Ni-Mg/Al layered double hydroxides[J].Catal.Lett.,2002,83(1):65-70.
[14]Chen I,shiue D W.Reduction of nickel-alumina catalysts[J].Ind.Eng.Chem.Res.,1988,27(3):429-434.
[15]Martin G,Demongolfier P,Imelik B.Comparaison des méthodes magnétiques à fort et à faible champ pour l′étude de l′adsorption de H2et de O2par des catalyseurs Ni SiO2[J].Surface Sci.,1973,36(2):675-688.
[16]Li C P,Chen Y W.Temperature-programmed-reduction studies of nickel-oxide alumina catalysts-effects of the preparation method[J].Thermochimica Acta,1995,256(2):457-465.
