TGF-β1基因修饰的脾细胞对大鼠肝脏移植免疫耐受的实验研究
2012-10-17闫振,李卫,吴波
闫 振,李 卫,吴 波
哈尔滨医科大学附属第四医院1.普外科;2.显微外科,黑龙江 哈尔滨 150001
肝脏移植(liver transplantation,LT)目前已成为治疗终末期肝病最有效的方法,然而同种异体排斥反应仍然是器官移植的主要障碍,虽然全身应用免疫抑制剂可以延长受体生存时间,但是可导致受体出现免疫功能低下,易发感染和肿瘤倾向[1]。郑树森等报道证实随着移植技术和免疫抑制剂的应用,LT患者的一年生存率有很大提高,为90%[2],如何有效减少排斥反应或抑制排斥反应,是目前器官移植的研究热点。转化生长因子β1是有效地免疫调控和免疫抑制分子,它在机体免疫系统中的广泛免疫抑制作用,对细胞免疫、体液免疫以及主要参与免疫反应的一些细胞因子都有调控作用[3]。TGF-β1在心脏移植、肾脏移植、血管移植中有广泛报道,但在肝脏移植中报道较少,本实验利用输注TGF-β1修饰的供者脾细胞研究TGF-β1质粒与肝脏移植的关系。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:供体为SD大鼠40只,受体Wistar大鼠40只,均为健康雄性,体质量为250~300 g,SPF级,均由哈尔滨医科大学实验动物中心提供。实验过程对动物处置符合动物伦理学标准。
1.1.2 主要试剂:脂质体2000试剂盒及Trizol试剂:美国Invitrogen公司;质粒pAdtrack-CMV-TGF-β1质粒和pAdEasy-1-Bj51833细胞株:华中科技大学同济医学院附属协和医院传染病实验室曾令兰教授惠赠;DP107-02高纯度质粒小量试剂盒:北京天根公司产品;RPMI 1640培养基及新生牛胎血清:奥地利PAA公司;台盼蓝染色试剂:上海碧云天产品;TUNEL检测试剂盒:上海罗氏公司。
1.2 方法
1.2.1 TGF-β1 质粒的制备:质粒 pAdtrack-CMVTGF-β1质粒和pAdEasy-1-Bj51833细胞株由华中科技大学同济医学院附属协和医院传染病实验室曾令兰教授惠赠。小量提取 DH5a细胞中的pAdtrack-CMVTGF-β1质粒,Pme I线性化后,1%琼脂糖凝胶电泳,紫外灯下切下目的条带,胶回收试剂盒回收连接产物的片段,取10 μL纯化后的 DNA片段转入感受态pAdEasy-1-Bj51833细胞中。铺Kana+抗性琼脂平板,培养16~20 h,挑取10~20个最小的克隆,用2 mL含0.025 g/L卡那霉素LB培养液振摇过夜,小量提取质粒,0.7%琼脂糖凝胶电泳,以pAdEasy-1作参照条带,与其大小相近的即为正确重组子。经鉴定为pAdtrack-CMV-TGF-β1质粒后大量扩增,分化提纯后备用。使用时用无菌生理盐水溶解。
1.2.2 TGF-β1基因修饰的脾细胞的制备:SD大鼠(6~8周)均在乙醚麻醉下无菌取脾,置于盛有不完全RPMI-1640培养液的培养皿中,用200目筛网研磨和红细胞裂解液处理后获得单个的脾细胞,再用不完全RPMI1640培养液洗涤3次,并用完全RPMI1640培养液(含10%体积/体积胎牛血清)调整终浓度至实验所需(5×106/mL),台盼蓝拒染法判定细胞活力>95%,待用。培养的胞转染前离心,置新鲜的RPMI 1640培养液中,使用脂质体2000试剂盒按照说明书转染脾细胞,转染的脾细胞每3天换1次培养液,10~14 d后选择建立稳定转染脾细胞株。
1.2.3 实验分组与大鼠原位肝脏移植模型的建立:供体为SD大鼠,受体为Wistar大鼠,均为健康雄性,体质量250~300 g,受体体质量略大于供体,术前12 h禁食,清洁手术。实验动物随机分成4组,每组10只:A组:肝移植组,术前7天受体经尾静脉输注生理盐水1 mL;B组:空质粒输注组,术前7天受体经尾静脉输注空质粒1 mL;C组:脾细胞输注组,术前7天受体经尾静脉输注脾细胞(5×106/mL)1 mL;D组:TGF-β1组,术前7天受体经尾静脉输注TGF-β1基因修饰的脾细胞(5×106/mL)1 mL。肝移植模型的建立采用Kamada二袖套法,并加以改进建立稳定的大鼠原位肝移植模型[4-5]。每组5只受体作为观察生存期之用,观察期以受体大鼠死亡为终点;另5只受体在移植后7天处死,观察移植肝组织病理学改变,肝脏功能和凋亡的变化。各组因术中、术后发生感染、血栓形成、胆管梗阻等并发症死亡的大鼠不列入统计之内。
1.3 检测指标
1.3.1 肝功能检测:手术后第 3、5、7天,在麻醉状态下,通过手术后大鼠的阴茎背静脉采血0.5 mL(不抗凝),化验肝功能,检测血清谷丙转氨酶(ALT)、血清总胆红素值(TBIL)。抽血后再输入2 mL生理盐水作为补液。
1.3.2 凋亡指数:TUNEL检测步骤TUNEL染色切片脱蜡至水,蛋白酶K消化15 min 4%多聚甲醛固10 min:3%H2O2,室温封闭 10 min:0.1%TritonX-100 冰浴 2 min,每片加 50 μL,TUNEL 混合液,37 ℃ 1 h,每片加50 μL POD,37℃ 30 min,每步间 PBS洗3次。DAB显色,水性封片剂液体封片,拍照。结果判定:应用TUNEL法检测,凋亡细胞胞核呈棕色,胞质一般不着色或着色淡,高倍视野下阳性细胞的百分数(%)作为凋亡指数(AI)。
1.3.3 排斥反应分析:手术后第7天,从各组随机取5只受体鼠,予以麻醉,在麻醉情况下,取移植肝脏标本,以10%的甲醛固定,行HE染色后进行组织学观察。根据Banff排异活动指数(RAI)评分体系分级,在光镜下观察急性排斥反应的程度。
1.4 统计学分析 应用SPSS 13.0统计软件分析,实验所得数据以均数±标准差()表示,组间差异用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 稳定转染脾细胞基因的表达 采用绿色荧光蛋白转染到TGF-β1基因修饰的脾细胞中,稳定转染的脾细胞同时表达TGF-β1蛋白和绿色荧光蛋白,荧光显微镜下可见稳定表达的脾细胞都激发绿色荧光(见图1)。
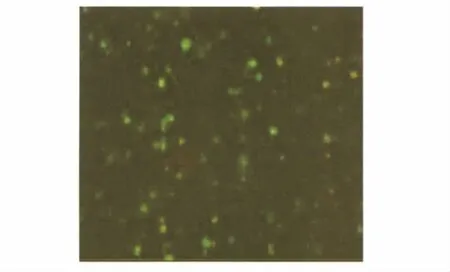
图1 荧光显微镜下见筛选后的脾细胞都激发绿色荧光,说明转染后的脾细胞稳定表达TGF-β1蛋白Fig 1 Fluorescence microscope,filtered spleen cells to stimulate green fluores-cence,indicating that the spleen cells after transfection and stable expression of TGF-β1 protein
2.2 肝移植后各组第3、5、7天血清 ALT及血清TBIL检测 与肝移植组及空质粒组相比TGF-β1修饰的脾细胞组肝脏功能较好,差异有统计学意义(P<0.05),与脾细胞组相比,TGF-β1 修饰的脾细胞组改善肝功能较好(P <0.05)(见表1、表2)。
2.3 肝移植后各组凋亡指数(AI,%)TGF-β1组为39.2 ±5.11,脾细胞组 17.0 ±3.67,空质粒组为 7.60±1.51,肝移植组为 4.40 ±2.07。TGF-β1 组与肝移植组及空质粒组相比,差异有统计学意义(P<0.01),与脾细胞组相比,差异有统计学意义(P<0.05,见图2)。
2.4 各组病理学观察 肝移植组及空质粒组见排斥反应较重,示汇管区增宽,大量淋巴细胞浸润,并可见肝脏实质的破坏;脾细胞输注组,示肝细胞轻度淤血,中等量淋巴细胞浸润;TGF-β1组移植排斥反应较轻,汇管区形态规则,少量淋巴细胞浸润,属轻度排斥反应(见图3)。
2.5 肝移植术后各组存活时间 我们利用大鼠原位肝脏移植模型对TGF-β1修饰的脾细胞在大鼠肝脏移植免疫耐受中的作用进行研究发现TGF-β1基因修饰组(36.4 ±4.16)d,生存期较肝移植组(8.4 ±1.4)d、空质粒组(7.8±0.84)d明显延长,差异有统计学意义(P <0.01);与脾细胞组(20.0 ±4.00)d 相比,差异有统计学意义(P <0.05)。
表1 各组ALT结果(U/L,)Tab 1 ALT test results in each group(U/L,)

表1 各组ALT结果(U/L,)Tab 1 ALT test results in each group(U/L,)
与肝移植组和空质粒输注组相比,△P<0.05;与脾细胞输注组相比,※P<0.05
组别 例数3 d 5 d 7 d肝移植组5319.28 ±17.35 561.16 ±60.35 917.25 ±54.39空质粒输注组 5 325.08 ±17.34 570.33 ±60.46 924.72 ±56.16脾细胞输注组△ 5 287.62 ±21.06 216.07 ±30.50 201.62 ±33.28 TGF-β1 输注组△※5256.99 ±9.12 172.00 ±16.52 113.23 ±20.35
表2 各组血清TBIL结果(μmol/L,)Tab 2 TBIL test results in each group(μmol/L,)

表2 各组血清TBIL结果(μmol/L,)Tab 2 TBIL test results in each group(μmol/L,)
与肝移植组和空质粒组输注相比,△P<0.05;与脾细胞组输注相比,※P<0.05
3 d 5 d 7 d组别 例数
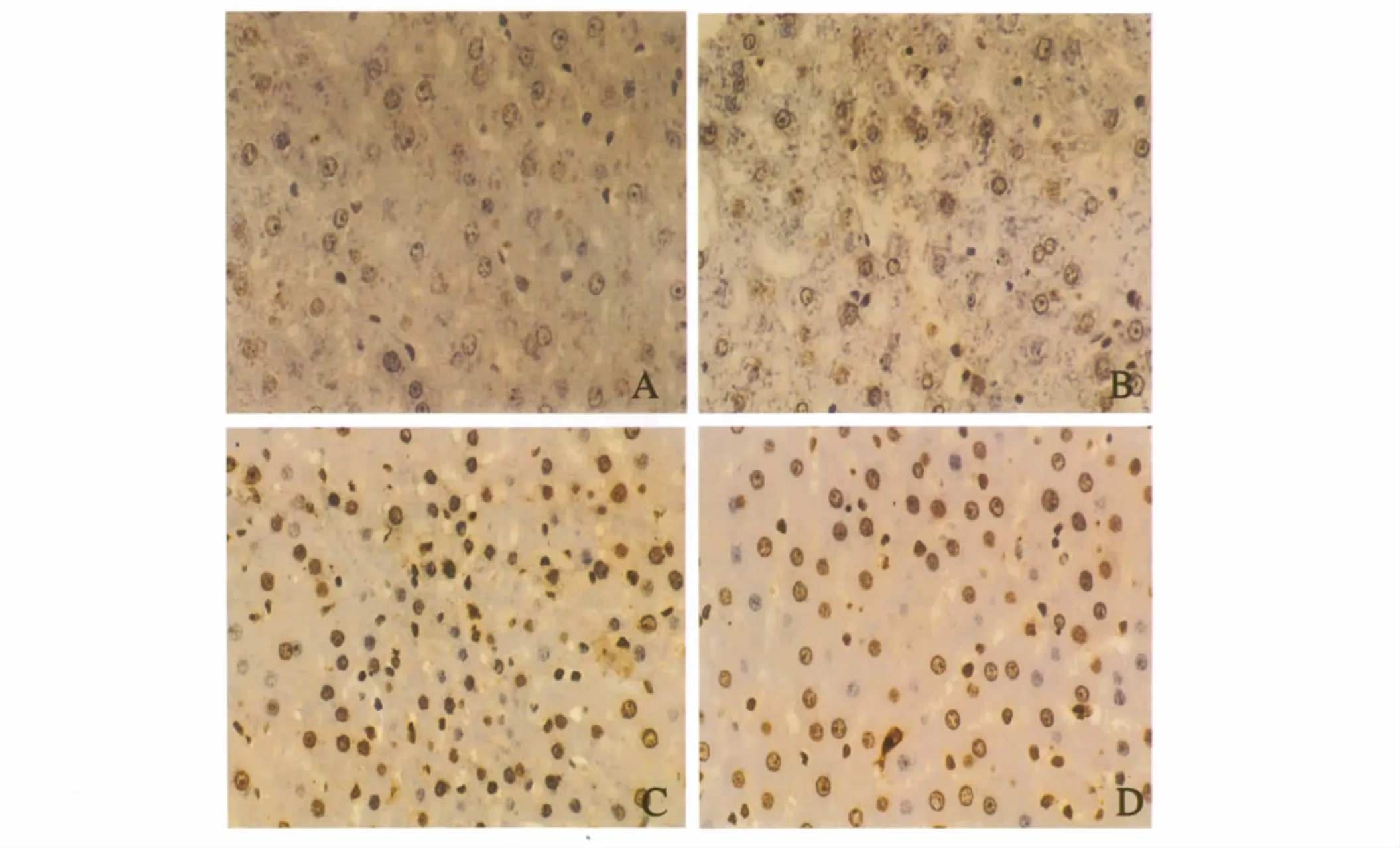
图2 各组大鼠术后第7天Tunel凋亡图中棕黄色颗粒为凋亡细胞(200×)A:肝移植组;B:空质粒输注组;C:脾细胞输注组;D:TGF-β1修饰的脾细胞输注组Fig 2 Tunel for liver tissues in each group at the end of 7th day,brown granules were apoptotic cells(Microscopy 200×)A:liver transplant group;B:empty vector infusion group;C:spleen cell infusion group;D:TGF-β1-modified spleen cell infusion group
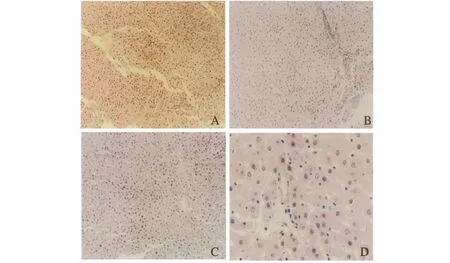
图3 各组大鼠术后第7天HE染色(100×) A:肝移植组;B:空质粒输注组;C:脾细胞输注组;D:TGF-β1修饰的脾细胞输注组Fig3 HE staining for liver tissues in each group at the end of 7th day(Microscopy 100×) A:liver transplant group;B:empty vector infusion group;C:spleen cell infusion group;D:TGF-β1-modified spleen cell infusion group
3 讨论
自1963年Satzrl成功实行了第1例人体原位肝移植以来,肝脏移植已成为治疗终末期肝脏疾病的重要手段。但是移植排斥反应已成为阻碍其进一步发展的突出矛盾。基因技术有可能发挥其独特作用,TGF-β1是一种重要的调节性细胞因子,对多种免疫活性细胞的增殖、分化、生物学功能起调节作用。人和鼠TGF-β1蛋白仅差一个氨基酸的不同[6]。TGF-β1具有强大的免疫抑制作用,是一种强效的免疫抑制性细胞因子,功能比环孢素还要强烈。TGF-β1抑制APC表面主要组织相容性复合物(MHCⅠ类、Ⅱ类分子)的表达[7],干扰APC的分化成熟,使T细胞无能;TGF-β1还可以抑制NK 细胞,LAK 细胞的增殖和分化[8-9]。TGF-β1的诸多生物学功能和研究表明,在移植免疫中,移植的长期存活和移植物的耐受都与TGF-β1的生成和分泌有关。Qin等[10]将 TGF-β1基因转移到心肌,监测移植物的存活情况。TGF-β1可抑制多种免疫细胞如T细胞、B细胞、NK细胞和细胞毒性T细胞等。Asderakis等[11]报道通过注射供体来源的 TGFβl基因修饰脾细胞,显著延长大鼠心脏移植的存活时间。Narumoto等[12]报道胆管细胞释放的TGF-β1可以减轻同种异体抗原的免疫反应等。
本实验采用将构建的 pAdtrack-CMV-TGF-β1质粒,采用脂质体转染脾细胞,获得稳定表达的TGF-β1基因修饰的脾细胞。TGF-β1转染组生存时间较长,监测术后第3、5、7天肝功能可发现基因修饰组肝脏功能在第5天时开始好转,第7天逐渐恢复,而移植组肝脏功能随着移植排斥反应加重而逐渐升高。在移植排斥反应过程中,发病过程主要是T细胞介导的免疫应答。TGF-β1在特异性免疫耐受中的作用主要通过对IL-2诱导的T细胞增殖活化发挥有效的负调节作用,影响T细胞生长因子受体、转铁蛋白受体的表达,抑制Rb蛋白磷酸化,诱导T细胞凋亡[13]。通过对肝脏细胞凋亡的检测可证实TGF-β1基因修饰的脾细胞组凋亡较其他组明显。有实验证明TGF-β1可导致肝细胞的凋亡,在肝移植出现急性排斥反应时,随着排斥反应增加,其表达增高,凋亡细胞数增加[14-15]。本研究结果表明随着TGF-β1基因的高表达,移植排斥反应减轻,凋亡细胞数增加,受体生存天数延长。
通过我们的研究,认为TGF-β1是一种有效的免疫抑制因子,通过基因修饰的方法,可以提高受体的生存时间,减轻免疫排斥反应,但其抑制免疫排斥的效果有限,具体的机制还需进一步研究,本实验以大鼠为模型,为基因治疗移植排斥反应提供了一种新方法,但能否应用于临床及可操作性需要进一步研究。
[1]Xia HS.Clinical transplantation[M].Hangzhou:Zhejiang Science and Technology Press,1999:150-191.夏穗生.临床移植医学[M].杭州:浙江科学技术出版社,1999:150-191.
[2]Zheng SS.Liver transplantation[M].Beijing:People’s Medical Publushing House,2001:1-2.郑树森.肝脏移植[M].北京:人民卫生出版社,2001:1-2.
[3]Juan FS,Miguel Q,Carmelo B.TGF-β/TGF-β receptor system and its role in physiological and pathological conditions[J].Clinical Science,2011,121(6):233-251.
[4]Kamada N,Calne RY.Orthotopic liver transplantation in therat.Technique using cuff for portal vein anastomosis and biliarydrainage [J].Transplantation,1979,28(1):47-50.
[5]Ma Y,He XS,Chen GH,et al.Surgical technique of the model of orthotopic liver transplantation and prevention of operatonal complication in rat[J].Chin J Micosurg,2003,26(1):45-47.马毅,何晓顺,陈规划,等.大鼠原位肝移植模型的手术技巧及并发症的预防[J].中华显微外科杂志,2003,26(1):45-47.
[6]Polyak K,Kato JY,Solomon MJ,et al.p27Kip1,a cyclin-Cdk inhibitor,Links transforming growth factor-beta and contact inhibition to cell cycle arrest[J].Genes Dev,1994,8(1):9-22.
[7]Eliopoulos N,Stagg J,Lejeune L,et al.Allogeneic marrow stromal cells are Immune rejected by MHC classⅠ-and classⅡ-mismatched recipient mice[J].Blood,2005,106(13):4057-4065.
[8]Lu LN,Lee WC,Takayama T,et al.Genet ic engineering of dendritic cells to express immunosuppressive molecules(viral IL-10,TGF-β1 and CTLA4Ig)[J].J Leu Biol,1999,66(2):293-307.
[9]Liu N,Duan TD,Zheng N.Effects of TGF-β1 gene modified donor dendritic cells on immune repulsion [J].J Sichuan Univ(Med Sci Edi),2006,37(5):721-725.刘宁,段体德,郑南.基因修饰树突状细胞对免疫排斥反应影响的研究[J].四川大学学报,2006,37(5):721-725.
[10]Qin L,Chvain KD,Ding Y,et al.Gene transfer for transplantation.Prolongation of allograft survival with transforming growth factor-beta1 [J].Transplantation,1994,220(4):508-518.
[11]Asderakis A,Sankaran D,Dyer P,et al.Association of polymorphisms in the human interferon-gamma and interleukin-10 gene with acute and chronic kidney transplant outcome:the cytokine effect on transplantation[J].Transplantation,2001,71(5):674-677.
[12]Narumoto K,Saibara T,Maeda T,et al.Transforming growth factorderived from biliary epithelial cells may attenuate al-loantigen-specifie immuneresponses[J].Transpl Int,2000,13(1):21-27.
[13]Meng QG,Yang Q,Li W,et al.TGF-β1 plasmid fresh allogenic nerve graft rejection reaction[J].Chin J Exp Surg,2010,27(10):1549-1550.孟庆刚,杨琪,李卫,等.转化生长因子-β1质粒对新鲜异体神经移植排斥反应的影响[J].中华实验外科杂志,2010,27(10):1549-1550.
[14]Borghi-Scoazec G,Scoazec JY,Durand F,et al.Apoptosis after ischemiareperfusion in human liver allografts[J].Liver Transpl Surg,1997,3(4):407-415.
[15]Hou N,Wen ZL,Li WM,et al.Relationship between hepatocellular apoptosis and rejection after liver transplantation[J].J Clin Exp Pathol,2003,19(6):633-636.侯宁,文载律,李为民,等.肝脏移植术后肝细胞凋亡与排斥反应的关系[J].临床与实验病理学杂志,2003,19(6):633-636.
