多孔细菌纤维素-聚乳酸乙醇酸-羟基磷灰石复合支架的制备及性能研究
2012-10-17姚志文王红忠李红玖程由勇李春华陈治清
姚志文 王红忠 蔡 琛 杨 安 刘 唯 李红玖 程由勇 李春华 陈治清
1.广州医学院附属深圳沙井医院口腔科,广东深圳 518104;2.四川大学华西口腔医学院口腔材料教研室,四川成都 610041
组织工程支架材料应用时,单一的材料往往难以同时满足生物体对其力学强度、亲水性、易成型性和生物相容性等多方面的要求,为了尽量同时满足这些要求,人们往往通过几种生物材料的组合来达到预期目的。基于这个思路,本课题选用细菌纤维素(bacterial cellulose,BC)、聚乳酸乙醇酸(poly lactic-co-glycolic acid,PLGA)和羟基磷灰石(HA)通过溶剂浇铸/粒子浸出法制备多孔BC-PLGA-HA复合支架,分析其相关理化性能,通过体外MG-63细胞培养,初步评价其体外生物相容性及在组织工程中的应用可行性。
1 仪器与试剂
1.1 主要仪器
电热恒温鼓风干燥箱(跃进医疗器械厂,上海),CO2培养箱(Sanyo,日本),LDZ5-2台式离心机(北京医用离心机厂),YJ-1450型超净工作台(苏净集团安泰公司,江苏),倒置相差显微照相系统(Olympus,日本),JSM-6360LV电子显微镜(EJOL,日本),HTS7000 plus多孔板紫外/荧光/可见光高效分析仪(PE,美国)。
1.2 主要试剂
高糖 DMEM 培养基(Gibco,美国),胎牛血清(Gibco,美国),胰蛋白酶(Gibco,美国),四甲基偶氮唑盐(MTT)(Sigma,美国),二甲基亚砜(Sigma,美国),乙二胺四乙酸(Sigma,美国),Braford蛋白含量检测试剂盒(南京凯基生物科技发展有限公司),碱性磷酸酶(Alkaline phosphatase,ALP)试剂盒(南京凯基生物科技发展有限公司),成骨样细胞MG-63(四川大学口腔疾病国家重点实验室)。
2 方法与结果
2.1 方法
2.1.1 多孔BC-PLGA-HA复合支架的制备
取1.0 g的PLGA和5 mL氯仿配成溶液,加入经过目筛的粒径为 100~200 μm 的 NaCl晶体 1.0 g和 HA 0.3 g,磁力搅拌和超声振动使其均匀分散。室温下将以上配好的PLGA溶液倒入底层铺有BC膜的玻璃皿中。静置24 h,干燥后PBS液反复漂洗,冷冻干燥后裁剪成直径5 mm圆片。25 kGy60Co照射24 h消毒灭菌。4℃保存备用。
2.1.2 多孔BC-PLGA-HA复合支架相关理化性能分析
2.1.2.1 表面形貌观察 多孔BC-PLGA-HA复合支架表面喷金后放置样品台进行扫描电镜观察。
2.1.2.2 抗张强度(δb)多孔BC-PLGA-HA复合支架裁剪成一定的形状,用千分尺测其厚度和宽度。使用万能电子拉力实验机进行测试,根据公式 δb=F/A(F:支架的最大拉力,A:支架的截面面积)计算出支架的抗张强度(δb)
2.1.2.3 孔隙结构测定 用乙醇装满一个小瓶记录重量为W1,支架称重记录为Ws,然后浸泡于该瓶乙醇中,支架的孔中都充满乙醇后,瓶子再加满乙醇,称重记录W2,然后把浸满乙醇的支架取出,剩余乙醇和小瓶称重记录为W3,ρ=0.79 kg/m3为乙醇的密度。根据以下公式计算孔隙率:
复合支架本身体积:Vs=(Wl+Ws-W2)/ρ
复合支架孔体积:Vp=(W2-W3-Ws)/ρ
复合支架孔隙率:ε=Vp/(Vs+Vp)=(W2-W3-Ws)/(W1-W3)
2.1.3 多孔BC-PLGA复合支架体外生物相容性分析
2.1.3.1 MG-3细胞在支架表面的形态学观察 MG-63细胞从冻存管复苏后培养换液,2.5 g/L胰酶常规传代,倒置相差显微镜下观察生长状态,选取生长良好的第3代细胞在24孔板内以2×105/mL的细胞浓度接种至多孔BC-PLGA-HA复合支架表面,置于37℃、体积分数为5%CO2恒温培养箱中进行培养,隔天换液。培养5 d后取出标本,2.5%戊二醛固定,梯度乙醇脱水,临界点干燥,样本表面喷金后电镜扫描观察。
2.1.3.2 MTT比色法检测细胞在支架材料表面的增殖 MG-3细胞在24孔板内以2×105/mL的细胞浓度接种至多孔BCPLGA-HA复合支架表面,培养1、3、5 d后各孔内分别加入MTT液100 μL,37℃孵育4 h。吸出孔内液体后每孔加入150 μL 二甲基亚砜(DMSO),振荡 10 min,吸取上清液用酶联免疫分光光度计 (490 nm)测定各孔光吸收值。同时以MG-3细胞直接接种于培养板底部作为对照组。
2.1.3.3 ALP活性检测 MG-3细胞在24孔板内以2×105/mL的细胞浓度接种至多孔BC-PLGA-HA复合支架表面,培养5 d后取相应样本,提取和制备支架材料上生长的全部细胞冻融液,参照ALP试剂盒和Braford试剂盒步骤测定细胞匀浆的中蛋白含量和ALP活性。同时以MG-3细胞直接接种于培养板底部作为对照组。结果进行统计学分析。
2.2 统计学方法
采用SPSS 13.0统计软件进行分析,对MTT实验所得数据采用重复测量数据方差分析法,对ALP检测所得数据采t检验,P<0.05为差异有统计学意义。
2.3 结果
2.3.1 多孔BC-PLGA-HA复合支架相关理化性能分析
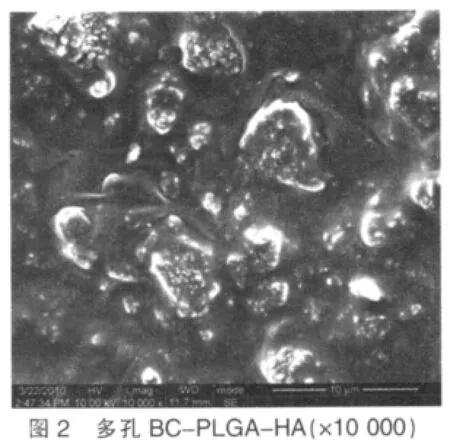
2.3.1.1 表面形貌观察 支架内部可见各种裂隙样或孔洞样的结构将材料分割为多孔的海绵状,孔大小为20~200 μm不等,部分孔表面可见覆盖膜样结构。10 000倍电镜下可见粒径约为几百纳米到几个微米形状不规则的HA分布在不平整的PLGA膜上。制备的多孔BC-PLGA-HA复合支架扫描电镜观察见图1、2。

2.3.1.2 抗拉强度结果 本实验制备的多孔BC-PLGA-HA复合支架的抗张强度测试结果为(8.923 1±0.901 2)N/mm2,理论上能够满足一定的组织工程支架力学的要求。
2.3.1.3 孔隙率测定 在测定支架的孔隙率时发现,所制备的多孔支架没有发生明显的溶胀现象,保持了原来的大小和形貌。本实验制备的多孔BC-PLGA-HA复合支架的孔隙率测定结果为(64.73±5.65)%,提示所得支架具有较好的内部贯通结构。
2.3.2 多孔BC-PLGA复合支架体外生物相容性分析
2.3.2.1 MG-3在支架表面的形态学观察 培养5 d后有一定数量的细胞黏附在复合支架表面并开始增殖(图3),细胞与支架表面贴壁紧密,细胞间以伪足连接,已达到一定程度的汇合,胞体丰满,折光较为明显,部分细胞已经深入到材料表面裂隙中生长。
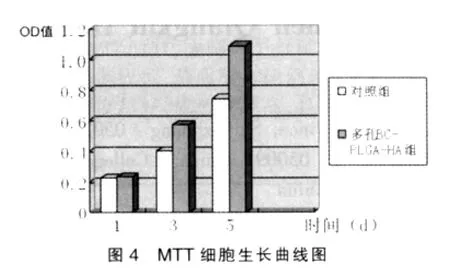
2.3.2.2 MG-3在支架材料上的增殖活性检测 重复测量方差分析结果显示,不同实验组差异有统计学意义(P<0.001);不同时间组差异有统计学意义(P<0.001);其中,第1天多孔BC-PLGA-HA组和空白对照组间光密度值差异无统计学意义(P=0.217),第 3、5天多孔 BC-PLGA-HA 组的光密度值均高于对照组(P<0.005),差异有统计学意义,提示MG-3细胞在多孔BC-PLGA-HA支架材料表面具有更强的增殖活性。MTT法测定多孔BC-PLGA-HA组和对照组细胞的成活和增殖能力结果见图4。

2.3.2.3 MG-3在支架材料上的ALP活性检测 MG-63细胞在多孔BC-PLGA-HA组和对照组培养基中生长5 d后,测定ALP表达,结果显示,多孔BC-PLGA-HA组高于对照组,差异有统计学意义(t=4.207,P<0.05),表明多孔 BC-PLGA-HA复合支架材料更有利于成骨细胞生长分化和成骨活性的表达。见表1。
表1 成骨样细胞MG-63的蛋白浓度和碱性磷酸酶活性(±s,n=4)
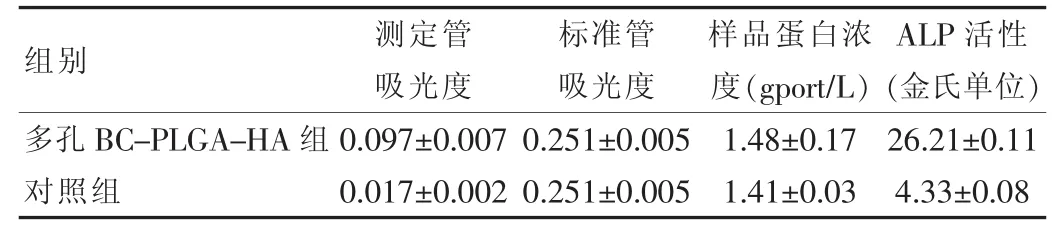
表1 成骨样细胞MG-63的蛋白浓度和碱性磷酸酶活性(±s,n=4)
组别 测定管吸光度标准管吸光度样品蛋白浓度(gport/L)ALP活性(金氏单位)多孔BC-PLGA-HA组对照组0.097±0.007 0.017±0.002 0.251±0.005 0.251±0.005 1.48±0.17 1.41±0.03 26.21±0.11 4.33±0.08
3 讨论
生物支架是组织工程重要要素之一,对种子细胞起到支撑和模板作用,是其附着的基本框架和代谢场所,支架的孔结构形状、尺寸大小和孔隙率对细胞的黏附、增殖和分化有着很重要的影响,但具体多大孔径为最佳目前尚未有统一的说法,Freyman等[1]认为孔径为 100~200 μm 较适合细胞生长。此外支架的高孔隙率(>90%)和相互贯穿的孔形态有利于细胞的种植生长、营养物质的传输以及血管和神经的内生长,但孔径和孔隙度的[2]增加同时会降低支架的生物力学强度。
支架材料种类的选择和制备方法对支架性能的影响有着重要的影响。本课题将BC、PLGA和HA三种材料通过溶液浇铸/粒子沥滤法制备多孔BC-PLGA-HA复合支架,基于如下考虑:(1)溶液浇铸/粒子沥滤法是较为成熟的制备可控孔径多孔生物支架的方法[3];(2)HA中有接近正常骨组织钙/磷比,同时具有良好的骨传导性[4];(3)PLGA降解后在局部积聚的酸性代谢物容易引起无菌性炎症发生。HA表面溶解后呈弱碱性,能够缓冲或中和PLGA降解产生的酸[5];(4)BC有着良好的理化性能[6-7]:①具有厚度为3~8 nm的纳米级超细纤维,大小仅为人工合成纤维的1/10;②具有高抗张强度和弹性模量,扬氏模量可达1.5×1010Pa,抗撕能力比聚乙烯膜和聚氯乙烯膜要强5倍;③具有良好的持水性和透气性能,内部有很多“孔道”使其能吸收60~700倍于其干重的水份。预期BC的加入可以补偿材料因降解过程中产生的物理机械性能下降,从而使复合支架在修复功能区和负荷区时可以较长时间地保持良好的力学性能。本课题选用粒径为100~200 μm的造孔剂,扫描电镜观察制备的多孔BC-PLGA-HA复合支架呈多孔状结构,孔形状略不规则,大小20~200 μm不等,孔的形状可能和造孔剂形状相关,出现部分较小孔径原因可能是在筛选造孔剂时混杂有小部分更小尺寸造孔剂所造成。高倍率下可见粒径不等的HA散在支架孔的底部。
抗拉强度和孔隙率是衡量生物材料理化性能的两个重要指标。材料断裂前所达到的最大应力值称为抗拉强度,它可以代表材料的部分力学性能。孔隙率和材料的亲水性相关,通常孔隙率越高,材料的吸水率就越高,生物相容性就越高。本课题所制备的多孔BC-PLGA-HA复合支架孔隙率为(64.73±5.65)%,抗拉强度(8.923 1±0.901 2)N/mm2,能够同时具有较高的力学强度和孔隙率,高强度可能来源于BC的本身的优良物理机械性能和支架制备时PLGA溶液渗透入BC内部立体网状结构并与其牢固结合有关,高孔隙率可能和BC本身的高亲水性和支架的多孔结构有关。因此有望用于修复人体功能和负荷区。
本实验将成骨样细胞MG-3植于多孔BC-PLGA-HA复合支架上体外培养5天后电镜扫描结果显示:细胞能够紧密黏附并有所伸展,达到一定程度的汇合并已开始增值,表明细胞生长状况良好。MTT检测结果显示培养1 d后多孔BCPLGA-HA组与对照组组间数值差异无统计学意义(P>0.05),可能是因为在接种早期MG-3细胞处于潜伏适应期,支架材料对其增殖的影响作用尚未发生;培养3~5 d,多孔BC-PLGAHA组细胞增殖速度明显快于对照组,差异有统计学意义(P<0.05)。在培养5 d后测量MG-3细胞内ALP的活性发现:多孔BC-PLGA-HA组细胞内的ALP的合成量明显高于对照组。说明多孔BC-PLGA-HA复合支架更有利于MG-3细胞的增殖和成骨分化。
综上所述,本课题采用溶剂浇铸法制备的多孔BC-PLGAHA复合支架具有良好的力学性能、孔隙率和生物相容性,有望作为修复功能区和负载区的生物材料,为组织工程支架材料提供新的选择和思路。针对缺点与不足,实验在支架的制备、理化性能和生物相容性方面进行了初步的探讨,有关复合支架其他相关性能、支架成分对支架本身性能的影响等方面内容,还需要进更多的实验来进行分析和讨论。
[1]Freyman TM,Yannas IV,Gibson LG.Cellular materials as porous scaffolds for tissue engineering[J].Progress in materials science,2001,46:273-282.
[2]Chang BS,Lee CK,Hong KS,et al.Osteoconduction at porous hydroxyapatite with various pore configurations[J].Biomaterials,2000,21(12):1291-1298.
[3]Mikos AG,Sarakinos G,Vacanti JP,et al.Biocompatible Polymer Membranes and methods of preparation of three dimensional membrane structures[J].United States Patent,1996:122.
[4]Legeros RZ.Properties of osteoconductive biomaterials:calcium phosphates[J].Clin Orthop,2002,395(2):81-98.
[5]Rezwan K,Chen QZ,Blaker JJ.Biodegradable and bioactive porous polymer/inorganic compositese scaffolds for bone tissue engineering[J].Biomaterials,2006,27(18):3413-3431.
[6]Henrik B,Bo R,Paul G.Observations on bacterial cellulose tube formation for application as vascular graft[J].Carbohydrate Polymers,2011,31(1):14-21.
[7]Magdalena Z,Aase B,Henrik B,et al.Microporous bacterial cellulose as a potential scaffold for bone regeneration[J].Acta Biomaterialia,2010,6(7):2540-2547.
